河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 453.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-24 11:21:06 | ||
图片预览



文档简介
遵化市2020—2021学年度第一学期期中考试
高二化学试卷
本试卷分第I卷和第II卷,第I卷为选择题,共40分,第II卷为非选择题,共60分,满分100分,考试时间为90分钟。将第I卷选择题的答案涂在答题卡中。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
第I卷(选择题,共40分)
一、选择题(本题共10小题,共20分,每小题只有一个选项符合题意。)
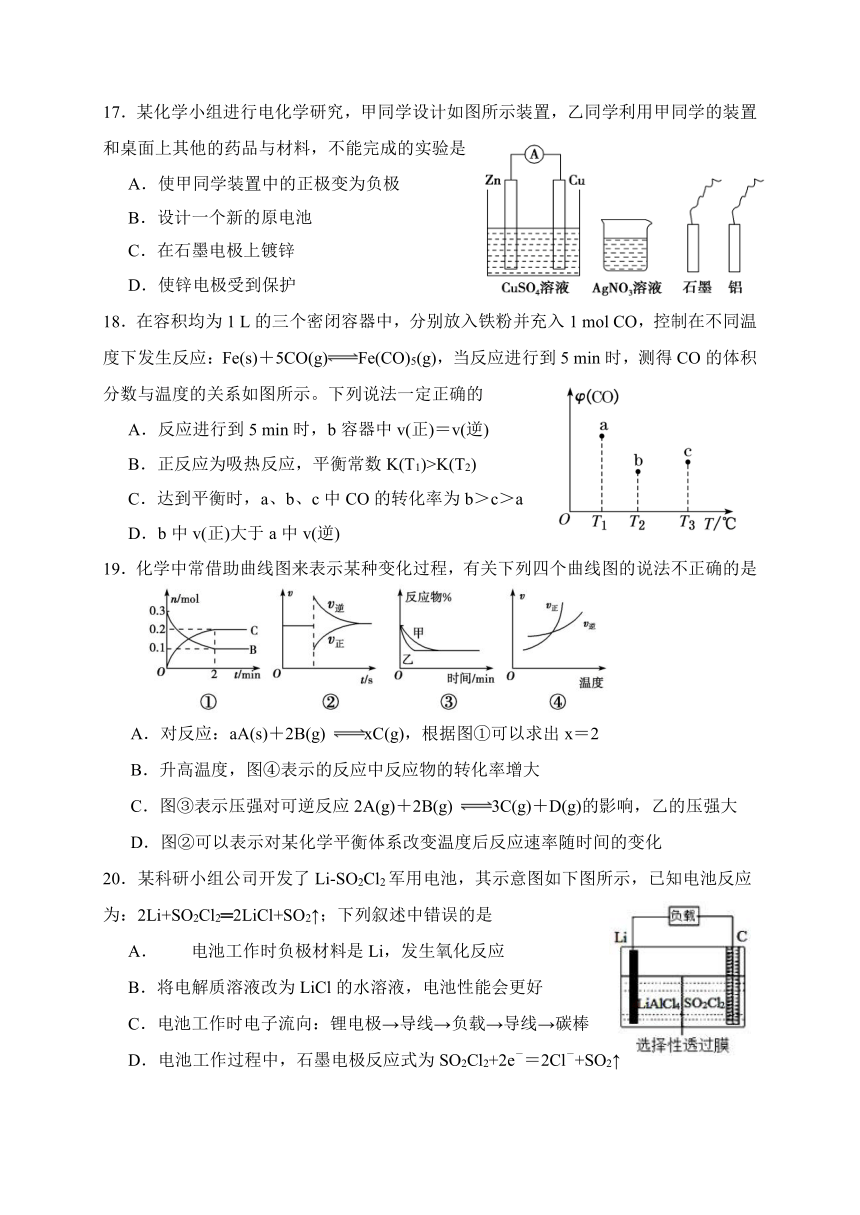
1.科幻片《流浪地球》中有个画面,冰原上是身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人类就被冻僵,该装置提供电能,并将电能转化为
A.化学能 B.热能 C.生物质能 D.动能
2.摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.生石灰 B.氯化钠 C.固体氢氧化钠 D.固体硝酸铵
3.升高温度能加快反应速率的主要原因是
A.活化分子能量明显增加 B.降低了反应所需的能量
C.增加了活化分子的百分数 D.改变了反应物的本身性质
4.在密闭容器中发生反应:C(s)+CO2(g)2CO(g),下列说法不正确的是
A.该反应达到平衡后将碳块磨成粉末可以使平衡右移
B.升高温度正逆反应速率均加快
C.容器体积不变时,向其中充入N2,反应速率不变
D.增加碳的质量不能加快反应速率
5.下列说法正确的是
A.铅蓄电池放电时,正极与负极质量均增加
B.手机、电脑中使用的锂电池属于一次电池
C.二次电池充电时,正极与外接电源的负极相连
D.燃料电池工作时,燃料在电池中燃烧,热能转化为电能
6.H2与O2发生反应的过程用模型图示如下。下列说法不正确的是
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
7.下列说法正确的是
A.同温同压下,H2(g)+Cl2(g) == 2HCl(g)在光照和点燃条件下的△H相同
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
C.在加热条件下发生的反应均为吸热反应
D.物质发生化学反应时不一定都伴随着能量变化
8.体积相同的甲乙两容器中,分别充有等量的SO2和O2。在相同温度下发生反应2SO2+O22SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.等于p% B.大于p% C.小于p% D.无法判断
9.用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态
A.CuSO4 B.CuO C.Cu(OH)2 D.CuSO4·5H2O
10.已知:CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是
温度/℃ 400 500 830 1000
平衡常数K 10 9 1 0.6
A.该反应的正反应是吸热反应
B.830 ℃时,反应达到平衡,一定是c(CO) == c(CO2)
C.恒温时减小容器体积增大压强,正反应速率增大,平衡不移动
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大
11.一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应生成另外两种气体,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A.该反应的化学方程式为3B(g)+4D(g)6A(g)+2C(g)
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
12.已知某可逆反应m A(g)+n B(g)p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
A.T1p2 m+n>p 放热反应
B.T1>T2 p1p 吸热反应
C.T1p2 m+nD.T1>T2 p113.某反应由两步反应A→B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
14.在1 L恒定容积的密闭容器中,可以证明可逆反应N2(g)+3H2(g)2NH3(g)已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.v正(N2)=2v逆(NH3)
C.其他条件不变时,混合气体的密度不再改变
D.一个N≡N键断裂的同时,有3个H—H键生成
15.下列不能用平衡移动原理解释的是
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
16.过量的铁粉与100mL 0.01mol·L﹣1的稀盐酸反应。为了减慢反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③将盐酸用量减半,浓度不变 ④加CuO固体
⑤加NaCl溶液 ⑥加入硝酸钾溶液 ⑦降低温度(不考虑盐酸挥发)
A.①⑤⑦ B.①⑤⑥⑦ C.③⑦ D.②④⑥
17.某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是
A.使甲同学装置中的正极变为负极
B.设计一个新的原电池
C.在石墨电极上镀锌
D.使锌电极受到保护
18.在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的
A.反应进行到5 min时,b容器中v(正)=v(逆)
B.正反应为吸热反应,平衡常数K(T1)>K(T2)
C.达到平衡时,a、b、c中CO的转化率为b>c>a
D.b中v(正)大于a中v(逆)
19.化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是
A.对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B.升高温度,图④表示的反应中反应物的转化率增大
C.图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
20.某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑;下列叙述中错误的是
A.电池工作时负极材料是Li,发生氧化反应
B.将电解质溶液改为LiCl的水溶液,电池性能会更好
C.电池工作时电子流向:锂电极→导线→负载→导线→碳棒
D.电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
遵化市2020—2021学年度第一学期期中考试
高二化学试卷
题号 21 22 23 24 25 总分
得分
第Ⅱ卷(非选择题,共60分)
二、填空题(本题共5道题,共60分)
得分 评卷人
? ?
21.(9分)依据氧化还原反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)设计的原电池如下图所示。请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是
__________________。
(2)铜电极为电池的________极,发生的电极反应为
____________________,X极上发生的电极反应为
。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
得分 评卷人
? ?
22.(9分)在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为 ,此温度下的平衡常数K=________。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比将________(填“增大”、“减小”或“不变”)。
(4)当增加A浓度,B的转化率________;若将C分离出来,化学平衡常数________。(填“增大”、“减小”或“不变”)
得分 评卷人
? ?
23.(12分)现在和将来的社会,对能源和材料的需求是越来越
大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 。
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.①③⑤⑥⑦⑧
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______。
(3)已知:H—H键的键能为436KJ/mol,H—N键的键能为391KJ/mol,根据化学方程式:N2+3H22NH3 ΔH=-92.4KJ/mol,
①请计算出N≡N键的键能为_______________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量__________92.4KJ(填“大于”或“小于”或“等于”)。
得分 评卷人
? ?
24.(12分) 中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从实验装置看,其中尚缺少的一种玻璃用品是__________,
除此之外,装置中的一个明显错误是_____________,烧杯
间填满碎纸条的作用是 。
(2)若改用60mL 0.25mol·L--1 H2SO4和50mL 0.55mol·L--1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
温度 实验次数 起始温度t1℃ 终止温度t2/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 29.5
2 27.0 27.4 27.2 32.3
3 25.9 25.9 25.9 29.2
4 26.4 26.2 26.3 29.8
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
得分 评卷人
? ?
25.(18分)
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应 2A(g)+ B(g)3C(g) ΔH>0,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。
图1 图2
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
t1~t2 t2~t3 t3~t4 t4~t5 t5~t6
K1 K2 K3 K4 K5
则K1=_______,K1、K2、K3、K4、K5之间的关系为
(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:2A(g)+ B(g)3C(g) ΔH,用含有a的代数式表达 ΔH = _________。
(4)在相同条件下,若起始时容器中加入4mol A、2 mol B和1.2 mol C,达到平衡时,体系中C的百分含量________t1时刻C的百分含量(填“大于”“小于”“等于”)。
(5)①能说明该反应已达到平衡状态的是________。
a.v(A)=2v(B) b.容器内压强保持不变
c.2v逆(c)=3v正(A) d.容器内密度保持不变
②为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出C气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
遵化市2020—2021学年度第一学期期中考试
高二化学答案
一、选择题(本题共10小题,共20分,每小题只有一个选项符合题意。)
1-5 BDCAA 6-10 DABBC 11-15 CDBDB 16-20 ACDDB
二、填空题(本题共5道题,共60分)
21.(9分,每空1分)
(1)Zn (2)CuSO4溶液或CuCl2溶液 (3)正极 (4)Cu2+?+?2e-?=Cu
(5)Zn?-2e-?=Zn2+ (6)锌 (7)铜 (8)锌 (9)不
22.(9分)
(1)60% 8.33或 (各2分) (2)正反应方向移动(1分) (3)不变(2分)
(4)增大 不变(各1分)
23.(12分)
(1)C;(2分)
(2)①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ·mol-1;(3分)
②△H=124.2kJ·mol-1 (3分)
(3)①945.6KJ/mol;(2分)②小于;(2分)
24.( 12分,每空2分)
(1)环形玻璃搅拌棒 小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高) 减少实验中的热量损失(2)不相等 (3)-56.8kJ/mol (4)a b c
25.(18分,每空2分)
(1)0.02 mol?L?1?min?1 (2)减小压强 1mol 0.84 K1 = K2 = K3 = K4(3)+200a kJ?mol-1 (4)等于 (5) c bc
高二化学试卷
本试卷分第I卷和第II卷,第I卷为选择题,共40分,第II卷为非选择题,共60分,满分100分,考试时间为90分钟。将第I卷选择题的答案涂在答题卡中。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
第I卷(选择题,共40分)
一、选择题(本题共10小题,共20分,每小题只有一个选项符合题意。)
1.科幻片《流浪地球》中有个画面,冰原上是身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人类就被冻僵,该装置提供电能,并将电能转化为
A.化学能 B.热能 C.生物质能 D.动能
2.摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.生石灰 B.氯化钠 C.固体氢氧化钠 D.固体硝酸铵
3.升高温度能加快反应速率的主要原因是
A.活化分子能量明显增加 B.降低了反应所需的能量
C.增加了活化分子的百分数 D.改变了反应物的本身性质
4.在密闭容器中发生反应:C(s)+CO2(g)2CO(g),下列说法不正确的是
A.该反应达到平衡后将碳块磨成粉末可以使平衡右移
B.升高温度正逆反应速率均加快
C.容器体积不变时,向其中充入N2,反应速率不变
D.增加碳的质量不能加快反应速率
5.下列说法正确的是
A.铅蓄电池放电时,正极与负极质量均增加
B.手机、电脑中使用的锂电池属于一次电池
C.二次电池充电时,正极与外接电源的负极相连
D.燃料电池工作时,燃料在电池中燃烧,热能转化为电能
6.H2与O2发生反应的过程用模型图示如下。下列说法不正确的是
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
7.下列说法正确的是
A.同温同压下,H2(g)+Cl2(g) == 2HCl(g)在光照和点燃条件下的△H相同
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
C.在加热条件下发生的反应均为吸热反应
D.物质发生化学反应时不一定都伴随着能量变化
8.体积相同的甲乙两容器中,分别充有等量的SO2和O2。在相同温度下发生反应2SO2+O22SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.等于p% B.大于p% C.小于p% D.无法判断
9.用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态
A.CuSO4 B.CuO C.Cu(OH)2 D.CuSO4·5H2O
10.已知:CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是
温度/℃ 400 500 830 1000
平衡常数K 10 9 1 0.6
A.该反应的正反应是吸热反应
B.830 ℃时,反应达到平衡,一定是c(CO) == c(CO2)
C.恒温时减小容器体积增大压强,正反应速率增大,平衡不移动
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大
11.一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应生成另外两种气体,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A.该反应的化学方程式为3B(g)+4D(g)6A(g)+2C(g)
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
12.已知某可逆反应m A(g)+n B(g)p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
A.T1
B.T1>T2 p1
C.T1
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
14.在1 L恒定容积的密闭容器中,可以证明可逆反应N2(g)+3H2(g)2NH3(g)已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.v正(N2)=2v逆(NH3)
C.其他条件不变时,混合气体的密度不再改变
D.一个N≡N键断裂的同时,有3个H—H键生成
15.下列不能用平衡移动原理解释的是
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
16.过量的铁粉与100mL 0.01mol·L﹣1的稀盐酸反应。为了减慢反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③将盐酸用量减半,浓度不变 ④加CuO固体
⑤加NaCl溶液 ⑥加入硝酸钾溶液 ⑦降低温度(不考虑盐酸挥发)
A.①⑤⑦ B.①⑤⑥⑦ C.③⑦ D.②④⑥
17.某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是
A.使甲同学装置中的正极变为负极
B.设计一个新的原电池
C.在石墨电极上镀锌
D.使锌电极受到保护
18.在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的
A.反应进行到5 min时,b容器中v(正)=v(逆)
B.正反应为吸热反应,平衡常数K(T1)>K(T2)
C.达到平衡时,a、b、c中CO的转化率为b>c>a
D.b中v(正)大于a中v(逆)
19.化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是
A.对反应:aA(s)+2B(g) xC(g),根据图①可以求出x=2
B.升高温度,图④表示的反应中反应物的转化率增大
C.图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
D.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
20.某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑;下列叙述中错误的是
A.电池工作时负极材料是Li,发生氧化反应
B.将电解质溶液改为LiCl的水溶液,电池性能会更好
C.电池工作时电子流向:锂电极→导线→负载→导线→碳棒
D.电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
遵化市2020—2021学年度第一学期期中考试
高二化学试卷
题号 21 22 23 24 25 总分
得分
第Ⅱ卷(非选择题,共60分)
二、填空题(本题共5道题,共60分)
得分 评卷人
? ?
21.(9分)依据氧化还原反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)设计的原电池如下图所示。请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是
__________________。
(2)铜电极为电池的________极,发生的电极反应为
____________________,X极上发生的电极反应为
。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
得分 评卷人
? ?
22.(9分)在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为 ,此温度下的平衡常数K=________。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比将________(填“增大”、“减小”或“不变”)。
(4)当增加A浓度,B的转化率________;若将C分离出来,化学平衡常数________。(填“增大”、“减小”或“不变”)
得分 评卷人
? ?
23.(12分)现在和将来的社会,对能源和材料的需求是越来越
大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 。
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.①③⑤⑥⑦⑧
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______。
(3)已知:H—H键的键能为436KJ/mol,H—N键的键能为391KJ/mol,根据化学方程式:N2+3H22NH3 ΔH=-92.4KJ/mol,
①请计算出N≡N键的键能为_______________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量__________92.4KJ(填“大于”或“小于”或“等于”)。
得分 评卷人
? ?
24.(12分) 中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从实验装置看,其中尚缺少的一种玻璃用品是__________,
除此之外,装置中的一个明显错误是_____________,烧杯
间填满碎纸条的作用是 。
(2)若改用60mL 0.25mol·L--1 H2SO4和50mL 0.55mol·L--1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
温度 实验次数 起始温度t1℃ 终止温度t2/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 29.5
2 27.0 27.4 27.2 32.3
3 25.9 25.9 25.9 29.2
4 26.4 26.2 26.3 29.8
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
得分 评卷人
? ?
25.(18分)
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应 2A(g)+ B(g)3C(g) ΔH>0,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。
图1 图2
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
t1~t2 t2~t3 t3~t4 t4~t5 t5~t6
K1 K2 K3 K4 K5
则K1=_______,K1、K2、K3、K4、K5之间的关系为
(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:2A(g)+ B(g)3C(g) ΔH,用含有a的代数式表达 ΔH = _________。
(4)在相同条件下,若起始时容器中加入4mol A、2 mol B和1.2 mol C,达到平衡时,体系中C的百分含量________t1时刻C的百分含量(填“大于”“小于”“等于”)。
(5)①能说明该反应已达到平衡状态的是________。
a.v(A)=2v(B) b.容器内压强保持不变
c.2v逆(c)=3v正(A) d.容器内密度保持不变
②为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出C气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
遵化市2020—2021学年度第一学期期中考试
高二化学答案
一、选择题(本题共10小题,共20分,每小题只有一个选项符合题意。)
1-5 BDCAA 6-10 DABBC 11-15 CDBDB 16-20 ACDDB
二、填空题(本题共5道题,共60分)
21.(9分,每空1分)
(1)Zn (2)CuSO4溶液或CuCl2溶液 (3)正极 (4)Cu2+?+?2e-?=Cu
(5)Zn?-2e-?=Zn2+ (6)锌 (7)铜 (8)锌 (9)不
22.(9分)
(1)60% 8.33或 (各2分) (2)正反应方向移动(1分) (3)不变(2分)
(4)增大 不变(各1分)
23.(12分)
(1)C;(2分)
(2)①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ·mol-1;(3分)
②△H=124.2kJ·mol-1 (3分)
(3)①945.6KJ/mol;(2分)②小于;(2分)
24.( 12分,每空2分)
(1)环形玻璃搅拌棒 小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高) 减少实验中的热量损失(2)不相等 (3)-56.8kJ/mol (4)a b c
25.(18分,每空2分)
(1)0.02 mol?L?1?min?1 (2)减小压强 1mol 0.84 K1 = K2 = K3 = K4
同课章节目录
