化学:3.3《盐类的水解》课件(新人教版选修4)
文档属性
| 名称 | 化学:3.3《盐类的水解》课件(新人教版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 396.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-30 00:00:00 | ||
图片预览










文档简介
(共33张PPT)
第三节 盐类的的水解
新民市高中 化学组
酸的水溶液呈酸性;
碱的水溶液呈碱性;
盐的水溶液的酸碱性如何呢?
想一想:
实验是科学之父
用pH试纸分别测量下列溶液的pH值:
(1) NaCl溶液
(2) Na2CO3溶液
(3) NaHCO3溶液
(4)NH4Cl溶液
(5) Na2SO4溶液
(6) CH3COONa溶液
(7) (NH4)2SO4溶液
思考:
NaAc溶液为何显碱性?
CH3COONa
= CH3COO- + Na+
H2O
H+ + OH-
C(H+ )=C(OH-)
加CH3COONa:
CH3COOH
C(H+ )﹤C(OH-)
CH3COONa + H2O CH3COOH+NaOH
离子方程式 CH3COO- +H2O CH3COOH+OH-
碱 性
请同学们按照前面同样的方法分析NH4Cl溶液为什么显酸性?
H2O OH- + H+
NH4Cl = NH4+ + Cl -
NH3·H2O
离子方程式 NH4+ +H2O NH3·H2O + H+
在 NH4Cl 溶液中:
NH4Cl + H2O NH3·H2O + H Cl
在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
一、盐类的水解
1. 定义:
增大了水的电离程度,使得盐溶液呈现出一定的酸碱性。
2. 实质:
思考: KNO3、NaCl能水解吗?为什么?
你根据实验结果,能找出盐水解之后显什么性的规律吗?
根据实验比较CH3COONa和Na2CO3水解后碱性的强弱及NH4Cl 和Al2(SO4)3水解后酸性的强弱,你能找出比较盐水解程度大小的规律吗?
比较同条件下Na2CO3和NaHCO3水解后碱性的强弱,并写出水解的离子方程式。
NH4Ac能水解吗?
是哪些离子水解?
3、水解规律:
有弱才水解
谁弱谁水解
越弱越水解
谁强显谁性
同强显中性(NH4Ac)
都弱都水解
盐类水解方程式的书写规律
1. 盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2. 多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二步水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,溶液碱性谁强。通常写第一步水解。
3. 多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
2. 判断下列盐溶液的酸碱性:
(1)KF (2) NH4NO3
(3)Na2SO4 (4)CuSO4
1. 写出下列物质水解的离子反应方程式:
(1) CH3COONa溶液 (2) Na2CO3溶液
(3) NH4Cl溶液 (4)Al2(SO4)3溶液
3. 比较同条件下CH3COONa和Na2CO3溶液
的碱性的强弱
二、影响盐类水解平衡的因素
1.内因:水解的离子结合H+或OH-的能力
(酸碱越弱越水解)
例:比较下列各组物质的溶液在同条件下 pH值的大小: (1)Na2CO3和NaHCO3 (2)Na2S和NaHS (3)NaH2PO4,Na2HPO4和Na3PO4
练习:浓度为0.1mol/L的下列几种溶液:NaHSO4, Na2CO3,NaHCO3, CH3COONa, CH3COOH,NH4Cl ,pH由小到大顺序为__________________。
2. 外 因——化学平衡移动原理
(1)温度
盐+水 酸+碱
中 和
水 解
——温度越高越水解.
(水解是吸热反应)
(2)浓度
——浓度越稀越水解.
稀释使水解平衡正向移动,但由于加水溶液体积增大,溶液的酸性或者碱性减弱。
(3)加入物质
一般酸可抑制阳离子水解,促进阴离子水解;
碱可抑制阴离子水解,促进阳离子水解。
条 件
移动方向
H+数
pH
Fe3+水解率
现 象
升温
加水稀释
通HCl
加Fe粉
加NaHCO3
填表:Fe3++3H2O Fe(OH)3+3H+
颜色变深
颜色变浅
颜色变浅
颜色变浅
红褐↓,无色↑
三、双水解
常见的、典型的双水解反应:
Al3+
HCO3-
CO32-
S2-
AlO2-
HS-
SO32-
HSO3-
Fe3+
HCO3-
CO32-
AlO2-
AlO2-
SiO32-
NH4+
双水解能进行到底的条件:
2. 生成的碱或酸的溶解度比其盐(或生成盐)的要小得多
1. 弱酸弱碱盐(强酸弱碱盐+弱酸强碱盐溶液)
AlO2-
Cu2+
NH4+
Fe3+
Al3+
Mg2+
练习:下列离子在溶液中能大量共存的是
A. Na+ 、 H2PO4-、HPO42-、Cl-
B. NH4+、H2PO4-、PO43-、 NO3-
C. Fe3+ 、 Na+ 、 ClO- 、 Cl-
D. AlO2-、Al3+、 H+ 、 Cl-
常见的双水解反应有(盐与盐在溶液中反应):
Al3++3HCO3-=Al(OH)3↓+3CO2↑(泡沫灭火机)
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
Al3++3AlO2-+6H2O=4Al(OH)3↓
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO
实验:热水配制CuCl2溶液
热水:升温能够促进水解
实验现象:溶液出现浑浊
原因:
CuCl2+2H2O Cu(OH)2+2HCl
或Cu2++2H2O Cu(OH)2+2H+
配制CuCl2溶液,为防止出现浑浊,应加少量的
_______
稀盐酸
思考:用热水配制硫酸铁溶液时,为什么会产生混浊?怎样才能用热水配制出澄清的硫酸铁溶液?
[小结]:配制易水解的金属盐溶液应加少量的______________
配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。
同种酸。
四、配制易水解的盐溶液时,
需考虑抑制盐的水解
在配制FeCl3(SnCl2等)溶液时,为了防止水解而使溶液变浑浊,故先将FeCl3溶于稀盐酸中,再加水至所需刻度。
同样:如何配制硫酸铜溶液?
思考:配制FeCl2溶液时哪些注意点?
五、加热蒸发可水解的盐溶液
例:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3.为什么?
△
2Fe(OH)3 = Fe2O3 + 3H2O
FeCl3+3H2O Fe(OH)3+3HCl
⑴加热促进水解 ⑵HCl挥发
思考:Al2(SO4)3溶液加热蒸发后得到固体是什么?
尽管Al3+水解生成Al(OH)3和H2SO4,但由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。
3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O
六.某些活泼金属与水解显酸性盐溶液的反应
【实验】 把Mg粉放入NH4Cl溶液
实验现象:剧烈反应有气体放出,有刺激性气味
[思考]检验NH3方法?
检验结果:湿润的红色的石蕊试纸变蓝,说明刺激性气味的气体是NH3 。
用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒
NH4++H2O NH3 H2O + H+
Mg+ 2H+ = Mg2+ + H2↑
△
NH3 H2O = NH3 ↑ + H2O
七、热纯碱水去油污能力强:
在碱性条件下去油污能力强
CO32-+H2O HCO3- +OH- __ Q
HCO3-+H2O H2CO3 +OH- __Q
[生活常识] 为什么用肥皂洗衣服时用温水比冷水洗得干净一些?
肥皂主要成分:硬脂酸钠(C17H35COONa)
硬脂酸(C17H35COOH)是一种一元弱酸
C17H35COO-+H2O C17H35COOH+OH- -Q
农业谚语 :
“灰混粪,粪混灰,灰粪相混损肥分。”
思考:为什么会损肥分
[实验] 饱和K2CO3(草木灰的主要成分)溶液和NH4Cl晶体混合
八、草木灰不宜与铵态氮肥混合施用:
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
双水解
灭火器原理
塑料筒里面放入的什么是药品?
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
药品:Al2(SO4)3溶液、NaHCO3溶液
九、泡沫灭火器的原理应用双水解
Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑;
当矾与碱放入水中时,它们之间会发生化学变化,产生大量CO2和絮状物。与面合在一起时,絮状物Al(OH)3与面产生膜状物,将CO2气体包住。油条放入热油锅中, CO2受热膨胀,使油条胀大。这就是炸油条要放矾、碱的原因。但其间的配比一定要掌握好,明矾多了,水解产生的Al(OH)3就多,使油条遇热产生硬、脆、多泡现象,而且耗油量大。若碱放多了,则会使油条颜色发黄,增加其苦涩味。矾与碱之比以2.5:3.5较为合适。
炸油条或油饼时必须要放明矾与纯碱
练习:
1. 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,产生碱性的原因(用离子方程式表示)_______________________, 施用适量石膏可降低盐碱地的碱性,表示其反应原理的离子方程式__________________.
CO32-+H2O HCO3-+OH-
Ca2+ + CO32- = CaCO3↓
2.(上海高考)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3 C. MgSO4 D. KMnO4
C
3. SnCl2溶液易水解,实验室应如何保存?
实验室保存SnCl2是向其中加入少量的稀盐酸
(抑制水解)和少量的金属锡(+2价的锡
不稳定,这样可以防止被氧化)
Sn4+ + Sn = 2Sn2+
SnCl2+2H2O Sn(OH)2+2HCl
4. 下列溶液加入金属镁可以产生H2的是( )
CH3COOH B. NaHCO3
C. NH4Cl D. NaClO
AC
5. 下列离子方程式正确的是( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. NH4++H2O = NH3·H2O+ H+
C. CO32-+H2O H2CO3+OH-
D. HCO3-+H2O H2CO3 +OH-
D
6. 为什么不能从溶液中直接制取Al2S3
因Al3+、S2-均能水解,Al3+水解使溶液呈酸性,S2-水解使溶液呈碱性。如Al3+、S2-在同一溶液中,它们将相互促进水解而使水解完全,从而得不到Al2S3。
第三节 盐类的的水解
新民市高中 化学组
酸的水溶液呈酸性;
碱的水溶液呈碱性;
盐的水溶液的酸碱性如何呢?
想一想:
实验是科学之父
用pH试纸分别测量下列溶液的pH值:
(1) NaCl溶液
(2) Na2CO3溶液
(3) NaHCO3溶液
(4)NH4Cl溶液
(5) Na2SO4溶液
(6) CH3COONa溶液
(7) (NH4)2SO4溶液
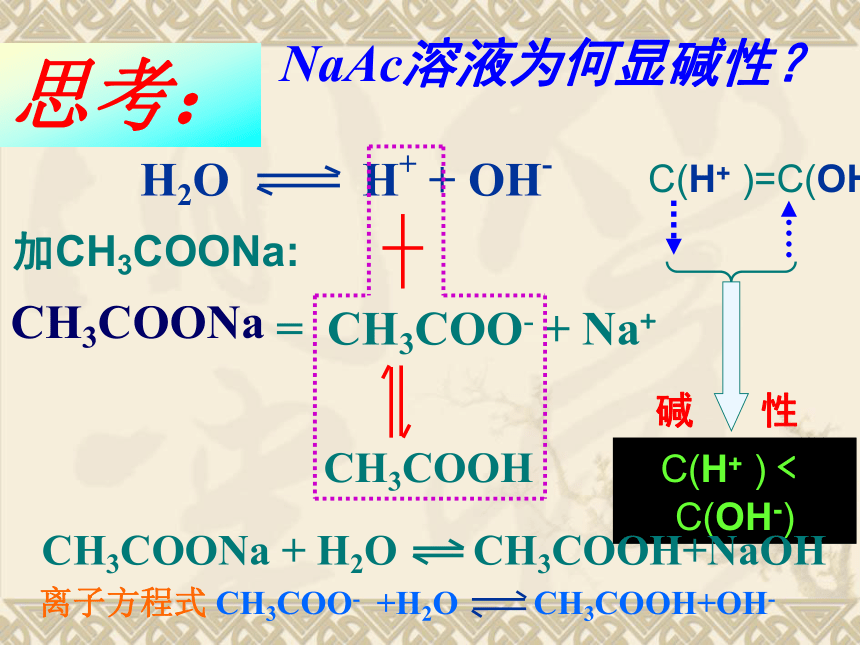
思考:
NaAc溶液为何显碱性?
CH3COONa
= CH3COO- + Na+
H2O
H+ + OH-
C(H+ )=C(OH-)
加CH3COONa:
CH3COOH
C(H+ )﹤C(OH-)
CH3COONa + H2O CH3COOH+NaOH
离子方程式 CH3COO- +H2O CH3COOH+OH-
碱 性
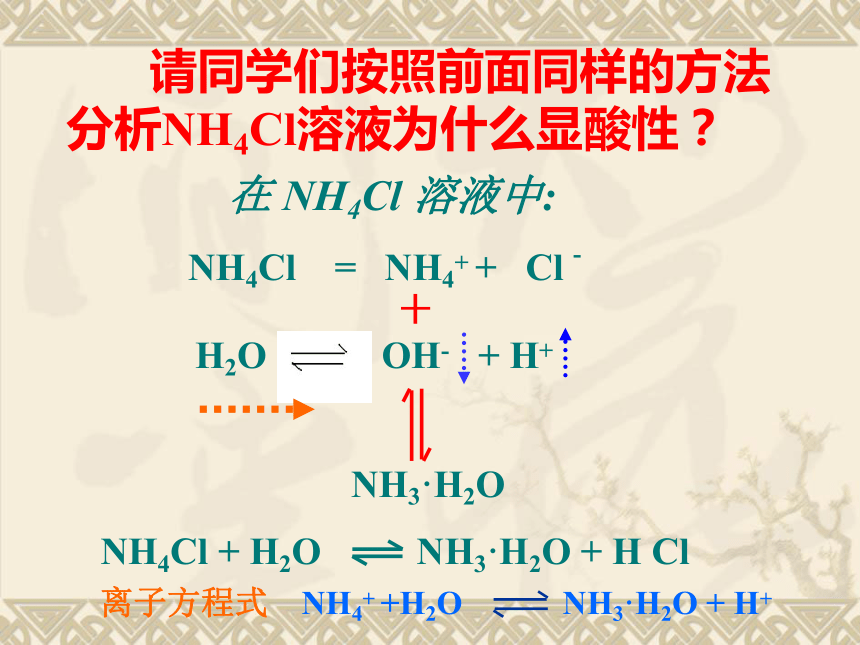
请同学们按照前面同样的方法分析NH4Cl溶液为什么显酸性?
H2O OH- + H+
NH4Cl = NH4+ + Cl -
NH3·H2O
离子方程式 NH4+ +H2O NH3·H2O + H+
在 NH4Cl 溶液中:
NH4Cl + H2O NH3·H2O + H Cl
在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
一、盐类的水解
1. 定义:
增大了水的电离程度,使得盐溶液呈现出一定的酸碱性。
2. 实质:
思考: KNO3、NaCl能水解吗?为什么?
你根据实验结果,能找出盐水解之后显什么性的规律吗?
根据实验比较CH3COONa和Na2CO3水解后碱性的强弱及NH4Cl 和Al2(SO4)3水解后酸性的强弱,你能找出比较盐水解程度大小的规律吗?
比较同条件下Na2CO3和NaHCO3水解后碱性的强弱,并写出水解的离子方程式。
NH4Ac能水解吗?
是哪些离子水解?
3、水解规律:
有弱才水解
谁弱谁水解
越弱越水解
谁强显谁性
同强显中性(NH4Ac)
都弱都水解
盐类水解方程式的书写规律
1. 盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2. 多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二步水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,溶液碱性谁强。通常写第一步水解。
3. 多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
2. 判断下列盐溶液的酸碱性:
(1)KF (2) NH4NO3
(3)Na2SO4 (4)CuSO4
1. 写出下列物质水解的离子反应方程式:
(1) CH3COONa溶液 (2) Na2CO3溶液
(3) NH4Cl溶液 (4)Al2(SO4)3溶液
3. 比较同条件下CH3COONa和Na2CO3溶液
的碱性的强弱
二、影响盐类水解平衡的因素
1.内因:水解的离子结合H+或OH-的能力
(酸碱越弱越水解)
例:比较下列各组物质的溶液在同条件下 pH值的大小: (1)Na2CO3和NaHCO3 (2)Na2S和NaHS (3)NaH2PO4,Na2HPO4和Na3PO4
练习:浓度为0.1mol/L的下列几种溶液:NaHSO4, Na2CO3,NaHCO3, CH3COONa, CH3COOH,NH4Cl ,pH由小到大顺序为__________________。
2. 外 因——化学平衡移动原理
(1)温度
盐+水 酸+碱
中 和
水 解
——温度越高越水解.
(水解是吸热反应)
(2)浓度
——浓度越稀越水解.
稀释使水解平衡正向移动,但由于加水溶液体积增大,溶液的酸性或者碱性减弱。
(3)加入物质
一般酸可抑制阳离子水解,促进阴离子水解;
碱可抑制阴离子水解,促进阳离子水解。
条 件
移动方向
H+数
pH
Fe3+水解率
现 象
升温
加水稀释
通HCl
加Fe粉
加NaHCO3
填表:Fe3++3H2O Fe(OH)3+3H+
颜色变深
颜色变浅
颜色变浅
颜色变浅
红褐↓,无色↑
三、双水解
常见的、典型的双水解反应:
Al3+
HCO3-
CO32-
S2-
AlO2-
HS-
SO32-
HSO3-
Fe3+
HCO3-
CO32-
AlO2-
AlO2-
SiO32-
NH4+
双水解能进行到底的条件:
2. 生成的碱或酸的溶解度比其盐(或生成盐)的要小得多
1. 弱酸弱碱盐(强酸弱碱盐+弱酸强碱盐溶液)
AlO2-
Cu2+
NH4+
Fe3+
Al3+
Mg2+
练习:下列离子在溶液中能大量共存的是
A. Na+ 、 H2PO4-、HPO42-、Cl-
B. NH4+、H2PO4-、PO43-、 NO3-
C. Fe3+ 、 Na+ 、 ClO- 、 Cl-
D. AlO2-、Al3+、 H+ 、 Cl-
常见的双水解反应有(盐与盐在溶液中反应):
Al3++3HCO3-=Al(OH)3↓+3CO2↑(泡沫灭火机)
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
Al3++3AlO2-+6H2O=4Al(OH)3↓
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO
实验:热水配制CuCl2溶液
热水:升温能够促进水解
实验现象:溶液出现浑浊
原因:
CuCl2+2H2O Cu(OH)2+2HCl
或Cu2++2H2O Cu(OH)2+2H+
配制CuCl2溶液,为防止出现浑浊,应加少量的
_______
稀盐酸
思考:用热水配制硫酸铁溶液时,为什么会产生混浊?怎样才能用热水配制出澄清的硫酸铁溶液?
[小结]:配制易水解的金属盐溶液应加少量的______________
配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。
同种酸。
四、配制易水解的盐溶液时,
需考虑抑制盐的水解
在配制FeCl3(SnCl2等)溶液时,为了防止水解而使溶液变浑浊,故先将FeCl3溶于稀盐酸中,再加水至所需刻度。
同样:如何配制硫酸铜溶液?
思考:配制FeCl2溶液时哪些注意点?
五、加热蒸发可水解的盐溶液
例:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3.为什么?
△
2Fe(OH)3 = Fe2O3 + 3H2O
FeCl3+3H2O Fe(OH)3+3HCl
⑴加热促进水解 ⑵HCl挥发
思考:Al2(SO4)3溶液加热蒸发后得到固体是什么?
尽管Al3+水解生成Al(OH)3和H2SO4,但由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。
3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O
六.某些活泼金属与水解显酸性盐溶液的反应
【实验】 把Mg粉放入NH4Cl溶液
实验现象:剧烈反应有气体放出,有刺激性气味
[思考]检验NH3方法?
检验结果:湿润的红色的石蕊试纸变蓝,说明刺激性气味的气体是NH3 。
用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒
NH4++H2O NH3 H2O + H+
Mg+ 2H+ = Mg2+ + H2↑
△
NH3 H2O = NH3 ↑ + H2O
七、热纯碱水去油污能力强:
在碱性条件下去油污能力强
CO32-+H2O HCO3- +OH- __ Q
HCO3-+H2O H2CO3 +OH- __Q
[生活常识] 为什么用肥皂洗衣服时用温水比冷水洗得干净一些?
肥皂主要成分:硬脂酸钠(C17H35COONa)
硬脂酸(C17H35COOH)是一种一元弱酸
C17H35COO-+H2O C17H35COOH+OH- -Q
农业谚语 :
“灰混粪,粪混灰,灰粪相混损肥分。”
思考:为什么会损肥分
[实验] 饱和K2CO3(草木灰的主要成分)溶液和NH4Cl晶体混合
八、草木灰不宜与铵态氮肥混合施用:
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
双水解
灭火器原理
塑料筒里面放入的什么是药品?
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
药品:Al2(SO4)3溶液、NaHCO3溶液
九、泡沫灭火器的原理应用双水解
Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑;
当矾与碱放入水中时,它们之间会发生化学变化,产生大量CO2和絮状物。与面合在一起时,絮状物Al(OH)3与面产生膜状物,将CO2气体包住。油条放入热油锅中, CO2受热膨胀,使油条胀大。这就是炸油条要放矾、碱的原因。但其间的配比一定要掌握好,明矾多了,水解产生的Al(OH)3就多,使油条遇热产生硬、脆、多泡现象,而且耗油量大。若碱放多了,则会使油条颜色发黄,增加其苦涩味。矾与碱之比以2.5:3.5较为合适。
炸油条或油饼时必须要放明矾与纯碱
练习:
1. 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,产生碱性的原因(用离子方程式表示)_______________________, 施用适量石膏可降低盐碱地的碱性,表示其反应原理的离子方程式__________________.
CO32-+H2O HCO3-+OH-
Ca2+ + CO32- = CaCO3↓
2.(上海高考)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3 C. MgSO4 D. KMnO4
C
3. SnCl2溶液易水解,实验室应如何保存?
实验室保存SnCl2是向其中加入少量的稀盐酸
(抑制水解)和少量的金属锡(+2价的锡
不稳定,这样可以防止被氧化)
Sn4+ + Sn = 2Sn2+
SnCl2+2H2O Sn(OH)2+2HCl
4. 下列溶液加入金属镁可以产生H2的是( )
CH3COOH B. NaHCO3
C. NH4Cl D. NaClO
AC
5. 下列离子方程式正确的是( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. NH4++H2O = NH3·H2O+ H+
C. CO32-+H2O H2CO3+OH-
D. HCO3-+H2O H2CO3 +OH-
D
6. 为什么不能从溶液中直接制取Al2S3
因Al3+、S2-均能水解,Al3+水解使溶液呈酸性,S2-水解使溶液呈碱性。如Al3+、S2-在同一溶液中,它们将相互促进水解而使水解完全,从而得不到Al2S3。
