盐类的水解及其影响因素
图片预览








文档简介
(共30张PPT)
盐类的水解
hydrolysis of salts
人教版选修4---化学反应原理
H2O H++OH-
电离度、水的离子积KW
水的电离
衡量水的电离的微弱程度
25℃, KW=10-14,
c(H+)=c(OH-)=10-7 mol/L
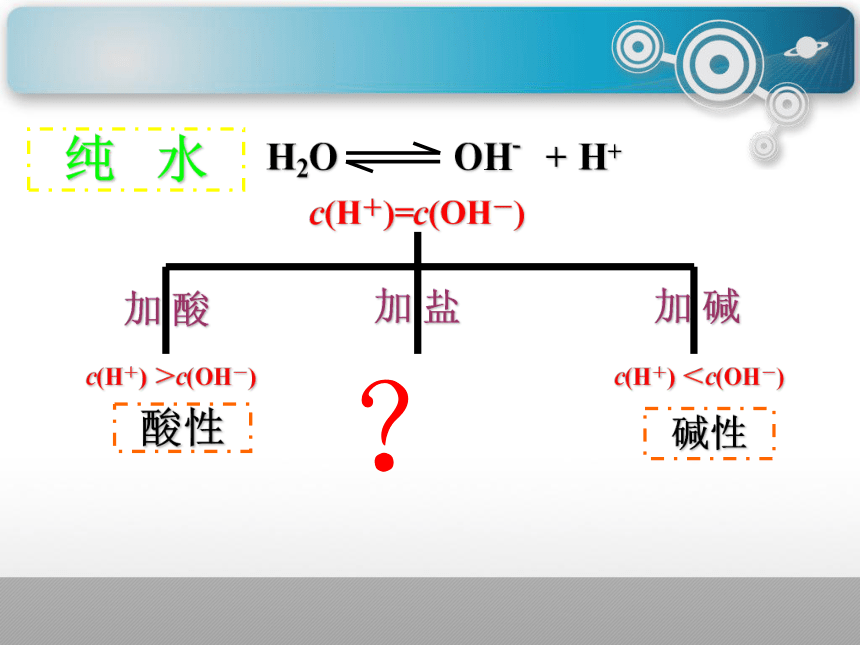
纯 水
酸性
碱性
加 酸
加 碱
加 盐
c(H+) <c(OH-)
c(H+) >c(OH-)
c(H+)=c(OH-)
H2O OH- + H+
?
科学探究
盐溶液 NaCl Na2SO4 (NH4)2SO4 NH4Cl CH3COONa Na2CO3
酸碱性
盐的类型
中性
酸性
酸性
碱性
碱性
中性
强酸强碱盐
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强碱弱酸盐
强碱弱酸盐
归纳盐的类型与盐溶液酸碱性的关系
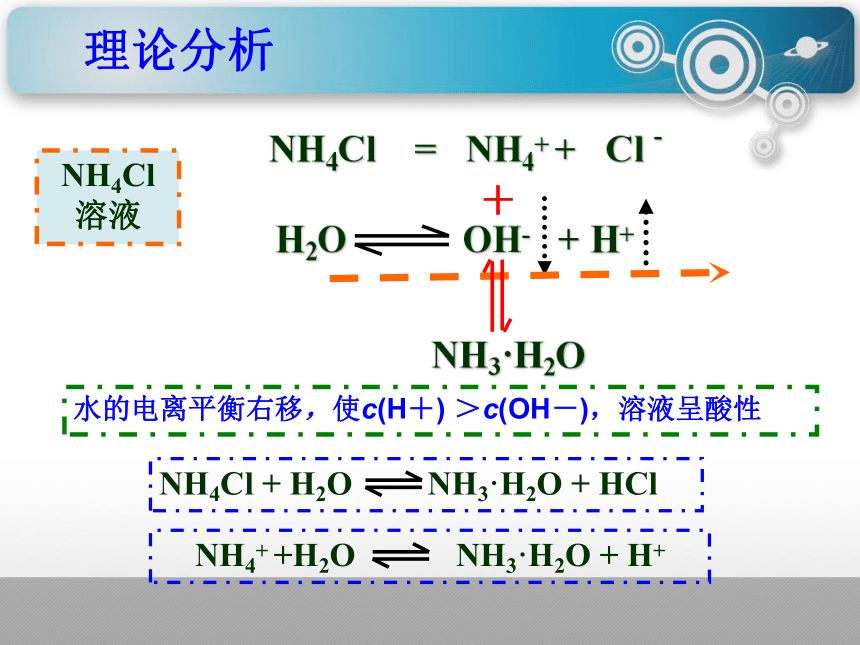
NH4Cl = NH4+ + Cl -
NH3·H2O
NH4Cl 溶液
水的电离平衡右移,使c(H+) >c(OH-),溶液呈酸性
NH4Cl + H2O NH3·H2O + HCl
H2O OH- + H+
理论分析
NH4+ +H2O NH3·H2O + H+
NH4++H2O NH3·H2O+H+
Fe3+ +3H2O Fe(OH)3+3H+
Al3++3H2O Al(OH)3+3H+
归纳共性
1.都生成弱电解质(弱碱);
2.都是可逆反应;
3.都消耗OH-,溶液显酸性;
4.都促进水的电离
强酸弱碱盐溶液
CH3COONa溶液
CH3COONa = CH3COO- + Na+
H2O
H+ + OH-
CH3COOH
CH3COONa + H2O CH3COOH+NaOH
CH3COO- +H2O CH3COOH+OH-
理论分析
水的电离平衡右移,使c(OH-) >c(H+),溶液呈碱性
ClO-+H2O HClO+OH-
CO32-+H2O HCO3- +OH-
S2- +H2O HS- +OH-
归纳共性
1.都生成弱电解质(弱酸);
2.都是可逆反应;
3.都消耗H+,溶液显碱性;
4.都促进水的电离
强碱弱酸盐溶液
强酸强碱
盐
中性
C(H+)=C(OH-)
强酸弱碱
酸性
C(H+)>C(OH-)
强碱弱酸
碱性
C(H+)弱酸弱碱
取决于电离常数
盐的类型与盐溶液酸碱性的关系
归纳整理
水解的对象
水解的本质
水解的结果
盐的水解
有弱就水解,
无弱不水解!
促进水的电离
谁强显谁性
盐类的水解
盐类溶于水时,由于其电离出的阳离子或阴离子可分别与水电离出的OH-或H+结合生成弱电解质(弱酸或弱碱),使溶液中的H+和OH-的浓度不相等,致使溶液呈现酸性或碱性。
OH- + Na+ = ?
H+ + Cl- = ?
H2O OH- + H+
NaCl = Na+ + Cl -
NaCl 溶液:
对水的电离平衡无影响,c(OH-) = c(H+)溶液呈中性
NaOH (强电解质)
HCl (强电解质)
强碱强酸盐溶液
计算室温下,pH=10的醋酸钠溶液中水电离出的OH- 的浓度
计算室温下,pH=4的氯化铵溶液中水电离出的H+的浓度
影响盐类水解的主要因素和盐类水解的应用
影响盐类水解的主要因素
1.内因:盐本身的性质
NaA = A- + Na+
H2O
H+ + OH-
+
HA
(弱酸)
如HA越弱, 则A-和H+更 结合, 水的电离程度更 , 即水解的程度更 .
容易
大
大
生成盐的弱酸(或弱碱)越弱, 盐的水解程度越大, 溶液的碱(或酸)性也越强
强碱弱酸盐
强酸弱碱盐
ACl = A+ + Cl-
H2O
OH- + H+
+
AOH
(弱碱)
如AOH越弱, 则A+和OH-更 结合, 水的电离程度更 , 即水解的程度更 .
容易
大
大
(越弱越水解)
① 不同弱酸对应的盐
NaClO (aq) NaHCO3 (aq)
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
碱 性
② 不同弱碱对应的盐
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
影响盐类水解的主要因素
1.内因:反应物本身的性质
③同一弱酸对应的盐
Na2CO3(aq) NaHCO3(aq)
对应的酸
HCO3ˉ H2CO3
<
碱性
>
相同温度下,等物质的量浓度的下列溶液pH的大小关系是( )
NaHCO3溶液 Na2CO3溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 Na2SO4溶液
学以致用
影响盐类水解的主要因素
2.1 温度
正向:中和反应为放热反应;
逆向:水解反应为吸热反应。
升高温度,盐的水解程度增大
2.外因
影响盐类水解的主要因素
2.2 浓度
增大盐的浓度,平衡向着水解的方向移动,溶液中H+或OH-浓度增大,溶液的酸性或碱性增强;但是发生水解的盐的百分率反而减小。
减小盐的浓度(加水稀释),平衡向着水解的方向移动,盐的水解程度增大,但溶液中H+或OH-浓度减小,溶液的酸性或碱性减弱;
2.外因
影响盐类水解的主要因素
2.外因
2.3 加酸、碱
水解呈酸(碱)性的盐溶液,若加入碱(酸),就会中和溶液中的H+(OH-),使平衡向水解方向移动而促进水解;若加酸(碱)就会抑制水解。
影响盐类水解的主要因素
3.双水解
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,甚至完全反应。
HCO3-+ H2O H2CO3 + OH-
Al3++3H2O Al(OH)3+3H+
+
H2O
3HCO3-+Al3+ = 3CO2↑ +Al(OH)3↓
NH4+
Al3+
Fe3+
S2-(HS-)
CO32-(HCO3-)
AlO2-
电解质溶液中的守恒关系
电荷守恒
物料守恒(原子守恒)
三个守恒
质子守恒
电解质溶液中的守恒关系
电荷守恒
电解质溶液中,阳离子所带电荷总数一定等于阴离子所带电荷总数。
NaHCO3溶液
c(Na+)+c(H+)=c(HCO-3)+c(OH-)+2c(CO32-)
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电解质溶液中的守恒关系
物料守恒
在电解质溶液中,由于某些离子能够水解,离子种类变多,但是其中所含原子的总数始终不变。
NaHCO3溶液
c(Na+)=c(HCO-3)+c(H2CO3)+c(CO32-)
K2S溶液
c(K+)=2[c(HS-)+c(OH-)+c(S2-)]
n(Na)=n(C)
n(K)=2n(S)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
CH3COONa溶液
CH3COO-
H2O
+H+
CH3COOH
+H+
H3O+
(即H+)
-H+
OH-
c( CH3COOH )+c(H+)=c(OH-)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
K2S溶液
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
KHS溶液
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S)=c(OH-) + c(S2- )
电解质溶液中的守恒关系
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
电解质溶液中的守恒关系
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
NaHS溶液
c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
c(Na+)=c(HS-)+c(H2S)+c(S2-)
原子守恒
联立,消去Na+得
c(H+) +c(H2S)=c(OH-) + c(S2- )
Na2CO3溶液中,各离子浓度大小顺序为______________________
学以致用
NaHCO3溶液中,各离子浓度大小顺序为______________________
盐类的水解
hydrolysis of salts
人教版选修4---化学反应原理
H2O H++OH-
电离度、水的离子积KW
水的电离
衡量水的电离的微弱程度
25℃, KW=10-14,
c(H+)=c(OH-)=10-7 mol/L
纯 水
酸性
碱性
加 酸
加 碱
加 盐
c(H+) <c(OH-)
c(H+) >c(OH-)
c(H+)=c(OH-)
H2O OH- + H+
?
科学探究
盐溶液 NaCl Na2SO4 (NH4)2SO4 NH4Cl CH3COONa Na2CO3
酸碱性
盐的类型
中性
酸性
酸性
碱性
碱性
中性
强酸强碱盐
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强碱弱酸盐
强碱弱酸盐
归纳盐的类型与盐溶液酸碱性的关系
NH4Cl = NH4+ + Cl -
NH3·H2O
NH4Cl 溶液
水的电离平衡右移,使c(H+) >c(OH-),溶液呈酸性
NH4Cl + H2O NH3·H2O + HCl
H2O OH- + H+
理论分析
NH4+ +H2O NH3·H2O + H+
NH4++H2O NH3·H2O+H+
Fe3+ +3H2O Fe(OH)3+3H+
Al3++3H2O Al(OH)3+3H+
归纳共性
1.都生成弱电解质(弱碱);
2.都是可逆反应;
3.都消耗OH-,溶液显酸性;
4.都促进水的电离
强酸弱碱盐溶液
CH3COONa溶液
CH3COONa = CH3COO- + Na+
H2O
H+ + OH-
CH3COOH
CH3COONa + H2O CH3COOH+NaOH
CH3COO- +H2O CH3COOH+OH-
理论分析
水的电离平衡右移,使c(OH-) >c(H+),溶液呈碱性
ClO-+H2O HClO+OH-
CO32-+H2O HCO3- +OH-
S2- +H2O HS- +OH-
归纳共性
1.都生成弱电解质(弱酸);
2.都是可逆反应;
3.都消耗H+,溶液显碱性;
4.都促进水的电离
强碱弱酸盐溶液
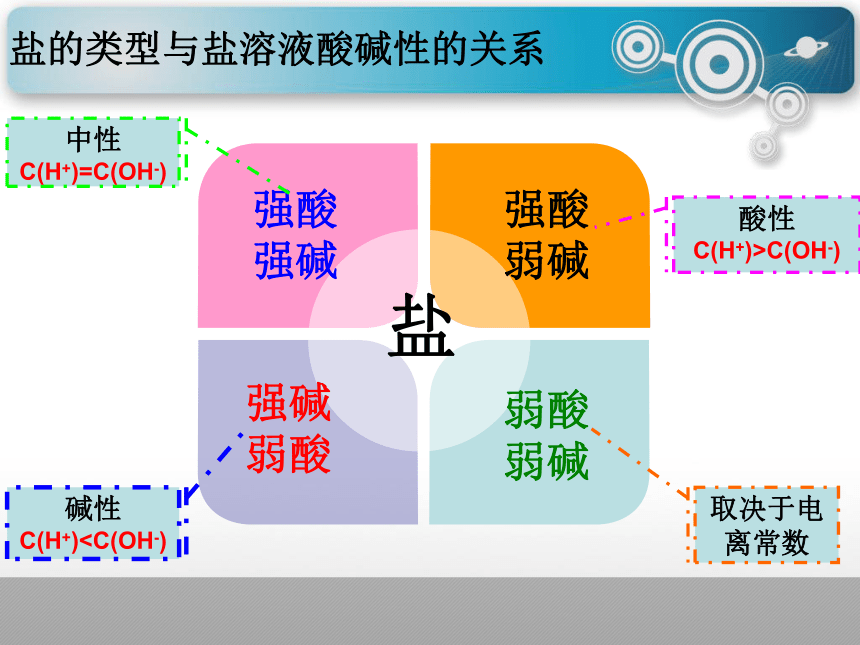
强酸强碱
盐
中性
C(H+)=C(OH-)
强酸弱碱
酸性
C(H+)>C(OH-)
强碱弱酸
碱性
C(H+)
取决于电离常数
盐的类型与盐溶液酸碱性的关系
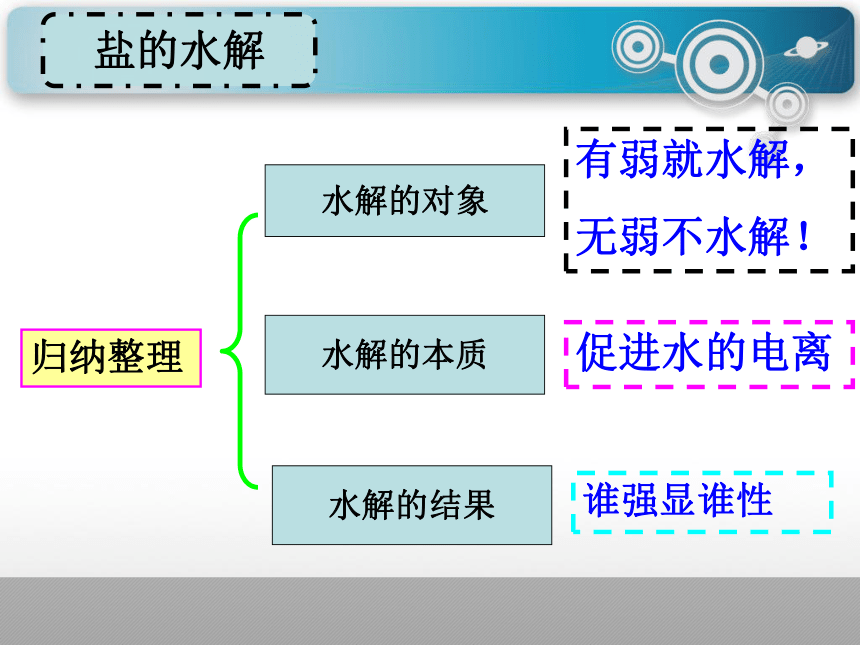
归纳整理
水解的对象
水解的本质
水解的结果
盐的水解
有弱就水解,
无弱不水解!
促进水的电离
谁强显谁性
盐类的水解
盐类溶于水时,由于其电离出的阳离子或阴离子可分别与水电离出的OH-或H+结合生成弱电解质(弱酸或弱碱),使溶液中的H+和OH-的浓度不相等,致使溶液呈现酸性或碱性。
OH- + Na+ = ?
H+ + Cl- = ?
H2O OH- + H+
NaCl = Na+ + Cl -
NaCl 溶液:
对水的电离平衡无影响,c(OH-) = c(H+)溶液呈中性
NaOH (强电解质)
HCl (强电解质)
强碱强酸盐溶液
计算室温下,pH=10的醋酸钠溶液中水电离出的OH- 的浓度
计算室温下,pH=4的氯化铵溶液中水电离出的H+的浓度
影响盐类水解的主要因素和盐类水解的应用
影响盐类水解的主要因素
1.内因:盐本身的性质
NaA = A- + Na+
H2O
H+ + OH-
+
HA
(弱酸)
如HA越弱, 则A-和H+更 结合, 水的电离程度更 , 即水解的程度更 .
容易
大
大
生成盐的弱酸(或弱碱)越弱, 盐的水解程度越大, 溶液的碱(或酸)性也越强
强碱弱酸盐
强酸弱碱盐
ACl = A+ + Cl-
H2O
OH- + H+
+
AOH
(弱碱)
如AOH越弱, 则A+和OH-更 结合, 水的电离程度更 , 即水解的程度更 .
容易
大
大
(越弱越水解)
① 不同弱酸对应的盐
NaClO (aq) NaHCO3 (aq)
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
碱 性
② 不同弱碱对应的盐
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
影响盐类水解的主要因素
1.内因:反应物本身的性质
③同一弱酸对应的盐
Na2CO3(aq) NaHCO3(aq)
对应的酸
HCO3ˉ H2CO3
<
碱性
>
相同温度下,等物质的量浓度的下列溶液pH的大小关系是( )
NaHCO3溶液 Na2CO3溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 Na2SO4溶液
学以致用
影响盐类水解的主要因素
2.1 温度
正向:中和反应为放热反应;
逆向:水解反应为吸热反应。
升高温度,盐的水解程度增大
2.外因
影响盐类水解的主要因素
2.2 浓度
增大盐的浓度,平衡向着水解的方向移动,溶液中H+或OH-浓度增大,溶液的酸性或碱性增强;但是发生水解的盐的百分率反而减小。
减小盐的浓度(加水稀释),平衡向着水解的方向移动,盐的水解程度增大,但溶液中H+或OH-浓度减小,溶液的酸性或碱性减弱;
2.外因
影响盐类水解的主要因素
2.外因
2.3 加酸、碱
水解呈酸(碱)性的盐溶液,若加入碱(酸),就会中和溶液中的H+(OH-),使平衡向水解方向移动而促进水解;若加酸(碱)就会抑制水解。
影响盐类水解的主要因素
3.双水解
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,甚至完全反应。
HCO3-+ H2O H2CO3 + OH-
Al3++3H2O Al(OH)3+3H+
+
H2O
3HCO3-+Al3+ = 3CO2↑ +Al(OH)3↓
NH4+
Al3+
Fe3+
S2-(HS-)
CO32-(HCO3-)
AlO2-
电解质溶液中的守恒关系
电荷守恒
物料守恒(原子守恒)
三个守恒
质子守恒
电解质溶液中的守恒关系
电荷守恒
电解质溶液中,阳离子所带电荷总数一定等于阴离子所带电荷总数。
NaHCO3溶液
c(Na+)+c(H+)=c(HCO-3)+c(OH-)+2c(CO32-)
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电解质溶液中的守恒关系
物料守恒
在电解质溶液中,由于某些离子能够水解,离子种类变多,但是其中所含原子的总数始终不变。
NaHCO3溶液
c(Na+)=c(HCO-3)+c(H2CO3)+c(CO32-)
K2S溶液
c(K+)=2[c(HS-)+c(OH-)+c(S2-)]
n(Na)=n(C)
n(K)=2n(S)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
CH3COONa溶液
CH3COO-
H2O
+H+
CH3COOH
+H+
H3O+
(即H+)
-H+
OH-
c( CH3COOH )+c(H+)=c(OH-)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
K2S溶液
S2-
H2O
+H+
HS-
+H+
H3O+
(即H+)
-H+
OH-
+2H+
H2S
c(HS- )+c(H+) +2c(H2S)=c(OH-)
电解质溶液中的守恒关系
质子守恒
水电离出的c(H+)c(OH-)始终相等,溶液中的H+或OH-虽与其他离子结合而以不同形式存在,但其总量相等
KHS溶液
HS-
H2O
+H+
H3O+
-H+
OH-
+H+
H2S
-H+
S2-
c(H+) +c(H2S)=c(OH-) + c(S2- )
电解质溶液中的守恒关系
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
K2S溶液
c(K+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
原子守恒
c(K+)=2[c(HS-)+c(H2S)+c(S2-)]
联立,消去K+得
c(HS- )+c(H+) +2c(H2S)=c(OH-)
电解质溶液中的守恒关系
质子守恒
通过联立电荷守恒和原子守恒,消去与得到和给出质子无关的粒子
NaHS溶液
c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-)
电荷守恒
c(Na+)=c(HS-)+c(H2S)+c(S2-)
原子守恒
联立,消去Na+得
c(H+) +c(H2S)=c(OH-) + c(S2- )
Na2CO3溶液中,各离子浓度大小顺序为______________________
学以致用
NaHCO3溶液中,各离子浓度大小顺序为______________________
