第三节化学平衡(一)
图片预览








文档简介
(共27张PPT)
第三节 化学平衡(第一课时)
1.了解化学平衡的建立化学平衡的特征。
2.能判断一个可以逆反应是否达到平衡状态。
3.理解外界条件对化学平衡的影响。
学习目标
知识回顾
影响化学反应速率大小的因素
内因:反应物的结构和性质(决定因素)
外因:温度、压强、浓度、催化剂、等。
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应.
注意:
可逆反应总是不能进行到底,得到的总是反应物与生成物的混合物
1、什么是可逆反应?
一.可逆反应与不可逆反应
阅读与思考
2、什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
没有!溶解与结晶仍在进行,只是二者的速率相等,饱和溶液的浓度和固体溶质的质量都保持不变,这种溶质在溶液中形成饱和溶液时的状态,称溶解平衡。
固体溶质 溶液中的溶质
交流 · 研讨
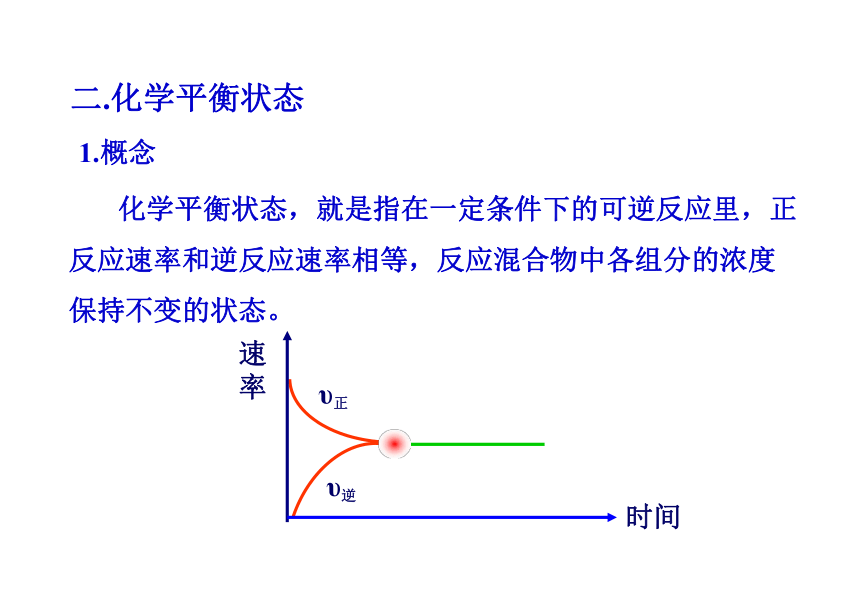
1.概念
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
υ正
时间
速率
二.化学平衡状态
υ逆
研究对象:可逆反应
微观实质:正反应速率=逆反应速率
宏观特征:反应混合物中各组分的
浓度保持不变的状态
注意
2.化学平衡状态的特征
(1)动:动态平衡(正逆反应仍在进行)
(2)等:正反应速率=逆反应速率
(3)定:反应混合物中各组分的浓度保持不变,各组 分的含量一定。
(4)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
1.速率: υ正= υ逆
(即任何一种物质的生成速率等于其消耗速率)
2.各组分的浓度保持不变。
3.可逆反应到平衡状态的标志:
对于不同类型的可逆反应,若某一物理量在平衡建立的过程中发生变化,则该物理量可以作为可逆反应已达到平衡的标志,否则,不可以。
注意
(1)浓度对化学平衡的影响
编号 1 2
步骤 滴加3-10滴浓H2SO4 滴加10-20滴6mol/LNaOH
K2Cr2O7 溶液
溶液变橙
溶液变红
实验2-5
4.影响化学平衡条件
编号 1 2
步骤(1) 滴加饱和FeCl3溶液 滴加1mol/LKSCN溶液
现象
步骤(2) 滴加NaOH溶液 滴加NaOH溶液
现象
结论
溶液颜色变深
溶液颜色变深
实验2-6
溶液颜色变浅
溶液颜色变浅
增大FeCl3和KSCN溶液的浓度,Fe(SCN)3的浓度增大。减小反应物的浓度, Fe(SCN)3的浓度减小。
思考与交流
1.上述两个实验中,化学平衡状态是否发生了改变?你是如何着判断的?
2.从中你能否推知影响化学平衡状态的因素?
1.化学平衡状态发生了改变。通过溶液颜色的变化可知物质的浓度发生了变化。
2.能。增大反应物的浓度平衡向正反应向移动,减小反应物的浓度平衡向逆反应移动。
学与问
其它条件不变时,如果减小反应物的浓度或减小生成物的浓度,正、逆反应速率如何变化平衡如何移动?
对于己达到化学平衡的可逆反应,如果减小的物的浓度,正反应速率减小,平衡向逆反应方向移动,减小生成物的浓度平衡,逆反应速率减小平衡向正反应方向移动。
注意
(1)对平衡体系中的固态和纯液态物质,其浓度可看 作一个常数,改变它们的量并不影响υ正、 υ逆的大小,所以化学平衡不移动。
(2)只要是增大浓度,不论增大的是反应物浓度,还是
生成物浓度,新平衡状态下的反应速率一定大于原 平衡 状态;减小浓度,新平衡状态下的速率一定小
于原平衡状态。
(3)反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他物质的转化率提高。
热水 冰水
现象
2NO2 N2O4 △ H= - 56.9kJ/mol
(红棕色) (无色)
实验2-7
结论
温度升高平衡向吸热方向移动,温度降低平衡向放热方向移动。
(2)温度度对化学平衡的影响
颜色变深
颜色变浅
解释
在其它条件不变的情况下, 升高温度,不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.
(3)压强对化学平衡的影响
数据表明:NH3%随着压强的增大而增大,即平衡向正反应的方向移动。
实验数据:
压强(MPa) 1 5 10 30 60 100
NH3 % 2.0 9.2 16.4 35.5 53.6 69.4
N2 十 3H2 2NH3
观察与思考
结论解释
对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。
增大压强,正逆反应速率均增大,但增大倍数 不一样,平衡向着体积缩小的方向移动
思考
催化剂为什么对化学平衡移动没有影响?
催化剂能同等程度的改变正、逆反应速率,因此对化学平衡移动没有影响,但可以缩短达到平衡所需要的时间。
学与问
1.什么是化学平衡移动?
2.化学平衡移动的实质是什么?
1.由于条件的改变导致旧平衡破坏新平衡建立的过程,称平衡移动。
2.化学平衡移动的实质是条件的改变造成υ正 ≠ υ逆
平衡移动原理(勒沙特列原理):
注意
只能用来解释与平衡移动(反应进行程度)有关的问题。
如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
阅读总结
一可逆反应不可逆反应
1.可逆反应 2.饱和溶液
二化学平衡
1.化学平衡
(1)概念
(2)特征(动等定变)
(3)标志
υ正=υ逆
各组分的浓度保持不变
2.外界条件对化学平衡的影响
(1)浓度
(2)温度
(3)压强
勒夏特列原理
如果改变影响平衡的条件之一,平衡就向着能够减弱这种改变的方向移动
课堂小结
1.在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
课堂训练
2.下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
3.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是 ( )
A.平衡向正反应方向移动
B.物质A的转化率增大
C.物质B的质量分数增加
D.a>b
D
4.在一定条件下,xA+yB zC的可逆反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是________.
(2)已知C是气体,且x+y=z,在加压时,如果平衡发生移动,则平衡必须向__________方向移动(填“正反应”或“逆反应”).
(3)已知B、C是气体,现增加A物质的量(其他条件不变),平衡不移动,则A是________态.
(4)加热后C的质量分数减少,则正反应是________热反应.
答案:(1)x+y>z (2)逆反应 (3)固或纯液 (4)放
第三节 化学平衡(第一课时)
1.了解化学平衡的建立化学平衡的特征。
2.能判断一个可以逆反应是否达到平衡状态。
3.理解外界条件对化学平衡的影响。
学习目标
知识回顾
影响化学反应速率大小的因素
内因:反应物的结构和性质(决定因素)
外因:温度、压强、浓度、催化剂、等。
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应.
注意:
可逆反应总是不能进行到底,得到的总是反应物与生成物的混合物
1、什么是可逆反应?
一.可逆反应与不可逆反应
阅读与思考
2、什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
没有!溶解与结晶仍在进行,只是二者的速率相等,饱和溶液的浓度和固体溶质的质量都保持不变,这种溶质在溶液中形成饱和溶液时的状态,称溶解平衡。
固体溶质 溶液中的溶质
交流 · 研讨
1.概念
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
υ正
时间
速率
二.化学平衡状态
υ逆
研究对象:可逆反应
微观实质:正反应速率=逆反应速率
宏观特征:反应混合物中各组分的
浓度保持不变的状态
注意
2.化学平衡状态的特征
(1)动:动态平衡(正逆反应仍在进行)
(2)等:正反应速率=逆反应速率
(3)定:反应混合物中各组分的浓度保持不变,各组 分的含量一定。
(4)变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
1.速率: υ正= υ逆
(即任何一种物质的生成速率等于其消耗速率)
2.各组分的浓度保持不变。
3.可逆反应到平衡状态的标志:
对于不同类型的可逆反应,若某一物理量在平衡建立的过程中发生变化,则该物理量可以作为可逆反应已达到平衡的标志,否则,不可以。
注意
(1)浓度对化学平衡的影响
编号 1 2
步骤 滴加3-10滴浓H2SO4 滴加10-20滴6mol/LNaOH
K2Cr2O7 溶液
溶液变橙
溶液变红
实验2-5
4.影响化学平衡条件
编号 1 2
步骤(1) 滴加饱和FeCl3溶液 滴加1mol/LKSCN溶液
现象
步骤(2) 滴加NaOH溶液 滴加NaOH溶液
现象
结论
溶液颜色变深
溶液颜色变深
实验2-6
溶液颜色变浅
溶液颜色变浅
增大FeCl3和KSCN溶液的浓度,Fe(SCN)3的浓度增大。减小反应物的浓度, Fe(SCN)3的浓度减小。
思考与交流
1.上述两个实验中,化学平衡状态是否发生了改变?你是如何着判断的?
2.从中你能否推知影响化学平衡状态的因素?
1.化学平衡状态发生了改变。通过溶液颜色的变化可知物质的浓度发生了变化。
2.能。增大反应物的浓度平衡向正反应向移动,减小反应物的浓度平衡向逆反应移动。
学与问
其它条件不变时,如果减小反应物的浓度或减小生成物的浓度,正、逆反应速率如何变化平衡如何移动?
对于己达到化学平衡的可逆反应,如果减小的物的浓度,正反应速率减小,平衡向逆反应方向移动,减小生成物的浓度平衡,逆反应速率减小平衡向正反应方向移动。
注意
(1)对平衡体系中的固态和纯液态物质,其浓度可看 作一个常数,改变它们的量并不影响υ正、 υ逆的大小,所以化学平衡不移动。
(2)只要是增大浓度,不论增大的是反应物浓度,还是
生成物浓度,新平衡状态下的反应速率一定大于原 平衡 状态;减小浓度,新平衡状态下的速率一定小
于原平衡状态。
(3)反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他物质的转化率提高。
热水 冰水
现象
2NO2 N2O4 △ H= - 56.9kJ/mol
(红棕色) (无色)
实验2-7
结论
温度升高平衡向吸热方向移动,温度降低平衡向放热方向移动。
(2)温度度对化学平衡的影响
颜色变深
颜色变浅
解释
在其它条件不变的情况下, 升高温度,不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.
(3)压强对化学平衡的影响
数据表明:NH3%随着压强的增大而增大,即平衡向正反应的方向移动。
实验数据:
压强(MPa) 1 5 10 30 60 100
NH3 % 2.0 9.2 16.4 35.5 53.6 69.4
N2 十 3H2 2NH3
观察与思考
结论解释
对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。
增大压强,正逆反应速率均增大,但增大倍数 不一样,平衡向着体积缩小的方向移动
思考
催化剂为什么对化学平衡移动没有影响?
催化剂能同等程度的改变正、逆反应速率,因此对化学平衡移动没有影响,但可以缩短达到平衡所需要的时间。
学与问
1.什么是化学平衡移动?
2.化学平衡移动的实质是什么?
1.由于条件的改变导致旧平衡破坏新平衡建立的过程,称平衡移动。
2.化学平衡移动的实质是条件的改变造成υ正 ≠ υ逆
平衡移动原理(勒沙特列原理):
注意
只能用来解释与平衡移动(反应进行程度)有关的问题。
如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
阅读总结
一可逆反应不可逆反应
1.可逆反应 2.饱和溶液
二化学平衡
1.化学平衡
(1)概念
(2)特征(动等定变)
(3)标志
υ正=υ逆
各组分的浓度保持不变
2.外界条件对化学平衡的影响
(1)浓度
(2)温度
(3)压强
勒夏特列原理
如果改变影响平衡的条件之一,平衡就向着能够减弱这种改变的方向移动
课堂小结
1.在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
AC
课堂训练
2.下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
3.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是 ( )
A.平衡向正反应方向移动
B.物质A的转化率增大
C.物质B的质量分数增加
D.a>b
D
4.在一定条件下,xA+yB zC的可逆反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是________.
(2)已知C是气体,且x+y=z,在加压时,如果平衡发生移动,则平衡必须向__________方向移动(填“正反应”或“逆反应”).
(3)已知B、C是气体,现增加A物质的量(其他条件不变),平衡不移动,则A是________态.
(4)加热后C的质量分数减少,则正反应是________热反应.
答案:(1)x+y>z (2)逆反应 (3)固或纯液 (4)放
