常见物质的检验
图片预览




文档简介
(共28张PPT)
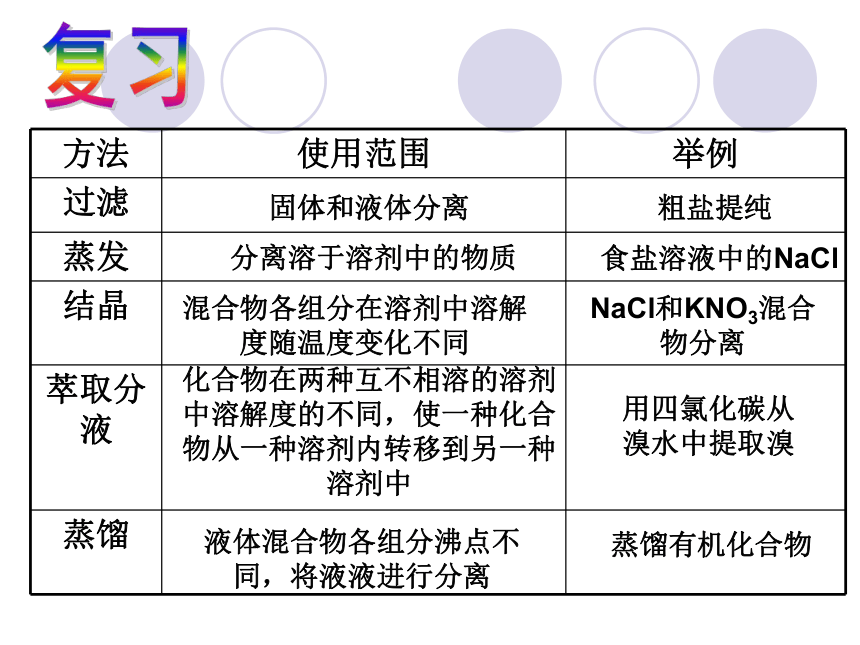
方法 使用范围 举例
过滤
蒸发
结晶
萃取分液
蒸馏
固体和液体分离
粗盐提纯
分离溶于溶剂中的物质
食盐溶液中的NaCl
混合物各组分在溶剂中溶解度随温度变化不同
NaCl和KNO3混合物分离
化合物在两种互不相溶的溶剂中溶解度的不同,使一种化合物从一种溶剂内转移到另一种溶剂中
用四氯化碳从溴水中提取溴
液体混合物各组分沸点不同,将液液进行分离
蒸馏有机化合物
专题一 化学家眼中的物质世界
第一单元 丰富多彩的化学物质
常见物质的检验
酒中的乙醇分子可以使橙红色的
重铬酸钾(k2Cr2O7)变为绿色的硫酸铬[Cr2(SO4)3]
CuSO4溶液
FeCl3溶液
NaOH
Mg(OH)2
NaOH溶液 H2SO4溶液
颜色
溶解度
气体的溢出
颜色的变化
Na2CO3 Na2SO4
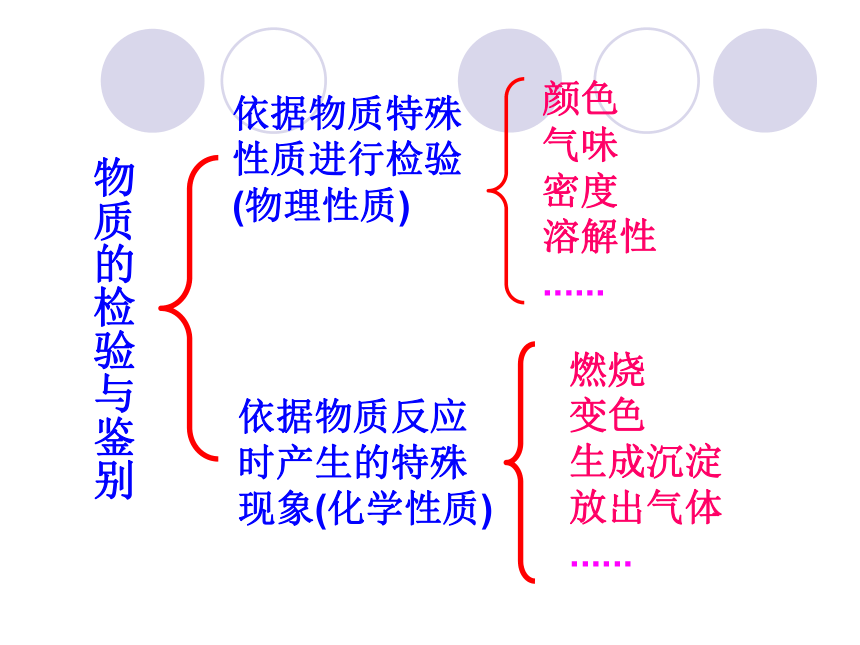
依据物质特殊性质进行检验
(物理性质)
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
依据物质反应时产生的特殊现象(化学性质)
物质的检验与鉴别
待检物质 检验方法 现象
O2
CO2
H2
碳酸盐
(CO32-)
酸
(H+)
碱
(OH-)
淀粉
丝绸制品
用带火星的木条放在装满氧气的集气瓶口
带火星的木条复燃,(利用氧气可燃性)
点燃
与盐酸反应,产生气体通入澄清石灰水
有气体产生,澄清石灰水变浑浊
用紫色石蕊试液;
用pH试纸
紫色石蕊变红;pH试纸变色pH<7
用紫色石蕊试液;用pH试纸
紫色石蕊变蓝;pH试纸变色pH>7
与碘水反应
变蓝
灼烧
有烧焦羽毛的气味
将气体通入澄清石灰水
澄清石灰水变浑浊
用冷的烧杯罩在火焰上方有水珠生成,向烧杯中注入Ca(OH)2不浑浊
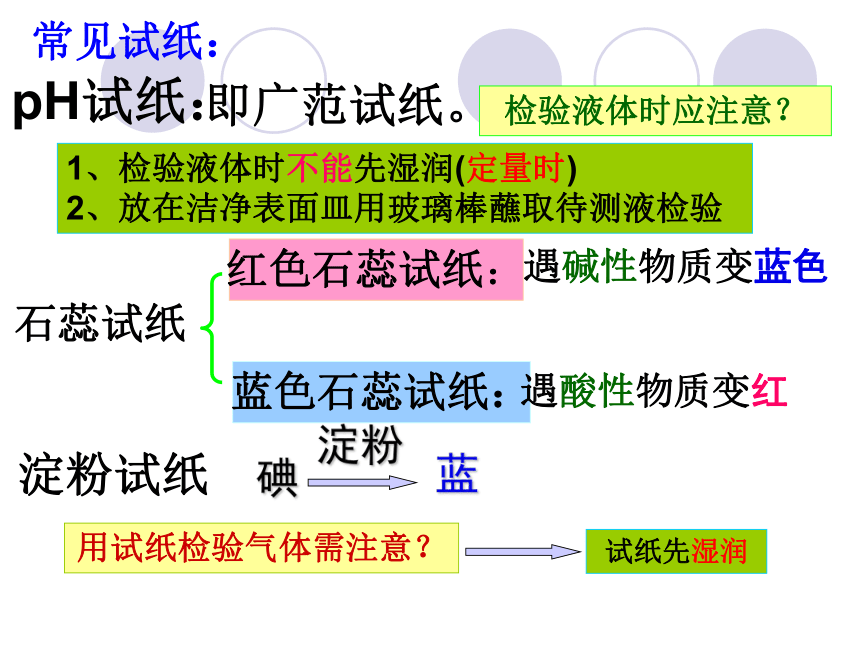
常见试纸:
pH试纸:
红色石蕊试纸:
即广范试纸。
石蕊试纸
遇碱性物质变蓝色
蓝色石蕊试纸:
遇酸性物质变红
淀粉试纸
碘
淀粉
蓝
检验液体时应注意?
1、检验液体时不能先湿润(定量时)
2、放在洁净表面皿用玻璃棒蘸取待测液检验
用试纸检验气体需注意?
试纸先湿润
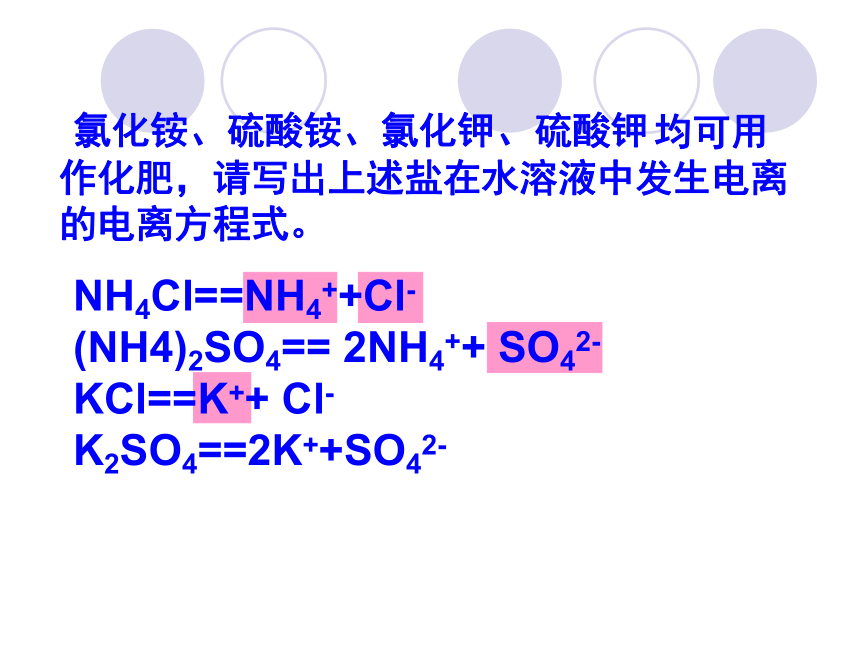
均可用作化肥,请写出上述盐在水溶液中发生电离的电离方程式。
氯化铵、硫酸铵、氯化钾、硫酸钾
NH4Cl==NH4++Cl-
(NH4)2SO4== 2NH4++ SO42-
KCl==K++ Cl-
K2SO4==2K++SO42-
如何检验溶液中有NH4+、Cl-、SO42-存在 ?
可用试剂:
NH4Cl、(NH4)2SO4、K2SO4、KCl、NaOH、 AgNO3、稀HNO3 、KCl、Ba(OH)2、稀HCl、各类试纸
课本P21
资料:
课本P109 常见酸、碱和盐的溶解性表
实验1:NH4+的检验
实验步骤:①取两支试管,分别加入_____ml的NH4Cl和(NH4)2SO4溶液。②再各加入___________溶液。③分别加热两支试管,并将________的_____________试纸靠近__________,观察试纸的颜色变化。
实验现象:
实验结论:
有刺激性气味气体产生,且该气体能使湿润的pH试纸变蓝。
NH4Cl和(NH4)2SO4中含有NH4+
NH4Cl + NaOH —
(NH4)2SO4 + 2NaOH —
化学方程式:
2
2mlNaOH
湿润
pH蕊试纸
试管口
取样(少量放在试管中)与碱液混合加热,若有能使湿润的pH试纸变蓝的气体产生,证明该试样中含有NH4+。
归纳1:NH4+ (铵盐)的检验方法:
NH4Cl + NaOH ==NaCl +H2O+NH3↑
(NH4)2SO4 + 2NaOH ==Na2SO4+2H2O+2NH3 ↑
NH3 使湿润的红色石蕊/pH试纸变蓝
实验原理:
实验2:Cl-的检验
实验步骤:①取两支试管,分别加入少量的_________
______溶液。②再各加入几滴________________溶液,观测实验现象。
实验现象:
实验结论:
加入AgNO3溶液后,出现白色沉淀,沉淀不溶解
溶液中的离子遇AgNO3产生不溶于硝酸的白色沉淀,说明含Cl-
KCl+AgNO3—
NH4Cl+AgNO3—
化学方程式:
稀硝酸的作用是什么?能改用硫酸吗?
排除CO32-、SO32-和SO42-的干扰
SO32- 硝酸 SO42-
NH4Cl
KCl
HNO3和AgNO3
实验原理:
KCl+AgNO3=KNO3+AgCl↓
NH4Cl+AgNO3=NH4NO3+AgCl ↓
AgCl不溶于稀HNO3
取样并向内加入稀HNO3,再加入AgNO3溶液,若生成白色沉淀并且沉淀不溶解,证明该试样中含有Cl- 。
归纳2: Cl-的检验方法:
实验2:SO42-的检验
实验步骤:①取两支试管,分别加入少量的_____________溶液。②再各加入几滴_________________,观测实验现象。
实验现象:
实验结论:
反应生成不溶于稀盐酸的白色沉淀
硫酸铵、硫酸钾中含有SO42-
(NH4)2SO4 + BaCl2 —
K2SO4+BaCl2 —
稀盐酸的作用是什么?能否改用稀硝酸和Ba(NO3)2 ?
化学方程式:
排除SO32-、CO32-、Ag+的干扰
硝酸具有氧化性SO32- SO42-
(NH4)2SO4、K2SO4
稀盐酸和BaCl2溶液
实验原理:
(NH4)2SO4 + BaCl2 =2NH4Cl+BaSO4↓
K2SO4+BaCl2=2KCl+BaSO4 ↓
BaSO4不溶于稀盐酸
取样并向内加稀盐酸,无沉淀生成,再加入BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42-。
归纳3: SO42- (硫酸盐)的检验方法
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2和Fe2(SO4)3溶液,这种试剂是( )
A.NaOH B.Na2CO3
C.AgNO3 D.BaCl2
B
A
如果实验室里有两瓶失去标签的试剂,它们分别是NaCl溶液和KCl溶液,你该怎样鉴别?
注意:焰色反应是指金属元素的性质
很多金属或它们的化合物在灼烧时都会使
火焰呈现出特殊的颜色,这在化学上叫做焰色
反应。
取一根铂丝,放在酒精灯的火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,放入火焰中灼烧,就会观察到不同颜色的火焰。
除杂
实验4:焰色反应
Li
紫红色
Na
黄色
K
紫色
Ca
砖红色
Sr
洋红色
Ba
黄绿色
1、焰色反应是一种物理现象
2、做焰色反应时,酒精灯的灯芯不能被污染
3、事先要将铂丝(铁丝)用HCl洗涤后灼烧到火焰呈无色或接近火焰颜色再实验
元素分析仪
红外光谱仪
原子吸收光谱仪
仪器分析法:
元素分析仪 测定物质中是否含C、H、O、N、S等元素
红外光谱仪 确定物质中是否含有某些有机基团
原子吸收光谱 确定物质中是否含有哪些金属元素
离子 试剂 现象
实验1 NH4+
实验2 Cl—
实验3 SO42—
实验4 K+
NaOH
加热,产生能使湿润的红 色石蕊试纸变蓝的气体
AgNO3、
稀HNO3
生成不溶于稀硝酸的
白色沉淀
稀HCl、
BaCl2
生成不溶于稀盐酸的白色沉淀
焰色反应
透过蓝色钴玻璃,看到火焰呈紫色
实验室里有四瓶标签模糊的试剂,它们分别是NH4Cl、(NH4)2SO4、K2SO4、NaCl。请问你如何鉴定它们的组成?
1、关于某溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有K+
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+
√
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液做焰色反应时火焰呈黄色,则该溶液中一定有钾离子
D.验证烧碱溶液中是否含有Cl-,先加足量稀硝酸,再加入AgNO3溶液,若有白色沉淀,证明含Cl-
2、对下列实验过程的评价,正确的是
√
3、某溶液中含有大量的Cl-、SO42-、OH-三种离子,如果只取一次就能够将3种阴离子依次检验出来,下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④
或 ③②①②④
方法 使用范围 举例
过滤
蒸发
结晶
萃取分液
蒸馏
固体和液体分离
粗盐提纯
分离溶于溶剂中的物质
食盐溶液中的NaCl
混合物各组分在溶剂中溶解度随温度变化不同
NaCl和KNO3混合物分离
化合物在两种互不相溶的溶剂中溶解度的不同,使一种化合物从一种溶剂内转移到另一种溶剂中
用四氯化碳从溴水中提取溴
液体混合物各组分沸点不同,将液液进行分离
蒸馏有机化合物
专题一 化学家眼中的物质世界
第一单元 丰富多彩的化学物质
常见物质的检验
酒中的乙醇分子可以使橙红色的
重铬酸钾(k2Cr2O7)变为绿色的硫酸铬[Cr2(SO4)3]
CuSO4溶液
FeCl3溶液
NaOH
Mg(OH)2
NaOH溶液 H2SO4溶液
颜色
溶解度
气体的溢出
颜色的变化
Na2CO3 Na2SO4
依据物质特殊性质进行检验
(物理性质)
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
依据物质反应时产生的特殊现象(化学性质)
物质的检验与鉴别
待检物质 检验方法 现象
O2
CO2
H2
碳酸盐
(CO32-)
酸
(H+)
碱
(OH-)
淀粉
丝绸制品
用带火星的木条放在装满氧气的集气瓶口
带火星的木条复燃,(利用氧气可燃性)
点燃
与盐酸反应,产生气体通入澄清石灰水
有气体产生,澄清石灰水变浑浊
用紫色石蕊试液;
用pH试纸
紫色石蕊变红;pH试纸变色pH<7
用紫色石蕊试液;用pH试纸
紫色石蕊变蓝;pH试纸变色pH>7
与碘水反应
变蓝
灼烧
有烧焦羽毛的气味
将气体通入澄清石灰水
澄清石灰水变浑浊
用冷的烧杯罩在火焰上方有水珠生成,向烧杯中注入Ca(OH)2不浑浊
常见试纸:
pH试纸:
红色石蕊试纸:
即广范试纸。
石蕊试纸
遇碱性物质变蓝色
蓝色石蕊试纸:
遇酸性物质变红
淀粉试纸
碘
淀粉
蓝
检验液体时应注意?
1、检验液体时不能先湿润(定量时)
2、放在洁净表面皿用玻璃棒蘸取待测液检验
用试纸检验气体需注意?
试纸先湿润
均可用作化肥,请写出上述盐在水溶液中发生电离的电离方程式。
氯化铵、硫酸铵、氯化钾、硫酸钾
NH4Cl==NH4++Cl-
(NH4)2SO4== 2NH4++ SO42-
KCl==K++ Cl-
K2SO4==2K++SO42-
如何检验溶液中有NH4+、Cl-、SO42-存在 ?
可用试剂:
NH4Cl、(NH4)2SO4、K2SO4、KCl、NaOH、 AgNO3、稀HNO3 、KCl、Ba(OH)2、稀HCl、各类试纸
课本P21
资料:
课本P109 常见酸、碱和盐的溶解性表
实验1:NH4+的检验
实验步骤:①取两支试管,分别加入_____ml的NH4Cl和(NH4)2SO4溶液。②再各加入___________溶液。③分别加热两支试管,并将________的_____________试纸靠近__________,观察试纸的颜色变化。
实验现象:
实验结论:
有刺激性气味气体产生,且该气体能使湿润的pH试纸变蓝。
NH4Cl和(NH4)2SO4中含有NH4+
NH4Cl + NaOH —
(NH4)2SO4 + 2NaOH —
化学方程式:
2
2mlNaOH
湿润
pH蕊试纸
试管口
取样(少量放在试管中)与碱液混合加热,若有能使湿润的pH试纸变蓝的气体产生,证明该试样中含有NH4+。
归纳1:NH4+ (铵盐)的检验方法:
NH4Cl + NaOH ==NaCl +H2O+NH3↑
(NH4)2SO4 + 2NaOH ==Na2SO4+2H2O+2NH3 ↑
NH3 使湿润的红色石蕊/pH试纸变蓝
实验原理:
实验2:Cl-的检验
实验步骤:①取两支试管,分别加入少量的_________
______溶液。②再各加入几滴________________溶液,观测实验现象。
实验现象:
实验结论:
加入AgNO3溶液后,出现白色沉淀,沉淀不溶解
溶液中的离子遇AgNO3产生不溶于硝酸的白色沉淀,说明含Cl-
KCl+AgNO3—
NH4Cl+AgNO3—
化学方程式:
稀硝酸的作用是什么?能改用硫酸吗?
排除CO32-、SO32-和SO42-的干扰
SO32- 硝酸 SO42-
NH4Cl
KCl
HNO3和AgNO3
实验原理:
KCl+AgNO3=KNO3+AgCl↓
NH4Cl+AgNO3=NH4NO3+AgCl ↓
AgCl不溶于稀HNO3
取样并向内加入稀HNO3,再加入AgNO3溶液,若生成白色沉淀并且沉淀不溶解,证明该试样中含有Cl- 。
归纳2: Cl-的检验方法:
实验2:SO42-的检验
实验步骤:①取两支试管,分别加入少量的_____________溶液。②再各加入几滴_________________,观测实验现象。
实验现象:
实验结论:
反应生成不溶于稀盐酸的白色沉淀
硫酸铵、硫酸钾中含有SO42-
(NH4)2SO4 + BaCl2 —
K2SO4+BaCl2 —
稀盐酸的作用是什么?能否改用稀硝酸和Ba(NO3)2 ?
化学方程式:
排除SO32-、CO32-、Ag+的干扰
硝酸具有氧化性SO32- SO42-
(NH4)2SO4、K2SO4
稀盐酸和BaCl2溶液
实验原理:
(NH4)2SO4 + BaCl2 =2NH4Cl+BaSO4↓
K2SO4+BaCl2=2KCl+BaSO4 ↓
BaSO4不溶于稀盐酸
取样并向内加稀盐酸,无沉淀生成,再加入BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42-。
归纳3: SO42- (硫酸盐)的检验方法
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2和Fe2(SO4)3溶液,这种试剂是( )
A.NaOH B.Na2CO3
C.AgNO3 D.BaCl2
B
A
如果实验室里有两瓶失去标签的试剂,它们分别是NaCl溶液和KCl溶液,你该怎样鉴别?
注意:焰色反应是指金属元素的性质
很多金属或它们的化合物在灼烧时都会使
火焰呈现出特殊的颜色,这在化学上叫做焰色
反应。
取一根铂丝,放在酒精灯的火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,放入火焰中灼烧,就会观察到不同颜色的火焰。
除杂
实验4:焰色反应
Li
紫红色
Na
黄色
K
紫色
Ca
砖红色
Sr
洋红色
Ba
黄绿色
1、焰色反应是一种物理现象
2、做焰色反应时,酒精灯的灯芯不能被污染
3、事先要将铂丝(铁丝)用HCl洗涤后灼烧到火焰呈无色或接近火焰颜色再实验
元素分析仪
红外光谱仪
原子吸收光谱仪
仪器分析法:
元素分析仪 测定物质中是否含C、H、O、N、S等元素
红外光谱仪 确定物质中是否含有某些有机基团
原子吸收光谱 确定物质中是否含有哪些金属元素
离子 试剂 现象
实验1 NH4+
实验2 Cl—
实验3 SO42—
实验4 K+
NaOH
加热,产生能使湿润的红 色石蕊试纸变蓝的气体
AgNO3、
稀HNO3
生成不溶于稀硝酸的
白色沉淀
稀HCl、
BaCl2
生成不溶于稀盐酸的白色沉淀
焰色反应
透过蓝色钴玻璃,看到火焰呈紫色
实验室里有四瓶标签模糊的试剂,它们分别是NH4Cl、(NH4)2SO4、K2SO4、NaCl。请问你如何鉴定它们的组成?
1、关于某溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定含有K+
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+
√
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液做焰色反应时火焰呈黄色,则该溶液中一定有钾离子
D.验证烧碱溶液中是否含有Cl-,先加足量稀硝酸,再加入AgNO3溶液,若有白色沉淀,证明含Cl-
2、对下列实验过程的评价,正确的是
√
3、某溶液中含有大量的Cl-、SO42-、OH-三种离子,如果只取一次就能够将3种阴离子依次检验出来,下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④
或 ③②①②④
