9.2 溶解度 第二课时(课件21页)
图片预览



文档简介
(共21张PPT)
课题2
溶解度
人教版
初中化学
第二课时
学习目标
了解溶解度曲线的意义,能根据溶解度曲线获得相关信息;
2.能记住气体溶解度的定义和影响因素,能利用气体溶解度曲线解释生活中的有关现象。
温度
(°C)
0
10
20
30
40
50
60
70
80
90
100
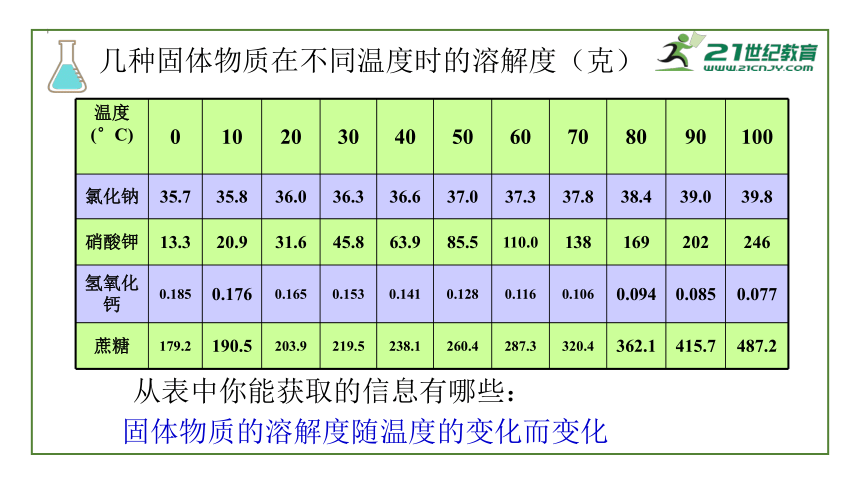
氯化钠
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
氢氧化钙
0.185
0.176
0.165
0.153
0.141
0.128
0.116
0.106
0.094
0.085
0.077
蔗糖
179.2
190.5
203.9
219.5
238.1
260.4
287.3
320.4
362.1
415.7
487.2
几种固体物质在不同温度时的溶解度(克)
从表中你能获取的信息有哪些:
固体物质的溶解度随温度的变化而变化
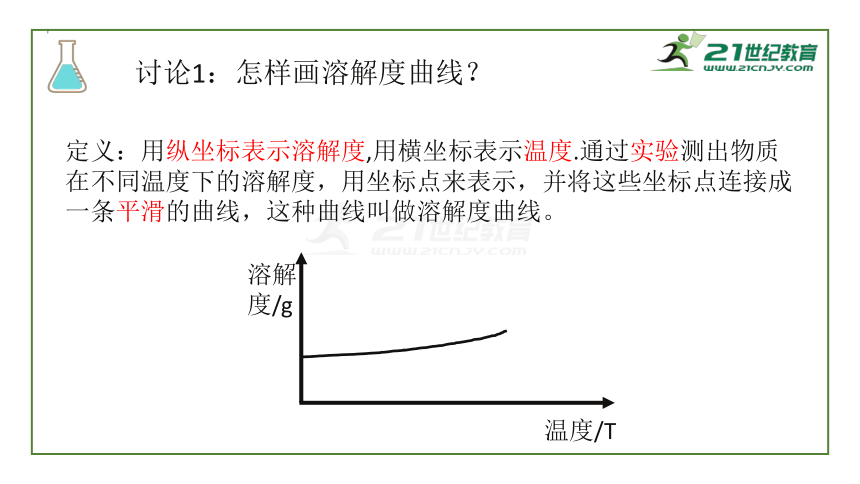
讨论1:怎样画溶解度曲线?
定义:用纵坐标表示溶解度,用横坐标表示温度.通过实验测出物质在不同温度下的溶解度,用坐标点来表示,并将这些坐标点连接成一条平滑的曲线,这种曲线叫做溶解度曲线。
溶解度/g
温度/T
①曲线上的点表示什么?
④线下方的点表示什么?
③线上方的点表示什么?
②两条曲线的交点表示什么?
某物质在某温度下的溶解度
某点所示温度下两种物质的溶解度相同
在该温度下该溶液是饱和溶液且有该物质未溶解
该温度下该溶液是不饱和溶液
4.2.固体溶解度曲线及意义
曲线:曲线越陡,该物质的溶解度受温度影响
越大。
溶解度曲线的应用:
①可以查出某物质在
某温度下的溶解度;
②可以比较不同物质
在同一温度下的溶解
度大小;
③能很快比较出两种
物质在某温度范围内
溶解度的大小
④确定怎样制得某温
度下的某物质的饱和溶液。
溶
解
度
/
克
温度
/℃
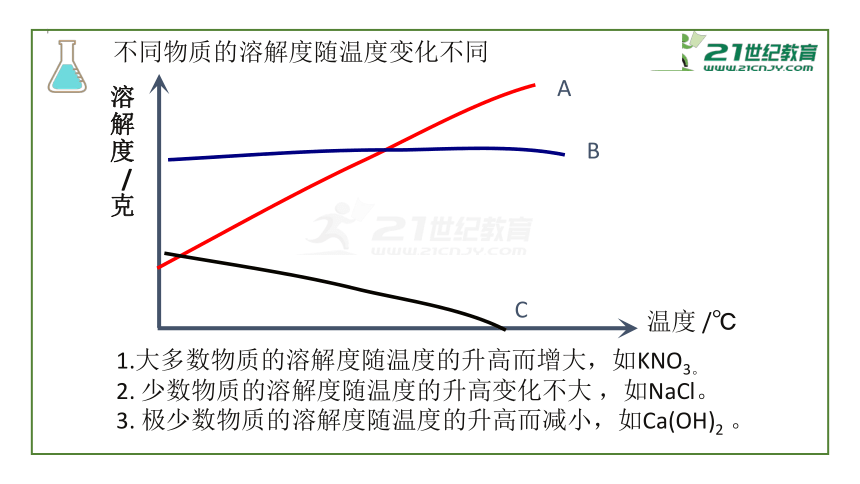
1.大多数物质的溶解度随温度的升高而增大,如KNO3。
2.
少数物质的溶解度随温度的升高变化不大
,如NaCl。
3.
极少数物质的溶解度随温度的升高而减小,如Ca(OH)2
。
A
B
C
不同物质的溶解度随温度变化不同
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
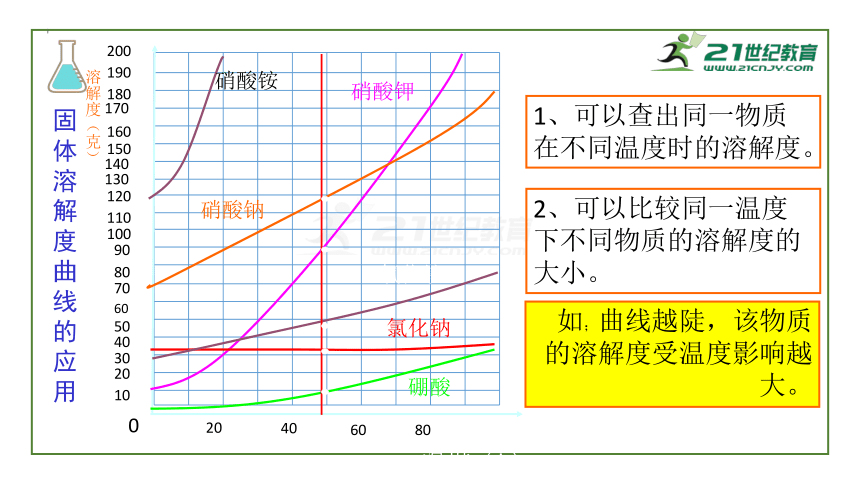
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
1、可以查出同一物质在不同温度时的溶解度。
2、可以比较同一温度下不同物质的溶解度的大小。
如;曲线越陡,该物质的溶解度受温度影响越大。
固体溶解度曲线的应用
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
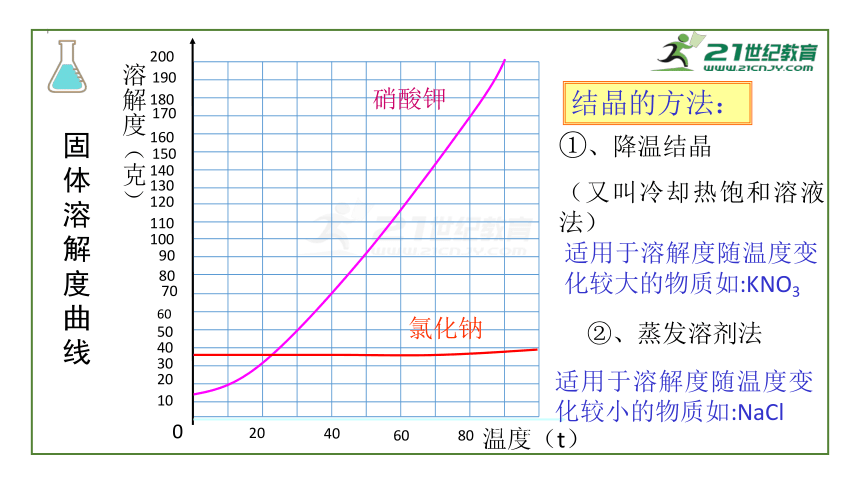
①、降温结晶
(又叫冷却热饱和溶液法)
②、蒸发溶剂法
适用于溶解度随温度变化较小的物质如:NaCl
适用于溶解度随温度变化较大的物质如:KNO3
结晶的方法:
固体溶解度曲线
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
0.10
0.20
70
40
0
10
20
50
60
80
100
30
温度/℃
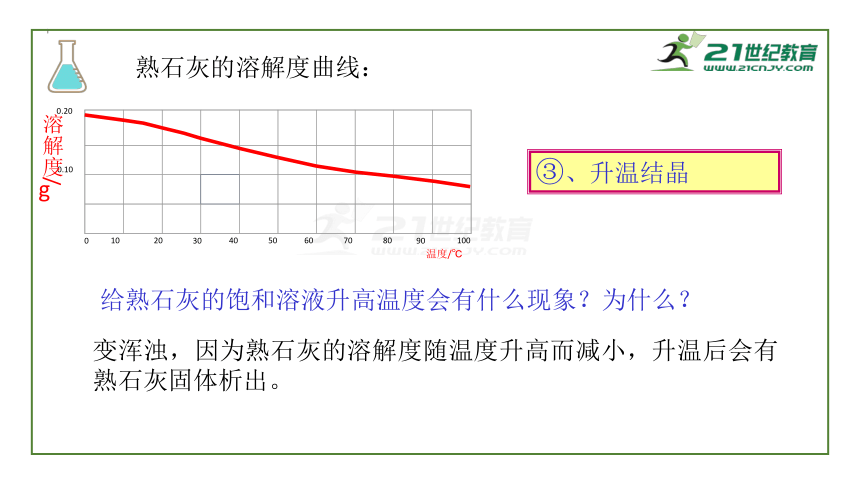
熟石灰的溶解度曲线:
溶解度/
g
③、升温结晶
给熟石灰的饱和溶液升高温度会有什么现象?为什么?
变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出。
90
例1.下图是A、B两种物质的溶解度曲线,试回答下列问题
(1)t1?C时,A
的溶解度
B
的溶解度.(填<
>
或=)
(2)A、B两物质溶解度在温度是
?C时恰好相等。
(3)当A、B两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、降低温度的方法都可以达到饱和的是
物质的溶液。
<
t2
A
例2:甲、乙两种固体的溶解度曲线如下图。现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里,
则下列说法正确的是(
)
A.乙溶液中剩余的固体减少
B.甲溶液中溶质的质量分数增大
C.试管里甲、乙物质的溶解度都增大
D.试管里甲、乙两溶液中的溶质都减少
再放进盛有冰水的烧杯里,
则下列说
再放进盛有冰水的烧杯里,
则下列说
A
温度
0
甲
乙
甲
乙
冰水
C
(
)
溶
解
度
(g)
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
冷却热饱和溶液
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液(又叫母液)中:
NaCl少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
降温结晶法提纯硝酸钾
(又叫冷却热饱和溶液法)
上图是A.B.C三种固体物质的溶解度曲线,回答下列问题:
(1)从B溶液中得到晶体宜采用的方法是
(2)除去A中混有的少量B的方法是
蒸发
配制热饱和溶液,降温结晶,过滤
温度
溶解度
A
B
C
(1)打开汽水盖时,汽水会自动喷出来。
(2)喝了汽水以后,常常会打嗝。
气体的溶解度随温度的升高而减小。
解释下列现象
气体的溶解度随压强的减小而减小。
当温度一定时.气体溶解度一般随压强增大而增大,压强减小而减小。
当压强一定时气体溶解度一般随温度升高而减小,温度降低而增大。
影响气体溶解度的因素:
同种溶质在不同的溶
剂中的溶解能力不同
不同的溶质在同种溶剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶
、可溶
、微溶
难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素
(温度、压强)
表示方法
表示方法
小结:
1.气体的溶解度是指压强为
KPa和一定温度时,气体溶解在1体积水里达到
时的气体体积。
2.盛夏,当天气又闷又热时,大气压较低,鱼池里常常出现鱼儿“浮头”的现象(鱼缺氧浮上水面呼吸),根据上述现象推知:气体的溶解性除受溶质、溶剂性质及温度的影响外,还和
有关;气体的溶解度随温度的
而减少,随
的增大而增大。
101
饱和
压强
压强
升高
课堂训练:
3.1000C硝酸钾饱和溶液冷却至300C,滤去晶体后,所得溶液是________溶液(饱和、不饱和)。
4.把600C时的氯化铵饱和溶液冷却到100C,有氯化铵晶体析出,剩余溶液是:
A.浓溶液
B.稀溶液
C.饱和溶液
D.不饱和溶液
5.200C时,要使硝酸钾不饱和溶液,变为饱和溶液,可采取下列措施中的:
A.温度升高至600C
B.加入硝酸钾
C.加入水
D.加入200C硝酸钾饱和溶液
饱和
C
B
6.下列关于硝酸钾的溶解度的说法,正确的是(
)
A、
20
℃时,20g硝酸钾溶解在100g水里,所以20
℃时硝酸钾的溶解度是20g。
B、
20
℃时,20g硝酸钾溶解在水里制成饱和溶液,所以20
℃时硝酸钾的溶解度是20g。
C、
把31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20
℃时硝酸钾的溶解度是31.6g。
D、
20
℃时,31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20
℃时硝酸钾的溶解度是31.6g。
D
7.右图分别表示A、B、C三种物质的溶解度曲线,则t20C时,其溶解度由大小的顺序是(
)
A.A、B、C
B.
B、A、C
C.B、C
、A
D.C
、A、B
A
B
C
t1
t2
t3
温度
溶解度
B
8.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_________________________
(2)当温度为t1?C,三种物质溶解度由大到小依次为_______,当温度为t3?C时,溶解度最大的是____.
(3)C可能表示哪种物质:
____________________
A和C两种物质在t2?C时的溶解度相同
C>A>B
A
Ca(OH)2或CO2等气体
课题2
溶解度
人教版
初中化学
第二课时
学习目标
了解溶解度曲线的意义,能根据溶解度曲线获得相关信息;
2.能记住气体溶解度的定义和影响因素,能利用气体溶解度曲线解释生活中的有关现象。
温度
(°C)
0
10
20
30
40
50
60
70
80
90
100
氯化钠
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
氢氧化钙
0.185
0.176
0.165
0.153
0.141
0.128
0.116
0.106
0.094
0.085
0.077
蔗糖
179.2
190.5
203.9
219.5
238.1
260.4
287.3
320.4
362.1
415.7
487.2
几种固体物质在不同温度时的溶解度(克)
从表中你能获取的信息有哪些:
固体物质的溶解度随温度的变化而变化
讨论1:怎样画溶解度曲线?
定义:用纵坐标表示溶解度,用横坐标表示温度.通过实验测出物质在不同温度下的溶解度,用坐标点来表示,并将这些坐标点连接成一条平滑的曲线,这种曲线叫做溶解度曲线。
溶解度/g
温度/T
①曲线上的点表示什么?
④线下方的点表示什么?
③线上方的点表示什么?
②两条曲线的交点表示什么?
某物质在某温度下的溶解度
某点所示温度下两种物质的溶解度相同
在该温度下该溶液是饱和溶液且有该物质未溶解
该温度下该溶液是不饱和溶液
4.2.固体溶解度曲线及意义
曲线:曲线越陡,该物质的溶解度受温度影响
越大。
溶解度曲线的应用:
①可以查出某物质在
某温度下的溶解度;
②可以比较不同物质
在同一温度下的溶解
度大小;
③能很快比较出两种
物质在某温度范围内
溶解度的大小
④确定怎样制得某温
度下的某物质的饱和溶液。
溶
解
度
/
克
温度
/℃
1.大多数物质的溶解度随温度的升高而增大,如KNO3。
2.
少数物质的溶解度随温度的升高变化不大
,如NaCl。
3.
极少数物质的溶解度随温度的升高而减小,如Ca(OH)2
。
A
B
C
不同物质的溶解度随温度变化不同
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
1、可以查出同一物质在不同温度时的溶解度。
2、可以比较同一温度下不同物质的溶解度的大小。
如;曲线越陡,该物质的溶解度受温度影响越大。
固体溶解度曲线的应用
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
①、降温结晶
(又叫冷却热饱和溶液法)
②、蒸发溶剂法
适用于溶解度随温度变化较小的物质如:NaCl
适用于溶解度随温度变化较大的物质如:KNO3
结晶的方法:
固体溶解度曲线
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
0.10
0.20
70
40
0
10
20
50
60
80
100
30
温度/℃
熟石灰的溶解度曲线:
溶解度/
g
③、升温结晶
给熟石灰的饱和溶液升高温度会有什么现象?为什么?
变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出。
90
例1.下图是A、B两种物质的溶解度曲线,试回答下列问题
(1)t1?C时,A
的溶解度
B
的溶解度.(填<
>
或=)
(2)A、B两物质溶解度在温度是
?C时恰好相等。
(3)当A、B两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、降低温度的方法都可以达到饱和的是
物质的溶液。
<
t2
A
例2:甲、乙两种固体的溶解度曲线如下图。现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里,
则下列说法正确的是(
)
A.乙溶液中剩余的固体减少
B.甲溶液中溶质的质量分数增大
C.试管里甲、乙物质的溶解度都增大
D.试管里甲、乙两溶液中的溶质都减少
再放进盛有冰水的烧杯里,
则下列说
再放进盛有冰水的烧杯里,
则下列说
A
温度
0
甲
乙
甲
乙
冰水
C
(
)
溶
解
度
(g)
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
冷却热饱和溶液
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液(又叫母液)中:
NaCl少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
降温结晶法提纯硝酸钾
(又叫冷却热饱和溶液法)
上图是A.B.C三种固体物质的溶解度曲线,回答下列问题:
(1)从B溶液中得到晶体宜采用的方法是
(2)除去A中混有的少量B的方法是
蒸发
配制热饱和溶液,降温结晶,过滤
温度
溶解度
A
B
C
(1)打开汽水盖时,汽水会自动喷出来。
(2)喝了汽水以后,常常会打嗝。
气体的溶解度随温度的升高而减小。
解释下列现象
气体的溶解度随压强的减小而减小。
当温度一定时.气体溶解度一般随压强增大而增大,压强减小而减小。
当压强一定时气体溶解度一般随温度升高而减小,温度降低而增大。
影响气体溶解度的因素:
同种溶质在不同的溶
剂中的溶解能力不同
不同的溶质在同种溶剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶
、可溶
、微溶
难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素
(温度、压强)
表示方法
表示方法
小结:
1.气体的溶解度是指压强为
KPa和一定温度时,气体溶解在1体积水里达到
时的气体体积。
2.盛夏,当天气又闷又热时,大气压较低,鱼池里常常出现鱼儿“浮头”的现象(鱼缺氧浮上水面呼吸),根据上述现象推知:气体的溶解性除受溶质、溶剂性质及温度的影响外,还和
有关;气体的溶解度随温度的
而减少,随
的增大而增大。
101
饱和
压强
压强
升高
课堂训练:
3.1000C硝酸钾饱和溶液冷却至300C,滤去晶体后,所得溶液是________溶液(饱和、不饱和)。
4.把600C时的氯化铵饱和溶液冷却到100C,有氯化铵晶体析出,剩余溶液是:
A.浓溶液
B.稀溶液
C.饱和溶液
D.不饱和溶液
5.200C时,要使硝酸钾不饱和溶液,变为饱和溶液,可采取下列措施中的:
A.温度升高至600C
B.加入硝酸钾
C.加入水
D.加入200C硝酸钾饱和溶液
饱和
C
B
6.下列关于硝酸钾的溶解度的说法,正确的是(
)
A、
20
℃时,20g硝酸钾溶解在100g水里,所以20
℃时硝酸钾的溶解度是20g。
B、
20
℃时,20g硝酸钾溶解在水里制成饱和溶液,所以20
℃时硝酸钾的溶解度是20g。
C、
把31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20
℃时硝酸钾的溶解度是31.6g。
D、
20
℃时,31.6g硝酸钾溶解在100g水里,形成饱和溶液,所以20
℃时硝酸钾的溶解度是31.6g。
D
7.右图分别表示A、B、C三种物质的溶解度曲线,则t20C时,其溶解度由大小的顺序是(
)
A.A、B、C
B.
B、A、C
C.B、C
、A
D.C
、A、B
A
B
C
t1
t2
t3
温度
溶解度
B
8.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_________________________
(2)当温度为t1?C,三种物质溶解度由大到小依次为_______,当温度为t3?C时,溶解度最大的是____.
(3)C可能表示哪种物质:
____________________
A和C两种物质在t2?C时的溶解度相同
C>A>B
A
Ca(OH)2或CO2等气体
同课章节目录
