2020-2021学年新教材高中化学人教版第一册 第二章实验活动1 配制一定物质的量浓度的溶液 学案
文档属性
| 名称 | 2020-2021学年新教材高中化学人教版第一册 第二章实验活动1 配制一定物质的量浓度的溶液 学案 |

|
|
| 格式 | docx | ||
| 文件大小 | 130.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-25 00:00:00 | ||
图片预览

文档简介
实验活动1 配制一定物质的量浓度的溶液
学习目标
1.结合物质的量浓度的公式,通过探究配制一定物质的量浓度溶液的方案,认识配制一定物质的量浓度溶液的操作步骤,培养学生严谨求实的科学素养。
2.学会一定物质的量浓度溶液的配制方法,熟悉步骤,帮助学生初步形成良好的实验习惯,能发现生产、生活中有意义的化学问题。
3.通过分工合作完成配制100 mL 1.00 mol·L-1NaCl溶液,记录实验过程中出现的问题,分析其对实验结果产生的影响,并讨论交流,增强解决问题的意识,提高科学探究的能力。
学习重点
容量瓶的使用,配制一定物质的量浓度溶液的操作步骤。
学习难点
分析对物质的量浓度精准度影响的因素。
课堂探究
主题
学习探究过程
提升素养
自主学习
如何配制500g溶质的质量分数为0.9%的生理盐水?
配制一定溶质质量分数溶液的一般步骤: 。?
课堂引入
【思考】配制一定物质的量浓度溶液的意义。
理解在不同应用下选择不同表示方法的科学意义。
一、初步探索
配制溶液的
过程和方法
【回顾】物质的量浓度的定义,对比物质的量浓度的定义式与溶质的质量分数的定义式。
【任务】请同学们思考如何配制100 mL浓度为1.00 mol·L-1的NaCl溶液?写出配制过程的基本步骤。
【讨论】固体溶解后,溶液的体积会发生变化吗?
【思考1】根据配制原理,如何保证物质的量浓度的准确?
【思考2】如何计算称量NaCl固体的质量?
【知识拓展】托盘天平和电子分析天平的精确度。
托盘天平的精确度:0.1 g;
普通电子天平的精确度:0.01 g;
电子分析天平的精确度:0.000 1 g。
构建配制一定物质的量浓度溶液的基本模型。
二、认识
容量瓶
【回顾】回顾烧杯、量筒的使用规则和精确度。
【思考】如何确保溶液体积(V)的准确性?
【知识拓展】容量瓶的常见规格和使用注意事项。
【反馈评价】计算配制480 mL 1.00 mol·L-1的NaOH溶液,需称取的NaOH固体的质量。
正确认识容量瓶的结构特点,归纳容量瓶的使用注意事项。
续 表
主题
学习探究过程
提升素养
三、进一步
探索配制
一定物质
的量浓度
溶液的过
程和方法
【思考1】如何用容量瓶配制100 mL的NaCl溶液?从确保实验精确度的原则出发,试分析操作细节。
提示:溶解放热(如NaOH固体溶解放热、浓硫酸稀释放热等);转移后的小烧杯内壁残留溶质(如将NaOH溶液移液后,向小烧杯内滴加酚酞溶液,溶液变红)
【思考2】如何操作才能保证加水恰好使溶液体积为100 mL?试叙述操作细节。
【思考3】从移液操作迁移到定容操作,认识到为保证溶液体积的精确性,需使用胶头滴管。
【思考4】
①完成上下颠倒摇匀操作后,容量瓶内的凹液面下降对溶液的体积有没有影响?
②装瓶保存时,有少量液体溅出,对溶液的浓度有何影响?
通过解决溶液配制过程中的物理量(n和V)的准确性问题,让学生体验实验操作的严谨性、规范性及定量实验对准确性的要求。
四、配制一
定物质的量
浓度溶液的
误差分析
对所配溶液浓度的准确性进行分析,我们从影响物质的量浓度的两个物理量n和V进行讨论。
【思考】用NaOH固体配制一定物质的量浓度的NaOH溶液。
1.为确保溶质n准确,采取的操作措施有哪些?
2.为确保溶液体积V的准确性,采取的操作措施有哪些?
【思考】若定容时,仰视或俯视刻度线,结果如何分析?请画出仰、俯视示意图。
建立以实验原理(公式)为依据,讨论定量实验误差的思维模型。
小结
【回顾】
1.基本仪器。
2.基本步骤。
3.误差分析原理依据。
核心素养专练
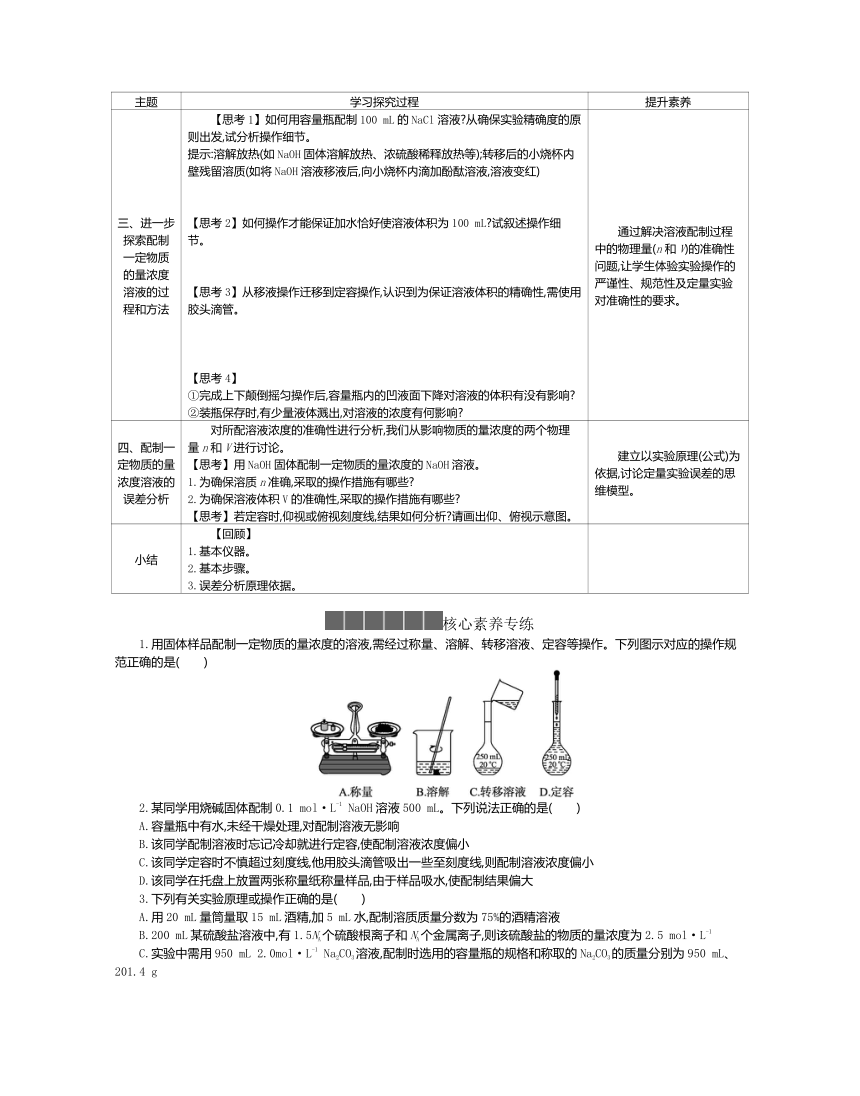
1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范正确的是( )
2.某同学用烧碱固体配制0.1 mol·L-1 NaOH溶液500 mL。下列说法正确的是( )
A.容量瓶中有水,未经干燥处理,对配制溶液无影响
B.该同学配制溶液时忘记冷却就进行定容,使配制溶液浓度偏小
C.该同学定容时不慎超过刻度线,他用胶头滴管吸出一些至刻度线,则配制溶液浓度偏小
D.该同学在托盘上放置两张称量纸称量样品,由于样品吸水,使配制结果偏大
3.下列有关实验原理或操作正确的是( )
A.用20 mL量筒量取15 mL酒精,加5 mL水,配制溶质质量分数为75%的酒精溶液
B.200 mL某硫酸盐溶液中,有1.5NA个硫酸根离子和NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C.实验中需用950 mL 2.0mol·L-1 Na2CO3溶液,配制时选用的容量瓶的规格和称取的Na2CO3的质量分别为950 mL、201.4 g
D.实验室配制500 mL 0.2 mol·L-1硫酸亚铁溶液,其操作是用托盘天平称取15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
4.Ⅰ.用固体烧碱配制480 mL 0.1 mol·L-1的NaOH溶液,请回答以下问题:
(1)需称量 g烧碱固体,它应盛在 中进行称量。?
(2)配制过程中,不需要使用的仪器是 (填字母)。?
A.托盘天平 B.药匙 C.烧杯 D.胶头滴管 E.玻璃棒 F.1 000 mL容量瓶 G.500 mL容量瓶
(3)若配制0.1 mol·L-1的NaOH溶液的其他操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏大的是 (填字母)。?
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溶液溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
Ⅱ.欲用98%的浓硫酸(ρ=1.84 g·cm-3)配制成浓度为0.5 mol·L-1的稀硫酸480 mL。
(1)所需浓硫酸的体积为 mL(保留一位小数)。?
(2)选用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒和 。?
(3)操作正确的顺序为 (填字母)。?
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中,贴上标签
E.稀释浓硫酸 F.冷却至室温后,将溶液转入容量瓶
参考答案
课堂探究
[自主学习]需用托盘天平称取4.5 g NaCl固体,溶解在495.5 mL水中,用玻璃棒搅拌均匀
[提升素养]计算、称量、量取、溶解
[思考]略
一、初步探索配制溶液的过程和方法
[回顾]c=nV;溶质的质量分数=溶质质量溶液质量×100%。
[任务]计算:n(NaCl)=0.1 L×1.00 mol·L-1=0.1 mol, m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。
称取5.85 g NaCl,在烧杯中加入少量水溶解,冷却之后转移到100 mL容量瓶中,摇匀。
[讨论]溶液的体积会发生变化。
[思考1]准确称量溶质的物质的量和确定溶液的体积。
[思考2]通常用电子天平称量5.85 g NaCl固体。
二、认识容量瓶
[回顾]烧杯的精确度为1 mL,量筒的精确度为 0.1 mL。
[思考]选取合适的量筒,准确读数。
[知识拓展]常用容量瓶的规格:50 mL、100 mL、250 mL、500 mL、1 000 mL。
使用容量瓶时的注意事项:
(1)容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失。
(2)在使用前,首先要检查容量瓶是否完好,瓶口处是否漏水。经检查不漏水的容量瓶才能使用。
(3)容量瓶使用完毕,应洗净、晾干。(玻璃磨口瓶塞应在瓶塞与瓶口处垫一张纸条,以免瓶塞与瓶口粘连。)
[反馈评价]称量烧碱固体的质量=0.5 L×1.00 mol·L-1×40 g·mol-1=20.0 g。
三、进一步探索配制一定物质的量浓度溶液的过程和方法
[思考1]某些物质溶解(稀释)后会放热,对溶液体积有影响,因此移液前须冷却至室温;移液过程不能有溶质损失,液体不能粘附在容量瓶刻度线以上,因此用玻璃棒引流,用蒸馏水洗涤小烧杯和玻璃棒2~3次。
[思考2]当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。
[思考4]①无影响。 ②无影响。
四、配制一定物质的量浓度溶液的误差分析
[思考]1.确保n准确的措施:(1)用烧杯盛放NaOH固体,放在电子天平上称量;(2)移液时用玻璃棒引流,然后进行洗涤操作。
2.确保V准确的措施:(1)正确使用规格合适的容量瓶;(2)移液前溶液须冷却至室温;(3)用胶头滴管小心定容,水平观察凹液面最低处与刻度线相切。
[思考]
仰视,V增大,c减小;俯视,V减小,c增大
[小结]1.基本仪器:电子天平、100 mL容量瓶、玻璃棒、胶头滴管等
2.基本步骤:计算、称量、溶解、(冷却)移液、洗涤、定容、摇匀、保存
3.误差分析:c=nV
核心素养专练
1.B 2.A 3.B 4.Ⅰ.(1)2.0 烧杯 (2)F (3)D
Ⅱ.(1)13.6 (2)500 mL容量瓶 (3)AEFCBD
学习目标
1.结合物质的量浓度的公式,通过探究配制一定物质的量浓度溶液的方案,认识配制一定物质的量浓度溶液的操作步骤,培养学生严谨求实的科学素养。
2.学会一定物质的量浓度溶液的配制方法,熟悉步骤,帮助学生初步形成良好的实验习惯,能发现生产、生活中有意义的化学问题。
3.通过分工合作完成配制100 mL 1.00 mol·L-1NaCl溶液,记录实验过程中出现的问题,分析其对实验结果产生的影响,并讨论交流,增强解决问题的意识,提高科学探究的能力。
学习重点
容量瓶的使用,配制一定物质的量浓度溶液的操作步骤。
学习难点
分析对物质的量浓度精准度影响的因素。
课堂探究
主题
学习探究过程
提升素养
自主学习
如何配制500g溶质的质量分数为0.9%的生理盐水?
配制一定溶质质量分数溶液的一般步骤: 。?
课堂引入
【思考】配制一定物质的量浓度溶液的意义。
理解在不同应用下选择不同表示方法的科学意义。
一、初步探索
配制溶液的
过程和方法
【回顾】物质的量浓度的定义,对比物质的量浓度的定义式与溶质的质量分数的定义式。
【任务】请同学们思考如何配制100 mL浓度为1.00 mol·L-1的NaCl溶液?写出配制过程的基本步骤。
【讨论】固体溶解后,溶液的体积会发生变化吗?
【思考1】根据配制原理,如何保证物质的量浓度的准确?
【思考2】如何计算称量NaCl固体的质量?
【知识拓展】托盘天平和电子分析天平的精确度。
托盘天平的精确度:0.1 g;
普通电子天平的精确度:0.01 g;
电子分析天平的精确度:0.000 1 g。
构建配制一定物质的量浓度溶液的基本模型。
二、认识
容量瓶
【回顾】回顾烧杯、量筒的使用规则和精确度。
【思考】如何确保溶液体积(V)的准确性?
【知识拓展】容量瓶的常见规格和使用注意事项。
【反馈评价】计算配制480 mL 1.00 mol·L-1的NaOH溶液,需称取的NaOH固体的质量。
正确认识容量瓶的结构特点,归纳容量瓶的使用注意事项。
续 表
主题
学习探究过程
提升素养
三、进一步
探索配制
一定物质
的量浓度
溶液的过
程和方法
【思考1】如何用容量瓶配制100 mL的NaCl溶液?从确保实验精确度的原则出发,试分析操作细节。
提示:溶解放热(如NaOH固体溶解放热、浓硫酸稀释放热等);转移后的小烧杯内壁残留溶质(如将NaOH溶液移液后,向小烧杯内滴加酚酞溶液,溶液变红)
【思考2】如何操作才能保证加水恰好使溶液体积为100 mL?试叙述操作细节。
【思考3】从移液操作迁移到定容操作,认识到为保证溶液体积的精确性,需使用胶头滴管。
【思考4】
①完成上下颠倒摇匀操作后,容量瓶内的凹液面下降对溶液的体积有没有影响?
②装瓶保存时,有少量液体溅出,对溶液的浓度有何影响?
通过解决溶液配制过程中的物理量(n和V)的准确性问题,让学生体验实验操作的严谨性、规范性及定量实验对准确性的要求。
四、配制一
定物质的量
浓度溶液的
误差分析
对所配溶液浓度的准确性进行分析,我们从影响物质的量浓度的两个物理量n和V进行讨论。
【思考】用NaOH固体配制一定物质的量浓度的NaOH溶液。
1.为确保溶质n准确,采取的操作措施有哪些?
2.为确保溶液体积V的准确性,采取的操作措施有哪些?
【思考】若定容时,仰视或俯视刻度线,结果如何分析?请画出仰、俯视示意图。
建立以实验原理(公式)为依据,讨论定量实验误差的思维模型。
小结
【回顾】
1.基本仪器。
2.基本步骤。
3.误差分析原理依据。
核心素养专练
1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范正确的是( )
2.某同学用烧碱固体配制0.1 mol·L-1 NaOH溶液500 mL。下列说法正确的是( )
A.容量瓶中有水,未经干燥处理,对配制溶液无影响
B.该同学配制溶液时忘记冷却就进行定容,使配制溶液浓度偏小
C.该同学定容时不慎超过刻度线,他用胶头滴管吸出一些至刻度线,则配制溶液浓度偏小
D.该同学在托盘上放置两张称量纸称量样品,由于样品吸水,使配制结果偏大
3.下列有关实验原理或操作正确的是( )
A.用20 mL量筒量取15 mL酒精,加5 mL水,配制溶质质量分数为75%的酒精溶液
B.200 mL某硫酸盐溶液中,有1.5NA个硫酸根离子和NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C.实验中需用950 mL 2.0mol·L-1 Na2CO3溶液,配制时选用的容量瓶的规格和称取的Na2CO3的质量分别为950 mL、201.4 g
D.实验室配制500 mL 0.2 mol·L-1硫酸亚铁溶液,其操作是用托盘天平称取15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
4.Ⅰ.用固体烧碱配制480 mL 0.1 mol·L-1的NaOH溶液,请回答以下问题:
(1)需称量 g烧碱固体,它应盛在 中进行称量。?
(2)配制过程中,不需要使用的仪器是 (填字母)。?
A.托盘天平 B.药匙 C.烧杯 D.胶头滴管 E.玻璃棒 F.1 000 mL容量瓶 G.500 mL容量瓶
(3)若配制0.1 mol·L-1的NaOH溶液的其他操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏大的是 (填字母)。?
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溶液溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
Ⅱ.欲用98%的浓硫酸(ρ=1.84 g·cm-3)配制成浓度为0.5 mol·L-1的稀硫酸480 mL。
(1)所需浓硫酸的体积为 mL(保留一位小数)。?
(2)选用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒和 。?
(3)操作正确的顺序为 (填字母)。?
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中,贴上标签
E.稀释浓硫酸 F.冷却至室温后,将溶液转入容量瓶
参考答案
课堂探究
[自主学习]需用托盘天平称取4.5 g NaCl固体,溶解在495.5 mL水中,用玻璃棒搅拌均匀
[提升素养]计算、称量、量取、溶解
[思考]略
一、初步探索配制溶液的过程和方法
[回顾]c=nV;溶质的质量分数=溶质质量溶液质量×100%。
[任务]计算:n(NaCl)=0.1 L×1.00 mol·L-1=0.1 mol, m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。
称取5.85 g NaCl,在烧杯中加入少量水溶解,冷却之后转移到100 mL容量瓶中,摇匀。
[讨论]溶液的体积会发生变化。
[思考1]准确称量溶质的物质的量和确定溶液的体积。
[思考2]通常用电子天平称量5.85 g NaCl固体。
二、认识容量瓶
[回顾]烧杯的精确度为1 mL,量筒的精确度为 0.1 mL。
[思考]选取合适的量筒,准确读数。
[知识拓展]常用容量瓶的规格:50 mL、100 mL、250 mL、500 mL、1 000 mL。
使用容量瓶时的注意事项:
(1)容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失。
(2)在使用前,首先要检查容量瓶是否完好,瓶口处是否漏水。经检查不漏水的容量瓶才能使用。
(3)容量瓶使用完毕,应洗净、晾干。(玻璃磨口瓶塞应在瓶塞与瓶口处垫一张纸条,以免瓶塞与瓶口粘连。)
[反馈评价]称量烧碱固体的质量=0.5 L×1.00 mol·L-1×40 g·mol-1=20.0 g。
三、进一步探索配制一定物质的量浓度溶液的过程和方法
[思考1]某些物质溶解(稀释)后会放热,对溶液体积有影响,因此移液前须冷却至室温;移液过程不能有溶质损失,液体不能粘附在容量瓶刻度线以上,因此用玻璃棒引流,用蒸馏水洗涤小烧杯和玻璃棒2~3次。
[思考2]当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。
[思考4]①无影响。 ②无影响。
四、配制一定物质的量浓度溶液的误差分析
[思考]1.确保n准确的措施:(1)用烧杯盛放NaOH固体,放在电子天平上称量;(2)移液时用玻璃棒引流,然后进行洗涤操作。
2.确保V准确的措施:(1)正确使用规格合适的容量瓶;(2)移液前溶液须冷却至室温;(3)用胶头滴管小心定容,水平观察凹液面最低处与刻度线相切。
[思考]
仰视,V增大,c减小;俯视,V减小,c增大
[小结]1.基本仪器:电子天平、100 mL容量瓶、玻璃棒、胶头滴管等
2.基本步骤:计算、称量、溶解、(冷却)移液、洗涤、定容、摇匀、保存
3.误差分析:c=nV
核心素养专练
1.B 2.A 3.B 4.Ⅰ.(1)2.0 烧杯 (2)F (3)D
Ⅱ.(1)13.6 (2)500 mL容量瓶 (3)AEFCBD
