2020-2021学年新教材高中化学人教版第一册 第四章 物质结构 元素周期律复习课 学案
文档属性
| 名称 | 2020-2021学年新教材高中化学人教版第一册 第四章 物质结构 元素周期律复习课 学案 |  | |
| 格式 | docx | ||
| 文件大小 | 227.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-25 21:35:14 | ||
图片预览

文档简介
第四章 物质结构 元素周期律复习课
学习目标
1.理解和掌握原子核外电子的排布规律,能够正确书写前20号原子的结构示意图,能够熟练书写常见物质的电子式。
2.了解元素周期表的结构,理解元素周期表与原子结构的关系,会应用元素周期表。
3.巩固元素周期律的实质及内容,通过自主学习过程,培养自己总结问题、归纳问题的能力。
4.能初步具有总结元素递变规律的能力,能把位、构、性初步联系起来并熟练运用。
课堂探究
主题
学习探究过程
提升素养
自主学习
(2019·北京理综)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.49115In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
【初建模型】
解决元素化合物题目的方法: 。?
一、原子结构、
元素的性质
及元素在周
期表中的位置
之间的关系
1.原子结构及原子核外电子的排布规律
【问题1-1】原子如何构成,如何表示原子的结构?
【问题1-2】核外电子如何排布,排布规律是什么?画出N、Cl、Ca原子的结构示意图。
【例1-1】据报道,某些建筑材料会产生对人体不利的放射性同位素?86222Rn。该同位素原子的中子数和质子数之差是( )
A.136 B.50 C.86 D.222
【规律总结】1.质量数、质子数、中子数的关系: 。?
2.原子中质子数和核电荷数、核外电子数的关系: 。?
3.阳离子中质子数和核电荷数、核外电子数的关系: 。?
4.阴离子中质子数和核电荷数、核外电子数的关系: 。?
2.核素、同位素
【问题1-3】什么是核素、同位素?如何区分元素、核素、同位素?我们又是如何确定元素的相对原子质量?
【例1-2】Se是人体必需的微量元素。下列有关?3478Se和?3480Se的说法正确的是( )
A.3478Se和?3480Se互为同素异形体
B.3478Se和?3480Se互为同位素
C.3478Se和?3480Se分别含有44和46个质子
D.3478Se和?3480Se都含有34个中子
3.元素周期表与原子结构的关系
【问题1-4】元素周期表是如何编制的?元素周期表的结构又是怎样的?
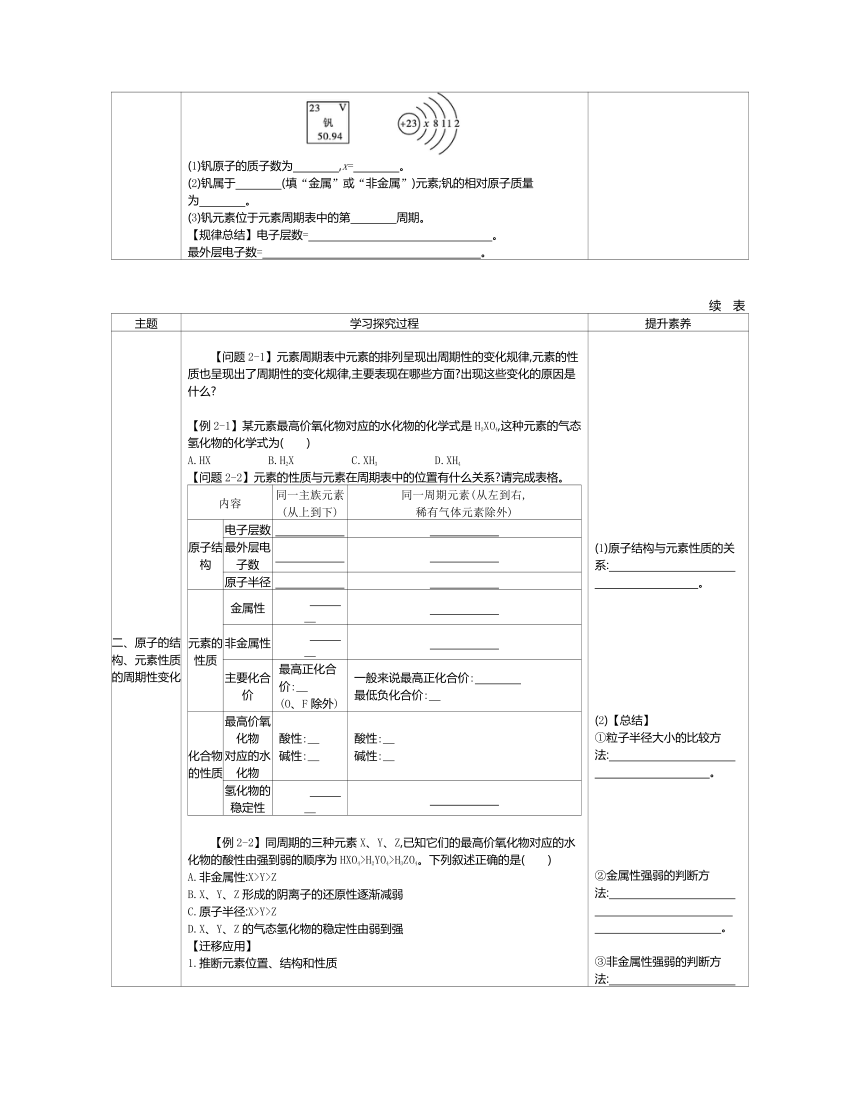
【例1-3】钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为 ,x= 。?
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。?
(3)钒元素位于元素周期表中的第 周期。?
【规律总结】电子层数= 。?
最外层电子数= 。?
(1)原子核外电子排布的规律: 。?
(2)原子的构成: 。?
(3)元素、核素、同位素之间的关系: 。?
(4)原子结构与元素在周期表中的位置的关系: 。?
续 表
主题
学习探究过程
提升素养
二、原子的结
构、元素性质
的周期性变化
【问题2-1】元素周期表中元素的排列呈现出周期性的变化规律,元素的性质也呈现出了周期性的变化规律,主要表现在哪些方面?出现这些变化的原因是什么?
【例2-1】某元素最高价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A.HX B.H2X C.XH3 D.XH4
【问题2-2】元素的性质与元素在周期表中的位置有什么关系?请完成表格。
内容
同一主族元素
(从上到下)
同一周期元素(从左到右,
稀有气体元素除外)
原子结构
电子层数
?
?
最外层电子数
?
?
原子半径
?
?
元素的性质
金属性
?
?
非金属性
?
?
主要化合价
最高正化合价:?
(O、F除外)
一般来说最高正化合价: ?
最低负化合价:?
化合物
的性质
最高价氧化物
对应的水化物
酸性:?
碱性:?
酸性:?
碱性:?
氢化物的稳定性
?
?
【例2-2】同周期的三种元素X、Y、Z,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4。下列叙述正确的是( )
A.非金属性:X>Y>Z
B.X、Y、Z形成的阴离子的还原性逐渐减弱
C.原子半径:X>Y>Z
D.X、Y、Z的气态氢化物的稳定性由弱到强
【迁移应用】
1.推断元素位置、结构和性质
右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是( )
A.三种元素的原子半径的大小顺序是BB.A元素最高价氧化物对应的水化物具有强氧化性和不稳定性
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能与水剧烈反应的单质
2.比较或推断一些性质
R、W、X、Y、Z为原子序数依次递增的同一短周期元素。下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低负化合价为-2价,则Z的最高正化合价为+6价
D.若X的最高正化合价为+5价,则五种元素都是非金属元素
(1)原子结构与元素性质的关系: 。?
(2)【总结】
①粒子半径大小的比较方法: 。?
②金属性强弱的判断方法: 。?
③非金属性强弱的判断方法: 。?
续 表
主题
学习探究过程
提升素养
三、从粒子间
的相互作用
来认识物质
及其变化
【问题3-1】原子间为什么能相互结合?
【问题3-2】哪些元素之间能形成离子键,哪些元素之间能形成共价键?又如何用电子式表示离子化合物和共价化合物?
【例3-1】下列物质的电子式书写正确的是( )
【例3-2】根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是 。(用序号回答,下同)?
(2)含有共价键的离子化合物是 。?
(3)含有共价键的共价化合物是 。?
(4)熔融状态时和固态时,都能导电的有 。?
【经典考题】
(2019·全国卷Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
【评价反馈】
【练习1】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是( )
①钴不是主族元素 ②2760CoCl2不能长期稳定地存在 ③鸟粪石中金属阳离子的结构示意图为 ④鸟粪石中2种阳离子的电子式分别为
A.①②④ B.①②③ C.②③④ D.①③④
【练习2】锗(Ge)是第四周期第ⅣA族元素,处于周期表中金属区与非金属区的交界线上。下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗的单质具有半导体的性能
C.锗是一种非金属性很强的元素
D.锗酸(H4GeO4)是难溶于水的强酸
(1)原子结构与化学键的关系: 。?
(2)电子式书写时的注意事项: 。?
(3)判断化学键类型时的注意事项: 。?
单元整合
请利用思维导图或者框图构建本章的知识体系。
核心素养专练
1.下列各组粒子中属于同位素的是( )
A.16O和18O B.H2O和D2O
C.H2和D2 D.24Mg和24Na
2.下列物质中,只含有离子键,不含有共价键的是( )
A.HCl B.KOH
C.CaCl2 D.CO2
3.下列递变情况中正确的是( )
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
4.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
项目
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(×10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最
低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是 。?
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是 ,名称是 ;碱性最强的化合物的电子式是 ,属于 (填“离子”或“共价”)化合物。?
(3)比较④和⑦的氢化物的稳定性: (用化学式表示)。?
(4)用电子式表示①的氢化物的形成过程: 。?
(5)写出⑦的最高价氧化物对应的水化物与它的氢化物反应的化学方程式: 。?
(6)写出②的最高价氧化物对应的水化物与⑤的氢化物水溶液反应的离子方程式: 。?
参考答案
课堂探究
[自主学习]D
[提升素养]
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
1.原子结构及原子核外电子的排布规律
[问题1-1]原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
[问题1-2]核外电子分层排布,排布规律如下:(1)每个电子层最多排2n2个电子;
(2)最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒第三层排小于等于32个电子;
(3)先排能量低的电子层,后排能量高的电子层。
[例1-1]B
[规律总结]1.质量数=质子数+中子数
2.质子数=核电荷数=核外电子数
3.质子数=核电荷数=离子的核外电子数+离子电荷数
4.质子数=核电荷数=离子的核外电子数-离子电荷数
2.核素、同位素
[问题1-3]
项目
元素
核素
同位素
定义
具有相同质子数(核电荷数)的一类原子的总称
具有一定数目质子和一定数目中子的一种原子
同一元素的不同核素之间的互称
特点
元素的种类由质子数决定
核素的种类由质子数和中子数共同决定
同一元素的同位素的种类由中子数决定
元素的平均相对原子质量:A=A1·x1+A2·x2+A3·x3+……
[例1-2]B
3.元素周期表与原子结构的关系
[问题1-4]把电子层数相同的元素,按原子序数递增的序顺从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列。
元素周期表的结构:7个周期(3个短周期、4个长周期)和16个族(7个主族、7个副族、1个0族、1个第Ⅷ族)。
[例1-3](1)23 2 (2)金属 50.94 (3)四
[规律总结]周期序数
主族序数=最高正化合价数(O、F除外)
[提升素养]
(1)①每个电子层最多排2n2个电子。
②最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒第三层排小于等于32个电子。
③先排能量低的电子层,后排能量高的电子层。
(2)原子的构成原子核质子中子核外电子
(3)
(4)原子结构元素在周期表中的位置
二、原子的结构、元素性质的周期性变化
[问题2-1]主要表现在元素原子的核外电子排布、原子半径、化合价、元素的金属性和非金属性这几个方面。
原因:元素原子的核外电子排布随着原子序数的递增而呈周期性的变化。
[例2-1]B
[问题2-2]结构决定性质
内容
同一主族元素
(从上到下)
同一周期元素(从左到
右,稀有气体元素除外)
原子
结构
电子层数
增多
相同
最外层
电子数
相同
增多
原子半径
增大
减小
元素的
性质
金属性
增强
减弱
非金属性
减弱
增强
主要化
合价
最高正化合价:
相同(O、F除外)
一般来说,
最高正化合价:升高
最低负化合价:升高
化合物
的性质
最高价氧
化物对应
的水化物
酸性:减弱
碱性:增强
酸性:增强
碱性:减弱
氢化物的
稳定性
减弱
增强
[例2-2]A
[迁移应用]
1.A 2.B
[提升素养]
(1)原子结构元素性质
(2)①a.同周期元素(稀有气体元素除外)的原子半径:从左到右,原子半径逐渐减小。
b.同主族元素的原子半径和离子半径:从上到下,原子(离子)半径逐渐增大。
c.电子层结构相同的离子:核电荷数越大,离子半径越小。
d.同种元素的粒子半径:同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径;同种元素形成的不同价态的离子,价态越高,离子半径越小。
②金属性强弱的判断依据:a.金属单质与水或者酸反应的快慢。
b.最高价氧化物对应的水化物的碱性强弱。
c.金属与盐溶液发生的金属间的置换反应。
③非金属性强弱的判断依据:a.非金属单质与氢气反应的难易。
b.气态氢化物的稳定性强弱。
c.最高价氧化物对应的水化物的酸性强弱。
d.非金属单质间的置换反应。
三、从粒子间的相互作用来认识物质及其变化
[问题3-1]原子间可形成化学键。
[问题3-2]一般来说,活泼金属元素(第ⅠA族和第ⅡA族)和活泼非金属元素(第ⅥA族和第ⅦA族)之间可形成离子化合物,非金属元素之间一般形成共价化合物(除铵盐)。
用电子式表示离子化合物时,需标出阳离子和阴离子所带的电荷,且阴离子及铵根离子需用方括号括起来,而用电子式表示共价化合物时,则不需要标出电荷和用方括号将阴离子括起来。
[例3-1]A
[例3-2](1)① (2)③⑤⑥ (3)②④⑦ (4)⑩
[经典考题]C
[评价反馈][练习1]B [练习2]B
[提升素养]
(1)金属元素的原子最外层电子数少于4,非金属元素的原子最外层电子数多于或等于4,一般来说,活泼金属元素(第ⅠA族和第ⅡA族)和活泼非金属元素(第ⅥA族和第ⅦA族)之间可形成离子键,非金属元素之间一般形成共价键(除铵盐)。
(2)①电荷:用电子式表示离子键形成物质的结构时,需标出阳离子和阴离子所带的电荷,而共价键形成物质时不标出电荷。
②方括号:离子键形成物质时,阴离子及铵根离子需用方括号括起来,而共价键形成物质时不用方括号括起来。
(3)①部分物质中不一定含有化学键。如稀有气体分子中不含化学键。
②离子化合物中一定含离子键,可能有共价键。共价化合物中只含有共价键。
③金属元素与非金属元素形成的化合物不一定都是离子化合物,如AlCl3;只由非金属元素形成的化合物不一定是共价化合物,也可能是离子化合物,如铵盐。
核心素养专练
1.A 2.C 3.C
4.(1)Li 硼 第二周期第ⅥA族
(2)HClO4 高氯酸 Na+[··O······H]- 离子
(3)NH3>PH3 (4)2H·+·O·····H··O······H
(5)NH3+HNO3NH4NO3
(6)Mg(OH)2+2H+Mg2++2H2O
学习目标
1.理解和掌握原子核外电子的排布规律,能够正确书写前20号原子的结构示意图,能够熟练书写常见物质的电子式。
2.了解元素周期表的结构,理解元素周期表与原子结构的关系,会应用元素周期表。
3.巩固元素周期律的实质及内容,通过自主学习过程,培养自己总结问题、归纳问题的能力。
4.能初步具有总结元素递变规律的能力,能把位、构、性初步联系起来并熟练运用。
课堂探究
主题
学习探究过程
提升素养
自主学习
(2019·北京理综)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.49115In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
【初建模型】
解决元素化合物题目的方法: 。?
一、原子结构、
元素的性质
及元素在周
期表中的位置
之间的关系
1.原子结构及原子核外电子的排布规律
【问题1-1】原子如何构成,如何表示原子的结构?
【问题1-2】核外电子如何排布,排布规律是什么?画出N、Cl、Ca原子的结构示意图。
【例1-1】据报道,某些建筑材料会产生对人体不利的放射性同位素?86222Rn。该同位素原子的中子数和质子数之差是( )
A.136 B.50 C.86 D.222
【规律总结】1.质量数、质子数、中子数的关系: 。?
2.原子中质子数和核电荷数、核外电子数的关系: 。?
3.阳离子中质子数和核电荷数、核外电子数的关系: 。?
4.阴离子中质子数和核电荷数、核外电子数的关系: 。?
2.核素、同位素
【问题1-3】什么是核素、同位素?如何区分元素、核素、同位素?我们又是如何确定元素的相对原子质量?
【例1-2】Se是人体必需的微量元素。下列有关?3478Se和?3480Se的说法正确的是( )
A.3478Se和?3480Se互为同素异形体
B.3478Se和?3480Se互为同位素
C.3478Se和?3480Se分别含有44和46个质子
D.3478Se和?3480Se都含有34个中子
3.元素周期表与原子结构的关系
【问题1-4】元素周期表是如何编制的?元素周期表的结构又是怎样的?
【例1-3】钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为 ,x= 。?
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。?
(3)钒元素位于元素周期表中的第 周期。?
【规律总结】电子层数= 。?
最外层电子数= 。?
(1)原子核外电子排布的规律: 。?
(2)原子的构成: 。?
(3)元素、核素、同位素之间的关系: 。?
(4)原子结构与元素在周期表中的位置的关系: 。?
续 表
主题
学习探究过程
提升素养
二、原子的结
构、元素性质
的周期性变化
【问题2-1】元素周期表中元素的排列呈现出周期性的变化规律,元素的性质也呈现出了周期性的变化规律,主要表现在哪些方面?出现这些变化的原因是什么?
【例2-1】某元素最高价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A.HX B.H2X C.XH3 D.XH4
【问题2-2】元素的性质与元素在周期表中的位置有什么关系?请完成表格。
内容
同一主族元素
(从上到下)
同一周期元素(从左到右,
稀有气体元素除外)
原子结构
电子层数
?
?
最外层电子数
?
?
原子半径
?
?
元素的性质
金属性
?
?
非金属性
?
?
主要化合价
最高正化合价:?
(O、F除外)
一般来说最高正化合价: ?
最低负化合价:?
化合物
的性质
最高价氧化物
对应的水化物
酸性:?
碱性:?
酸性:?
碱性:?
氢化物的稳定性
?
?
【例2-2】同周期的三种元素X、Y、Z,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4。下列叙述正确的是( )
A.非金属性:X>Y>Z
B.X、Y、Z形成的阴离子的还原性逐渐减弱
C.原子半径:X>Y>Z
D.X、Y、Z的气态氢化物的稳定性由弱到强
【迁移应用】
1.推断元素位置、结构和性质
右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是( )
A.三种元素的原子半径的大小顺序是B
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能与水剧烈反应的单质
2.比较或推断一些性质
R、W、X、Y、Z为原子序数依次递增的同一短周期元素。下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低负化合价为-2价,则Z的最高正化合价为+6价
D.若X的最高正化合价为+5价,则五种元素都是非金属元素
(1)原子结构与元素性质的关系: 。?
(2)【总结】
①粒子半径大小的比较方法: 。?
②金属性强弱的判断方法: 。?
③非金属性强弱的判断方法: 。?
续 表
主题
学习探究过程
提升素养
三、从粒子间
的相互作用
来认识物质
及其变化
【问题3-1】原子间为什么能相互结合?
【问题3-2】哪些元素之间能形成离子键,哪些元素之间能形成共价键?又如何用电子式表示离子化合物和共价化合物?
【例3-1】下列物质的电子式书写正确的是( )
【例3-2】根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是 。(用序号回答,下同)?
(2)含有共价键的离子化合物是 。?
(3)含有共价键的共价化合物是 。?
(4)熔融状态时和固态时,都能导电的有 。?
【经典考题】
(2019·全国卷Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
【评价反馈】
【练习1】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是( )
①钴不是主族元素 ②2760CoCl2不能长期稳定地存在 ③鸟粪石中金属阳离子的结构示意图为 ④鸟粪石中2种阳离子的电子式分别为
A.①②④ B.①②③ C.②③④ D.①③④
【练习2】锗(Ge)是第四周期第ⅣA族元素,处于周期表中金属区与非金属区的交界线上。下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗的单质具有半导体的性能
C.锗是一种非金属性很强的元素
D.锗酸(H4GeO4)是难溶于水的强酸
(1)原子结构与化学键的关系: 。?
(2)电子式书写时的注意事项: 。?
(3)判断化学键类型时的注意事项: 。?
单元整合
请利用思维导图或者框图构建本章的知识体系。
核心素养专练
1.下列各组粒子中属于同位素的是( )
A.16O和18O B.H2O和D2O
C.H2和D2 D.24Mg和24Na
2.下列物质中,只含有离子键,不含有共价键的是( )
A.HCl B.KOH
C.CaCl2 D.CO2
3.下列递变情况中正确的是( )
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
4.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
项目
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(×10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最
低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是 。?
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是 ,名称是 ;碱性最强的化合物的电子式是 ,属于 (填“离子”或“共价”)化合物。?
(3)比较④和⑦的氢化物的稳定性: (用化学式表示)。?
(4)用电子式表示①的氢化物的形成过程: 。?
(5)写出⑦的最高价氧化物对应的水化物与它的氢化物反应的化学方程式: 。?
(6)写出②的最高价氧化物对应的水化物与⑤的氢化物水溶液反应的离子方程式: 。?
参考答案
课堂探究
[自主学习]D
[提升素养]
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
1.原子结构及原子核外电子的排布规律
[问题1-1]原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
[问题1-2]核外电子分层排布,排布规律如下:(1)每个电子层最多排2n2个电子;
(2)最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒第三层排小于等于32个电子;
(3)先排能量低的电子层,后排能量高的电子层。
[例1-1]B
[规律总结]1.质量数=质子数+中子数
2.质子数=核电荷数=核外电子数
3.质子数=核电荷数=离子的核外电子数+离子电荷数
4.质子数=核电荷数=离子的核外电子数-离子电荷数
2.核素、同位素
[问题1-3]
项目
元素
核素
同位素
定义
具有相同质子数(核电荷数)的一类原子的总称
具有一定数目质子和一定数目中子的一种原子
同一元素的不同核素之间的互称
特点
元素的种类由质子数决定
核素的种类由质子数和中子数共同决定
同一元素的同位素的种类由中子数决定
元素的平均相对原子质量:A=A1·x1+A2·x2+A3·x3+……
[例1-2]B
3.元素周期表与原子结构的关系
[问题1-4]把电子层数相同的元素,按原子序数递增的序顺从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列。
元素周期表的结构:7个周期(3个短周期、4个长周期)和16个族(7个主族、7个副族、1个0族、1个第Ⅷ族)。
[例1-3](1)23 2 (2)金属 50.94 (3)四
[规律总结]周期序数
主族序数=最高正化合价数(O、F除外)
[提升素养]
(1)①每个电子层最多排2n2个电子。
②最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒第三层排小于等于32个电子。
③先排能量低的电子层,后排能量高的电子层。
(2)原子的构成原子核质子中子核外电子
(3)
(4)原子结构元素在周期表中的位置
二、原子的结构、元素性质的周期性变化
[问题2-1]主要表现在元素原子的核外电子排布、原子半径、化合价、元素的金属性和非金属性这几个方面。
原因:元素原子的核外电子排布随着原子序数的递增而呈周期性的变化。
[例2-1]B
[问题2-2]结构决定性质
内容
同一主族元素
(从上到下)
同一周期元素(从左到
右,稀有气体元素除外)
原子
结构
电子层数
增多
相同
最外层
电子数
相同
增多
原子半径
增大
减小
元素的
性质
金属性
增强
减弱
非金属性
减弱
增强
主要化
合价
最高正化合价:
相同(O、F除外)
一般来说,
最高正化合价:升高
最低负化合价:升高
化合物
的性质
最高价氧
化物对应
的水化物
酸性:减弱
碱性:增强
酸性:增强
碱性:减弱
氢化物的
稳定性
减弱
增强
[例2-2]A
[迁移应用]
1.A 2.B
[提升素养]
(1)原子结构元素性质
(2)①a.同周期元素(稀有气体元素除外)的原子半径:从左到右,原子半径逐渐减小。
b.同主族元素的原子半径和离子半径:从上到下,原子(离子)半径逐渐增大。
c.电子层结构相同的离子:核电荷数越大,离子半径越小。
d.同种元素的粒子半径:同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径;同种元素形成的不同价态的离子,价态越高,离子半径越小。
②金属性强弱的判断依据:a.金属单质与水或者酸反应的快慢。
b.最高价氧化物对应的水化物的碱性强弱。
c.金属与盐溶液发生的金属间的置换反应。
③非金属性强弱的判断依据:a.非金属单质与氢气反应的难易。
b.气态氢化物的稳定性强弱。
c.最高价氧化物对应的水化物的酸性强弱。
d.非金属单质间的置换反应。
三、从粒子间的相互作用来认识物质及其变化
[问题3-1]原子间可形成化学键。
[问题3-2]一般来说,活泼金属元素(第ⅠA族和第ⅡA族)和活泼非金属元素(第ⅥA族和第ⅦA族)之间可形成离子化合物,非金属元素之间一般形成共价化合物(除铵盐)。
用电子式表示离子化合物时,需标出阳离子和阴离子所带的电荷,且阴离子及铵根离子需用方括号括起来,而用电子式表示共价化合物时,则不需要标出电荷和用方括号将阴离子括起来。
[例3-1]A
[例3-2](1)① (2)③⑤⑥ (3)②④⑦ (4)⑩
[经典考题]C
[评价反馈][练习1]B [练习2]B
[提升素养]
(1)金属元素的原子最外层电子数少于4,非金属元素的原子最外层电子数多于或等于4,一般来说,活泼金属元素(第ⅠA族和第ⅡA族)和活泼非金属元素(第ⅥA族和第ⅦA族)之间可形成离子键,非金属元素之间一般形成共价键(除铵盐)。
(2)①电荷:用电子式表示离子键形成物质的结构时,需标出阳离子和阴离子所带的电荷,而共价键形成物质时不标出电荷。
②方括号:离子键形成物质时,阴离子及铵根离子需用方括号括起来,而共价键形成物质时不用方括号括起来。
(3)①部分物质中不一定含有化学键。如稀有气体分子中不含化学键。
②离子化合物中一定含离子键,可能有共价键。共价化合物中只含有共价键。
③金属元素与非金属元素形成的化合物不一定都是离子化合物,如AlCl3;只由非金属元素形成的化合物不一定是共价化合物,也可能是离子化合物,如铵盐。
核心素养专练
1.A 2.C 3.C
4.(1)Li 硼 第二周期第ⅥA族
(2)HClO4 高氯酸 Na+[··O······H]- 离子
(3)NH3>PH3 (4)2H·+·O·····H··O······H
(5)NH3+HNO3NH4NO3
(6)Mg(OH)2+2H+Mg2++2H2O
