第五单元课题3 利用化学方程式的简单计算
文档属性
| 名称 | 第五单元课题3 利用化学方程式的简单计算 |

|
|
| 格式 | rar | ||
| 文件大小 | 720.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-01 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
利民中学 张世杰
学习目标
1、在理解化学方程式涵义的基础上,掌握有关反应物、生成物质量的计算。
2、通过有关化学方程式计算,掌握化学方程式计算的书写格式,同时培养、提高思维能力和解题能力。
学习重点
1、掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
2、根据化学方程式计算的书写格式规范化。
2H2O 2H2↑ + O2↑
通电
( )克 : ( )克 : 16 克
36 : 4 : 32
若
36克 : ( )克 :( )克
若
这说明:在化学反应中,反应物与生成物之间质量比是成正比例关系。因此,利用正比例关系据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。
18
2
32
4
说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应(或生成物)的质量,可求生成物(反应物)。
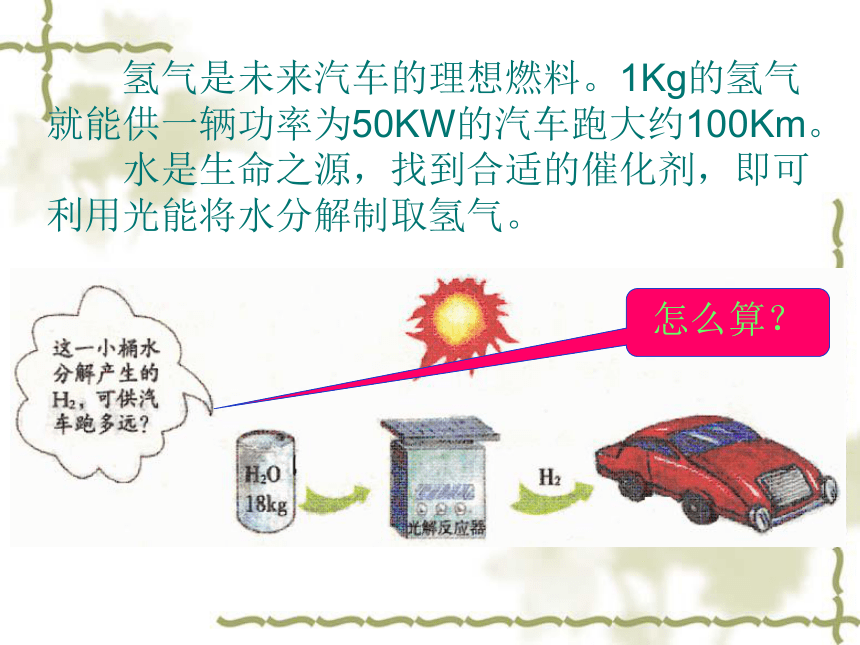
氢气是未来汽车的理想燃料。1Kg的氢气就能供一辆功率为50KW的汽车跑大约100Km。
水是生命之源,找到合适的催化剂,即可利用光能将水分解制取氢气。
怎么算?
要想知道汽车能跑多远,就要弄清楚小桶中那18Kg的水能分解产生多少Kg的氢气?
思路1:可根据化学式的计算求解。
理由:水中的氢元素全部转化为氢气。
解:水中氢元素的质量分数
H的相对原子质量×H的原子数
H2O的相对分子质量
×100%
=
1×2
1×2+16
×100%
=
=11.11%
18Kg的水中所含氢元素的质量为:18Kg ×11.11%=2Kg
所以产生的氢气的质量为2Kg。
困惑:若某种元素没有全部转化为某种物质,求该物质的质量怎么办呢?
化学方程式的意义有哪些?(以电解水的反应为例)
2H2O 2H2↑+O2↑
通电
1、表示水通电生成氢气和氧气。
2、表示每36份质量的水完全反应,生成4份质
量的氢气和32份质量的氧气。
36
4
32
18Kg
?
思路2:利用化学方程式来计算。
2H2O 2H2↑+O2↑
36
4
18Kg
x
解:设小桶中18Kg的水分解 生成氢气的质量为x。
36
18Kg
4
x
=
x
=
2Kg
所以,小桶中的水能使小汽车行驶:2×100=200(Km)
答:18Kg水分解生成的氢气是2Kg。
通电
【例题1】 :加热分解6g高锰酸钾,可以得到氧气多少g?
2KMnO4 K2MnO4 + MnO2 + O2↑
解:设加热分解6g高锰酸钾可以得到氧气的质量为x。
△
316
32
6g
x
6g
32
x
=
=
0.61g
答:加热分解6g高锰酸钾,可以得到0.61g氧气。
【解题步骤】
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比
(4)标出已知量、未知量
(5)列比例式
(6)解比例式
(7)简明地写出答语
【书写格式】
x
316
学习探究
练习2 为保持长时间潜航,在潜水艇中要配备氧气再发生装置,其制氧的方法是利用过氧化钠(Na2O2)与二氧化碳在常温下生成碳酸钠和氧气而制得。其反应的化学方程式为:
2Na2O2+2CO2 2Na2CO3+O2
若要得到48g氧气,需过氧化钠的质量是多少?
解:设若要得到48g氧气,需过氧化钠的质量是x
2Na2O2+2CO2 2Na2CO3+O2
2×78
32
x
48g
x =
234g
2×78
x
32
48g
=
答:要得到48g氧气,需过氧化钠的质量是234g。
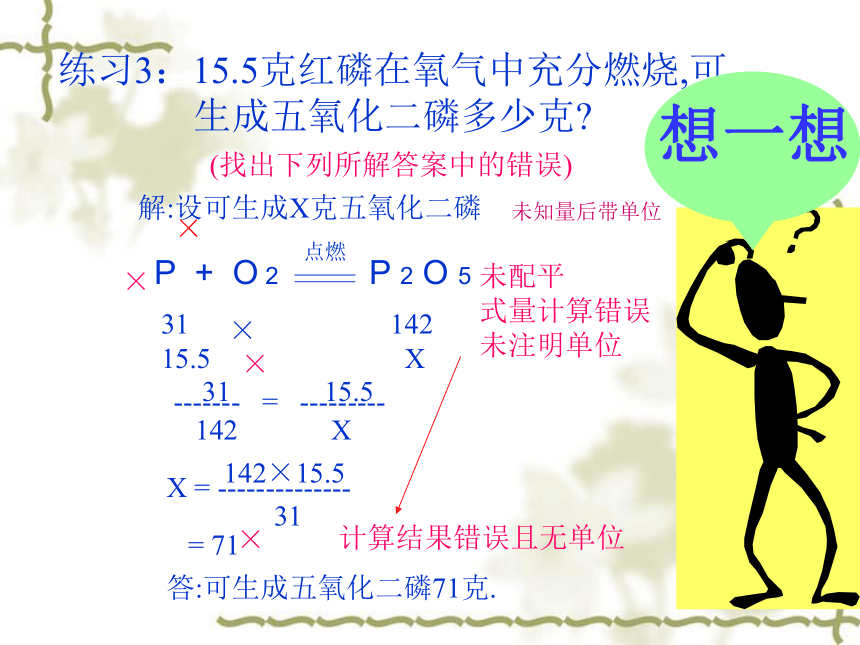
练习3:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成X克五氧化二磷
31 142
15.5 X
31 15.5
------- = ---------
142 X
X = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克.
想一想
×
×
×
×
未配平
式量计算错误
未注明单位
计算结果错误且无单位
×
未知量后带单位
P + O 2 P 2 O 5
点燃
试试你的眼力,下列练习对吗?
燃烧72g镁最多可得氧化镁多少克?
甲同学:解:设燃烧72g镁最多
可得氧化镁质量为x
Mg+O2 MgO
点燃
24
40
72g
x
24
72g
=
X = 120g
答:燃烧72g镁最多
可得氧化镁质量为120g。
乙同学:解:设燃烧72g镁最多
可得氧化镁质量为x
Mg+O2 MgO2
点燃
24
72g
56
x
40
x
24
72g
56
x
=
X = 168g
答:燃烧72g镁最多
可得氧化镁质量为168g。
根据化学方程式计算的注意事项:
(1). 根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2). 解题格式的书写要规范化。
(3). 注意单位的书写要求。
[练习3]:(1) .加热分解12.25克氯酸钾,可得到多少克的氧气
同时生成氯化钾多少克?
(2) .制取4.8克氧气,需要氯酸钾多少克
(1) [解]:设:可得到氧气的质量为X。
2KClO3
MnO2
△
2KCl
+3O2
↑
245
96
12.25克
X
245
-------
96
=
12.25克
-------
X
X =
96×5.8克
--------------
245
= 4.8 克
答:解5.8克氯酸钾可得到氧气 4.8克.
……………...……….写
…………….…………设
}
…………...………….标
……………….……….. 比
…………………...……解
……………………….…..答
149
Y
245 12.25克
------- = ----------
149 Y
Y = ---------------
245
149×12.25克
= 7.45克
可生成氯化钾7.45克.
生成氯化钾的质量为Y
…………...………….算
(2) 解:设:需要氯酸钾的质量为X。
2KCIO3
MnO2
2KCI
+3O2
245
96
△
↑
4.8克
X
245
X
4.8克
96
=
-------
-------
X = --------------
4.8克×245
96
= 12.25克
答:需要氯酸钾12.25克.
课堂练习4
氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气需要氯气多少g?生成氯化氢气体多少g
小结:当所有的反应物和生成物中,只有一种物质的质量未知,可选用
质量守恒定律计算。
练习5:
工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要
碳酸钙多少t?
化学反应计算中的几种方法
计算方法 适用范围
1、利用化学式进行计算
2、利用化学方程式计算
3、利用质量守恒定律计算
物质中的某元素完全转化
到另一种物质中
已知任何一种物质的质量,
可求其他物质的质量
所有反应物和生成物中只
有一种未知
第 二 课 时
1.为使书写的化学方程式遵守____________定律,要在化学方程式两边的化学式的前面配上适当的_______,使化学方程式等号两边各种原子的_______和_______ 都相同,这个过程叫配平。正确的化学方程式应当是配平的,反应物和生成物之间用_________连接,还要标明化学反应发生的______________。如果_________中无气体,_______中有气体,在________的气体______边要注______号;溶液中的反应,如果生成物中有______,则在固体物质的化学式的右边要注______号。
答案:质量守恒 化学计量数 种类 数目 等号
条件 反应物 生成物 生成 右 ↑ 沉淀 ↓
复习巩固类训练
2.在2A+B=2C的反应中,1.2 g A完全反应
生成2 g C,又知B的式量是32,则C的式量为___________。
思路解析:
据质量守恒定律,参加反应的B的质量为
2 g-1.2 g=0.8 g。
设C的式量为x。2A+B 2C
32 2x
0.8g 2 g
32 2x
0.8g 2 g
=
x=40
3. 在反应X+2Y=R+2M中,当1.6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为( )
A.23∶9 B.16∶9 C.32∶9 D.46∶9
思路解析: 此题考查的知识是物质之间发生的反应按一定的质量比进行,反应物和生成物的质量总和相等(即质量守恒)。
设生成M的质量为x。
X+2Y=R + 2M
11 9
4.4 g x
(1)11/4.4 g=9/x,x= 3.6 g。
(2)根据质量守恒定律:Y的质量为:4.4 g+3.6 g-1.6 g=6.4 g。
Y和M的质量之比是:6.4 g∶3.6 g=16∶9。
答案:B
4. 在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____________。
思路解析:此题是根据质量守恒定律确定Y的相对分子质量。解题时,首先要确定4Y的值,即
3×32+4Y=2×102
答案:27
4Y=2×102-3×32=108
Y=27
1.某校学生去旅游,带回了几小块石灰石样品。为了检测其中碳酸钙的含量,甲乙丙丁四同学用浓度相同的盐酸与样品充分反应来进行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测的数据如下表:
甲同学 乙同学 丙同学 丁同学
所取石灰石样品质量(g) 10.0 10.0 10.0 10.0
加入盐酸的质量(g) 20.0 30.0 45.0 50.0
剩余固体的质量(g) 6.0 4.0 1.0 1.0
试回答:
(1)10.0g样品与45g盐酸充分反应后,盐酸是否还有剩余?样品中碳 酸钙的质量分数是多少?
(2)10.0g样品与足量稀盐酸反应后可产生二氧化碳多少克?
能力提升
2.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
序号 加入稀盐酸质量/g 剩余固体质量/g
第1次 10 5.5
第2次 10 m
第3次 10 1.2]
第4次 10 1.2
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克?
(化学方程式:CaCO3 CaO+CO2↑)
(思路解析:
(1)8 g石灰石样品中含有杂质为1.2 g。
(2)样品中碳酸钙的质量分数为:6.8g/8gx100%=85%。
(3)m=5.5 g-(8 g-5.5 g)=3 g。
(4)设需要80%的石灰石的质量为x。
CaCO3 CaO+CO2↑
100 56
x×80% 280 kg
= 625 kg
此题通过不断改变所加入的稀盐酸的质量,观察剩余固体的质量来判断稀盐酸何时不足,石灰石中CaCO3何时完全反应。由表中数据可知,在第三次加入10 g盐酸后,固体剩余物质量不再减少,说明剩余的1.2 g固体不和稀盐酸反应,应为杂质。然后,用8 g石灰石样品质量-杂质质量=CaCO3质量。再除以样品质量,即可求出样品中碳酸钙的质量分数。第(3)问也可从题意得出正解,即第一次加10 g酸时固体的质量减少应和第二次一样,所以第二次剩余的固体质量就是3 g。最后一问可利用含杂质问题的解题方法处理。
答案:(1)1.2 g (2)85% (3)3 (4)625 kg
3.用26.5g氯酸钾和二氧化锰的混合物共热,使充分反应至不在产生气体为止,冷却后称量剩余固体的质量为16.9g。求:
(1)产生氧气的质量;(2)剩余固体中含有那些物质?各为多少克?
(1)根据质量守恒定律,产生氧气的质量为:26.5g-16.9g=9.6g
(2)剩余固体中含有氯化钾和二氧化锰
设生成9.6g氧气,同时生成氯化钾的质量为x
2KClO3 2KCl + 3 O2↑
MnO2
△
96
x 9.6g
149 96
x 9.6g
X=14.9g
二氧化锰的质量为:16.9g-14.9g=2g
答:
(2)剩余固体中含有氯化钾14.9g和二氧化锰2g
解:
解:
4. 某中学九年级和化学小组的同学为测定实验室新购氯酸钾的纯度,取该样品12.5g与4g二氧化锰混合后加热至不再产生气体为止,实验测得产生气体的质量与加热时间的关系如右图所示。请计算(1)完全反应后产生氧气的质量;(2)样品中氯酸钾的纯度。
产生气体的质量/g
时间/min
4.8
2.4
t1
t2
(1)产生氧气的质量为:4.8g
(2)设参加反应的氯酸钾的质量为x
2KClO3 2 KCl + 3 O2↑
△
MnO2
245 96
x 4.8g
245 96
x 4.8g
X=12.25g
12.25g
12.5g
X100%=98%
答:(略)
样品中氯酸钾的纯度:
….
……..
……..…
……
在一定条件下,在密闭容器中发生反应,测得反应过程中各物质的质量如下表所示:
下列判断错误的是
A该反应一定是化合反应
B若X为氧气,则Y一定发生氧化反应
C第二次测量时,Y已完全参加反应
D该反应中,Z与Q质量变化之比为11:9
A
物 质 X Y Z Q
第一次测得的质量/g 68 16 4.4 3.6
第二次测得的质量/g 4 未测 48.4 39.6
则关于此反应认识不正确的是:
A反应后物质M的质量为13g
B反应中N、P的质量比为5:4
C物质Q一定是该反应的催化剂
D该反应属于化合反应
在一个密闭容器中放入M、N、Q、P四中物质,在一定条件下反应,一段时间后测得有关数据如下表:
物 质 M N Q P
反应前质量/g 18 1 2 32
反应后质量/g x 26 2 12
C
课堂小结:
1.根据化学方程式计算的解题步骤
同学们,通过本节课的学习,你有什么收获?
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比
(4)标出已知量、未知量
(5)列比例式
(6)解比例式
(7)简明地写出答语
【三个要领】
(1)步骤要完整(设、写、算、标、列、解、答);
(2)格式要规范;
(3)得数要准确(保留两位小数);
【三个关键】
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
2.根据化学方程式计算的三个要领和三个关键
小结:
根据化学方程式计算要求:
化学方程式要配平
需将纯量代方程
关系式对关系量
计算单位不能忘
关系量间成比例
解设比答要牢记
再见!
利民中学 张世杰
学习目标
1、在理解化学方程式涵义的基础上,掌握有关反应物、生成物质量的计算。
2、通过有关化学方程式计算,掌握化学方程式计算的书写格式,同时培养、提高思维能力和解题能力。
学习重点
1、掌握已知一种反应物(或生成物)的质量,求生成物(或反应物)的质量。
2、根据化学方程式计算的书写格式规范化。
2H2O 2H2↑ + O2↑
通电
( )克 : ( )克 : 16 克
36 : 4 : 32
若
36克 : ( )克 :( )克
若
这说明:在化学反应中,反应物与生成物之间质量比是成正比例关系。因此,利用正比例关系据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(或反应物)的质量。
18
2
32
4
说明:在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应(或生成物)的质量,可求生成物(反应物)。
氢气是未来汽车的理想燃料。1Kg的氢气就能供一辆功率为50KW的汽车跑大约100Km。
水是生命之源,找到合适的催化剂,即可利用光能将水分解制取氢气。
怎么算?
要想知道汽车能跑多远,就要弄清楚小桶中那18Kg的水能分解产生多少Kg的氢气?
思路1:可根据化学式的计算求解。
理由:水中的氢元素全部转化为氢气。
解:水中氢元素的质量分数
H的相对原子质量×H的原子数
H2O的相对分子质量
×100%
=
1×2
1×2+16
×100%
=
=11.11%
18Kg的水中所含氢元素的质量为:18Kg ×11.11%=2Kg
所以产生的氢气的质量为2Kg。
困惑:若某种元素没有全部转化为某种物质,求该物质的质量怎么办呢?
化学方程式的意义有哪些?(以电解水的反应为例)
2H2O 2H2↑+O2↑
通电
1、表示水通电生成氢气和氧气。
2、表示每36份质量的水完全反应,生成4份质
量的氢气和32份质量的氧气。
36
4
32
18Kg
?
思路2:利用化学方程式来计算。
2H2O 2H2↑+O2↑
36
4
18Kg
x
解:设小桶中18Kg的水分解 生成氢气的质量为x。
36
18Kg
4
x
=
x
=
2Kg
所以,小桶中的水能使小汽车行驶:2×100=200(Km)
答:18Kg水分解生成的氢气是2Kg。
通电
【例题1】 :加热分解6g高锰酸钾,可以得到氧气多少g?
2KMnO4 K2MnO4 + MnO2 + O2↑
解:设加热分解6g高锰酸钾可以得到氧气的质量为x。
△
316
32
6g
x
6g
32
x
=
=
0.61g
答:加热分解6g高锰酸钾,可以得到0.61g氧气。
【解题步骤】
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比
(4)标出已知量、未知量
(5)列比例式
(6)解比例式
(7)简明地写出答语
【书写格式】
x
316
学习探究
练习2 为保持长时间潜航,在潜水艇中要配备氧气再发生装置,其制氧的方法是利用过氧化钠(Na2O2)与二氧化碳在常温下生成碳酸钠和氧气而制得。其反应的化学方程式为:
2Na2O2+2CO2 2Na2CO3+O2
若要得到48g氧气,需过氧化钠的质量是多少?
解:设若要得到48g氧气,需过氧化钠的质量是x
2Na2O2+2CO2 2Na2CO3+O2
2×78
32
x
48g
x =
234g
2×78
x
32
48g
=
答:要得到48g氧气,需过氧化钠的质量是234g。
练习3:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成X克五氧化二磷
31 142
15.5 X
31 15.5
------- = ---------
142 X
X = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克.
想一想
×
×
×
×
未配平
式量计算错误
未注明单位
计算结果错误且无单位
×
未知量后带单位
P + O 2 P 2 O 5
点燃
试试你的眼力,下列练习对吗?
燃烧72g镁最多可得氧化镁多少克?
甲同学:解:设燃烧72g镁最多
可得氧化镁质量为x
Mg+O2 MgO
点燃
24
40
72g
x
24
72g
=
X = 120g
答:燃烧72g镁最多
可得氧化镁质量为120g。
乙同学:解:设燃烧72g镁最多
可得氧化镁质量为x
Mg+O2 MgO2
点燃
24
72g
56
x
40
x
24
72g
56
x
=
X = 168g
答:燃烧72g镁最多
可得氧化镁质量为168g。
根据化学方程式计算的注意事项:
(1). 根据物质的组成求各化学式的式量与化学式前边系数的乘积之比,计算时必须准确无误。
(2). 解题格式的书写要规范化。
(3). 注意单位的书写要求。
[练习3]:(1) .加热分解12.25克氯酸钾,可得到多少克的氧气
同时生成氯化钾多少克?
(2) .制取4.8克氧气,需要氯酸钾多少克
(1) [解]:设:可得到氧气的质量为X。
2KClO3
MnO2
△
2KCl
+3O2
↑
245
96
12.25克
X
245
-------
96
=
12.25克
-------
X
X =
96×5.8克
--------------
245
= 4.8 克
答:解5.8克氯酸钾可得到氧气 4.8克.
……………...……….写
…………….…………设
}
…………...………….标
……………….……….. 比
…………………...……解
……………………….…..答
149
Y
245 12.25克
------- = ----------
149 Y
Y = ---------------
245
149×12.25克
= 7.45克
可生成氯化钾7.45克.
生成氯化钾的质量为Y
…………...………….算
(2) 解:设:需要氯酸钾的质量为X。
2KCIO3
MnO2
2KCI
+3O2
245
96
△
↑
4.8克
X
245
X
4.8克
96
=
-------
-------
X = --------------
4.8克×245
96
= 12.25克
答:需要氯酸钾12.25克.
课堂练习4
氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气需要氯气多少g?生成氯化氢气体多少g
小结:当所有的反应物和生成物中,只有一种物质的质量未知,可选用
质量守恒定律计算。
练习5:
工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要
碳酸钙多少t?
化学反应计算中的几种方法
计算方法 适用范围
1、利用化学式进行计算
2、利用化学方程式计算
3、利用质量守恒定律计算
物质中的某元素完全转化
到另一种物质中
已知任何一种物质的质量,
可求其他物质的质量
所有反应物和生成物中只
有一种未知
第 二 课 时
1.为使书写的化学方程式遵守____________定律,要在化学方程式两边的化学式的前面配上适当的_______,使化学方程式等号两边各种原子的_______和_______ 都相同,这个过程叫配平。正确的化学方程式应当是配平的,反应物和生成物之间用_________连接,还要标明化学反应发生的______________。如果_________中无气体,_______中有气体,在________的气体______边要注______号;溶液中的反应,如果生成物中有______,则在固体物质的化学式的右边要注______号。
答案:质量守恒 化学计量数 种类 数目 等号
条件 反应物 生成物 生成 右 ↑ 沉淀 ↓
复习巩固类训练
2.在2A+B=2C的反应中,1.2 g A完全反应
生成2 g C,又知B的式量是32,则C的式量为___________。
思路解析:
据质量守恒定律,参加反应的B的质量为
2 g-1.2 g=0.8 g。
设C的式量为x。2A+B 2C
32 2x
0.8g 2 g
32 2x
0.8g 2 g
=
x=40
3. 在反应X+2Y=R+2M中,当1.6 g X与Y完全反应后,生成4.4 g R,且反应生成的R和M的质量之比为11∶9,则在此反应中Y和M的质量之比为( )
A.23∶9 B.16∶9 C.32∶9 D.46∶9
思路解析: 此题考查的知识是物质之间发生的反应按一定的质量比进行,反应物和生成物的质量总和相等(即质量守恒)。
设生成M的质量为x。
X+2Y=R + 2M
11 9
4.4 g x
(1)11/4.4 g=9/x,x= 3.6 g。
(2)根据质量守恒定律:Y的质量为:4.4 g+3.6 g-1.6 g=6.4 g。
Y和M的质量之比是:6.4 g∶3.6 g=16∶9。
答案:B
4. 在化学反应3X+4Y=2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为____________。
思路解析:此题是根据质量守恒定律确定Y的相对分子质量。解题时,首先要确定4Y的值,即
3×32+4Y=2×102
答案:27
4Y=2×102-3×32=108
Y=27
1.某校学生去旅游,带回了几小块石灰石样品。为了检测其中碳酸钙的含量,甲乙丙丁四同学用浓度相同的盐酸与样品充分反应来进行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测的数据如下表:
甲同学 乙同学 丙同学 丁同学
所取石灰石样品质量(g) 10.0 10.0 10.0 10.0
加入盐酸的质量(g) 20.0 30.0 45.0 50.0
剩余固体的质量(g) 6.0 4.0 1.0 1.0
试回答:
(1)10.0g样品与45g盐酸充分反应后,盐酸是否还有剩余?样品中碳 酸钙的质量分数是多少?
(2)10.0g样品与足量稀盐酸反应后可产生二氧化碳多少克?
能力提升
2.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
序号 加入稀盐酸质量/g 剩余固体质量/g
第1次 10 5.5
第2次 10 m
第3次 10 1.2]
第4次 10 1.2
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克?
(化学方程式:CaCO3 CaO+CO2↑)
(思路解析:
(1)8 g石灰石样品中含有杂质为1.2 g。
(2)样品中碳酸钙的质量分数为:6.8g/8gx100%=85%。
(3)m=5.5 g-(8 g-5.5 g)=3 g。
(4)设需要80%的石灰石的质量为x。
CaCO3 CaO+CO2↑
100 56
x×80% 280 kg
= 625 kg
此题通过不断改变所加入的稀盐酸的质量,观察剩余固体的质量来判断稀盐酸何时不足,石灰石中CaCO3何时完全反应。由表中数据可知,在第三次加入10 g盐酸后,固体剩余物质量不再减少,说明剩余的1.2 g固体不和稀盐酸反应,应为杂质。然后,用8 g石灰石样品质量-杂质质量=CaCO3质量。再除以样品质量,即可求出样品中碳酸钙的质量分数。第(3)问也可从题意得出正解,即第一次加10 g酸时固体的质量减少应和第二次一样,所以第二次剩余的固体质量就是3 g。最后一问可利用含杂质问题的解题方法处理。
答案:(1)1.2 g (2)85% (3)3 (4)625 kg
3.用26.5g氯酸钾和二氧化锰的混合物共热,使充分反应至不在产生气体为止,冷却后称量剩余固体的质量为16.9g。求:
(1)产生氧气的质量;(2)剩余固体中含有那些物质?各为多少克?
(1)根据质量守恒定律,产生氧气的质量为:26.5g-16.9g=9.6g
(2)剩余固体中含有氯化钾和二氧化锰
设生成9.6g氧气,同时生成氯化钾的质量为x
2KClO3 2KCl + 3 O2↑
MnO2
△
96
x 9.6g
149 96
x 9.6g
X=14.9g
二氧化锰的质量为:16.9g-14.9g=2g
答:
(2)剩余固体中含有氯化钾14.9g和二氧化锰2g
解:
解:
4. 某中学九年级和化学小组的同学为测定实验室新购氯酸钾的纯度,取该样品12.5g与4g二氧化锰混合后加热至不再产生气体为止,实验测得产生气体的质量与加热时间的关系如右图所示。请计算(1)完全反应后产生氧气的质量;(2)样品中氯酸钾的纯度。
产生气体的质量/g
时间/min
4.8
2.4
t1
t2
(1)产生氧气的质量为:4.8g
(2)设参加反应的氯酸钾的质量为x
2KClO3 2 KCl + 3 O2↑
△
MnO2
245 96
x 4.8g
245 96
x 4.8g
X=12.25g
12.25g
12.5g
X100%=98%
答:(略)
样品中氯酸钾的纯度:
….
……..
……..…
……
在一定条件下,在密闭容器中发生反应,测得反应过程中各物质的质量如下表所示:
下列判断错误的是
A该反应一定是化合反应
B若X为氧气,则Y一定发生氧化反应
C第二次测量时,Y已完全参加反应
D该反应中,Z与Q质量变化之比为11:9
A
物 质 X Y Z Q
第一次测得的质量/g 68 16 4.4 3.6
第二次测得的质量/g 4 未测 48.4 39.6
则关于此反应认识不正确的是:
A反应后物质M的质量为13g
B反应中N、P的质量比为5:4
C物质Q一定是该反应的催化剂
D该反应属于化合反应
在一个密闭容器中放入M、N、Q、P四中物质,在一定条件下反应,一段时间后测得有关数据如下表:
物 质 M N Q P
反应前质量/g 18 1 2 32
反应后质量/g x 26 2 12
C
课堂小结:
1.根据化学方程式计算的解题步骤
同学们,通过本节课的学习,你有什么收获?
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比
(4)标出已知量、未知量
(5)列比例式
(6)解比例式
(7)简明地写出答语
【三个要领】
(1)步骤要完整(设、写、算、标、列、解、答);
(2)格式要规范;
(3)得数要准确(保留两位小数);
【三个关键】
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
2.根据化学方程式计算的三个要领和三个关键
小结:
根据化学方程式计算要求:
化学方程式要配平
需将纯量代方程
关系式对关系量
计算单位不能忘
关系量间成比例
解设比答要牢记
再见!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
