2011年高中化学 第1课时混合物的分离和提纯课件
文档属性
| 名称 | 2011年高中化学 第1课时混合物的分离和提纯课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 711.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-01 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
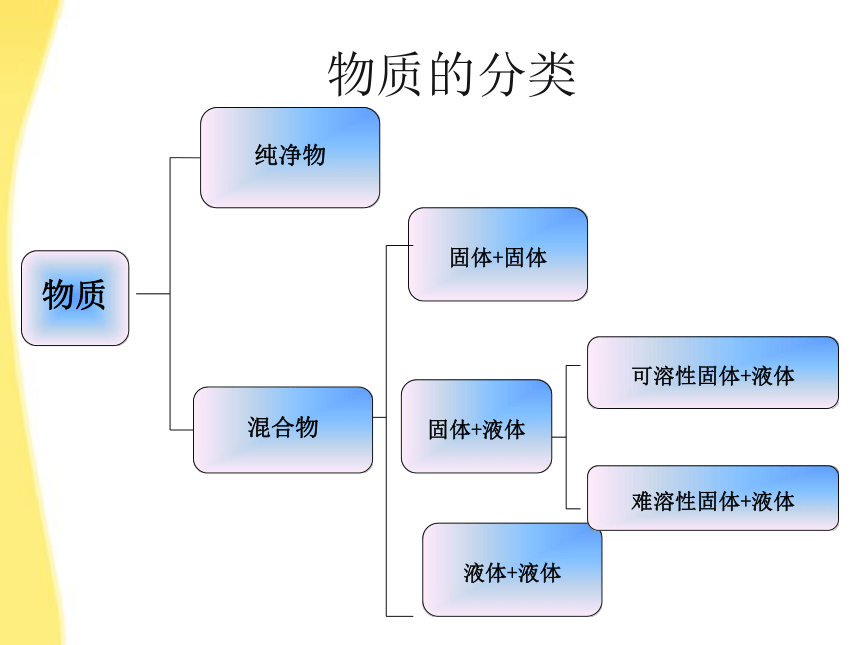
固体+固体
物质的分类
物质
纯净物
混合物
液体+液体
难溶性固体+液体
可溶性固体+液体
固体+液体
1 混合物的分离和提纯的含义和区别
2 混合物的分离和提纯的常用方法和分类
3 混合物的分离和提纯的常用方法之 “过滤和蒸发”
4 混合物的分离和提纯的常用方法之“蒸馏和萃取”
二、混合物的分离和提纯
不增:不引入新的杂质。
不变:不能改变被提纯物质的性质和质量尽量不减少。
易分:被提纯物与杂质易分离。
混合物的分离:将混合物中各物质用物理或化学方法将各成分彼此分开的过程。
混合物的提纯 :将混合物中的杂质除去,以得到纯净物质的过程。物质提纯的原则为:不增、不变、易分。
1.混合物的分离和提纯的含义和区别
思考与交流(P5)
1、利用什么方法和性质将金子与沙子分离?
2、如何分离铁屑和沙子?
固体和固体混合
物理方法:过滤、蒸发、蒸馏、萃取、结晶、分液、渗析等
化学方法:灼烧、洗气、固体试剂吸收等
2.混合物的分离和提纯常用的方法和分类
按实质分:
固体和液体混合物
1、如何从沙和水的混合物中得到沙
2、如何从食盐水中得到NaC晶体。
(难溶性固体+液体)
(可溶性固体+液体)
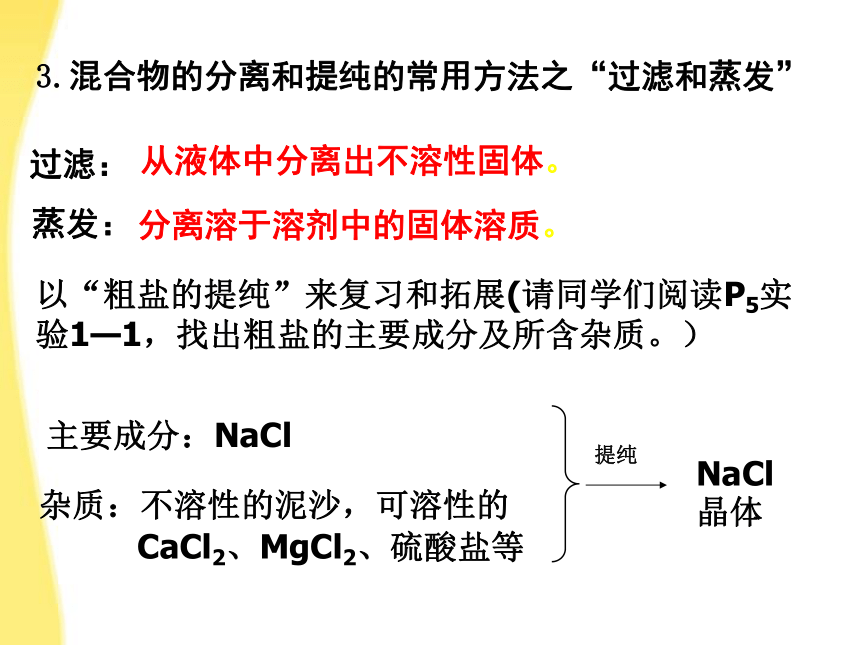
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
以“粗盐的提纯”来复习和拓展(请同学们阅读P5实验1—1,找出粗盐的主要成分及所含杂质。)
杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等
主要成分:NaCl
提纯
NaCl
晶体
3.混合物的分离和提纯的常用方法之“过滤和蒸发”
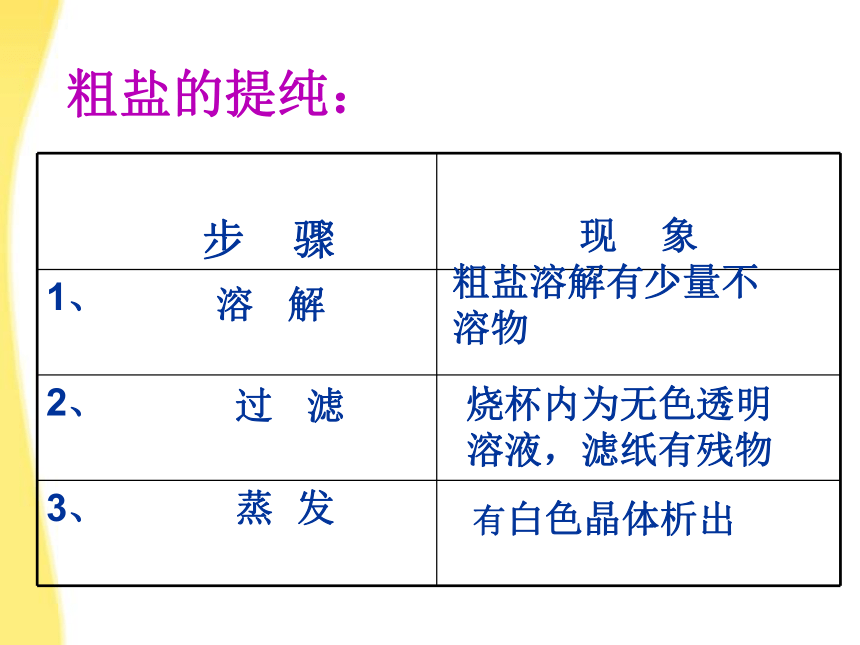
步 骤
现 象
1、
2、
3、
溶 解
过 滤
蒸 发
烧杯内为无色透明
溶液,滤纸有残物
有白色晶体析出
粗盐溶解有少量不溶物
粗盐的提纯:
1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)当有大量晶体析出
时停止加热。
(4)取下未冷却的蒸发
皿时,要放在石棉网
玻璃棒的作用
溶解:搅拌,加速溶解
过滤:引流
蒸发:搅拌,防止局部温度过高,使液体飞溅
问题讨论:
[实验1-1]得到的盐是纯净的NaCl吗?可能还有什么杂质没有除去?用什么方法可以检验它们呢?
纯净的NaCl
粗盐
溶 解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
蒸 发
过 滤
1、如何检验未知溶液中是否含有SO42- ?
实验1-2
取【实验1-1】得到的盐约0.5g放入试管中,向试管中加入约2 mL水配成溶液,先加稀盐酸使溶液酸化,然后向试管中滴入几滴BaCl2溶液。观察现象。
现象:
有白色沉淀生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
离子的检验:
试剂:稀盐酸和BaCl2溶液
加入稀盐酸的原因:排除Ag+ CO32-对SO42-检验的干扰。
思考1:还能通过检验哪些离子来说明所得到的氯化钠不纯,应采用什么试剂来检验?
2、你还记得以下离子的检验吗
有白色沉淀生成
NaCl + AgNO3 = AgCl↓+ NaNO3
检验H+ :
检验OH- :
检验CO32- :
检验CI- :
试剂
现象
稀硝酸和AgNO3溶液
先加盐酸,产生的气体通入澄清石灰水
澄清石灰水变浑浊
紫色石蕊溶液
酚酞溶液
溶液变红
溶液变红
CaCl2+Na2CO3=CaCO3↓+2NaCl
Na2CO3溶液
CaCl2
MgCl2+2NaOH=Mg(OH)2↓
+2NaCl
NaOH溶液
MgCl2
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2溶液
硫酸盐
化学方程式
加入的试剂
杂质
思考与交流(P7)
⑴如果要除去粗盐中含有的可溶性杂质MgCl2 、CaCl2以及一些硫酸盐,应加入什么试剂?属分离还是提纯?
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+ Cl-
适量HCl
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+ Cl-
适量HCl
不增
不减
易分
除杂原则
不增
不减
易分
不引入新的杂质。
除杂原则
不增
不减
易分
不引入新的杂质。
不消耗被提纯的物质
除杂原则
不增
不减
易分
不引入新的杂质。
不消耗被提纯的物质
杂质转化为沉淀、气体等,易分离出去。
除杂原则
注意事项:
1、除杂试剂要过量
2、过量试剂要除尽
3、去除多种杂质时要考虑加入试剂的顺序
4、选择最佳的除杂途径
学与问(P5)
在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗?
固体+固体
物质的分类
物质
纯净物
混合物
液体+液体
难溶性固体+液体
可溶性固体+液体
固体+液体
1 混合物的分离和提纯的含义和区别
2 混合物的分离和提纯的常用方法和分类
3 混合物的分离和提纯的常用方法之 “过滤和蒸发”
4 混合物的分离和提纯的常用方法之“蒸馏和萃取”
二、混合物的分离和提纯
不增:不引入新的杂质。
不变:不能改变被提纯物质的性质和质量尽量不减少。
易分:被提纯物与杂质易分离。
混合物的分离:将混合物中各物质用物理或化学方法将各成分彼此分开的过程。
混合物的提纯 :将混合物中的杂质除去,以得到纯净物质的过程。物质提纯的原则为:不增、不变、易分。
1.混合物的分离和提纯的含义和区别
思考与交流(P5)
1、利用什么方法和性质将金子与沙子分离?
2、如何分离铁屑和沙子?
固体和固体混合
物理方法:过滤、蒸发、蒸馏、萃取、结晶、分液、渗析等
化学方法:灼烧、洗气、固体试剂吸收等
2.混合物的分离和提纯常用的方法和分类
按实质分:
固体和液体混合物
1、如何从沙和水的混合物中得到沙
2、如何从食盐水中得到NaC晶体。
(难溶性固体+液体)
(可溶性固体+液体)
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
以“粗盐的提纯”来复习和拓展(请同学们阅读P5实验1—1,找出粗盐的主要成分及所含杂质。)
杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等
主要成分:NaCl
提纯
NaCl
晶体
3.混合物的分离和提纯的常用方法之“过滤和蒸发”
步 骤
现 象
1、
2、
3、
溶 解
过 滤
蒸 发
烧杯内为无色透明
溶液,滤纸有残物
有白色晶体析出
粗盐溶解有少量不溶物
粗盐的提纯:
1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)当有大量晶体析出
时停止加热。
(4)取下未冷却的蒸发
皿时,要放在石棉网
玻璃棒的作用
溶解:搅拌,加速溶解
过滤:引流
蒸发:搅拌,防止局部温度过高,使液体飞溅
问题讨论:
[实验1-1]得到的盐是纯净的NaCl吗?可能还有什么杂质没有除去?用什么方法可以检验它们呢?
纯净的NaCl
粗盐
溶 解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
蒸 发
过 滤
1、如何检验未知溶液中是否含有SO42- ?
实验1-2
取【实验1-1】得到的盐约0.5g放入试管中,向试管中加入约2 mL水配成溶液,先加稀盐酸使溶液酸化,然后向试管中滴入几滴BaCl2溶液。观察现象。
现象:
有白色沉淀生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
离子的检验:
试剂:稀盐酸和BaCl2溶液
加入稀盐酸的原因:排除Ag+ CO32-对SO42-检验的干扰。
思考1:还能通过检验哪些离子来说明所得到的氯化钠不纯,应采用什么试剂来检验?
2、你还记得以下离子的检验吗
有白色沉淀生成
NaCl + AgNO3 = AgCl↓+ NaNO3
检验H+ :
检验OH- :
检验CO32- :
检验CI- :
试剂
现象
稀硝酸和AgNO3溶液
先加盐酸,产生的气体通入澄清石灰水
澄清石灰水变浑浊
紫色石蕊溶液
酚酞溶液
溶液变红
溶液变红
CaCl2+Na2CO3=CaCO3↓+2NaCl
Na2CO3溶液
CaCl2
MgCl2+2NaOH=Mg(OH)2↓
+2NaCl
NaOH溶液
MgCl2
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2溶液
硫酸盐
化学方程式
加入的试剂
杂质
思考与交流(P7)
⑴如果要除去粗盐中含有的可溶性杂质MgCl2 、CaCl2以及一些硫酸盐,应加入什么试剂?属分离还是提纯?
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+ Cl-
适量HCl
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+ Cl-
适量HCl
不增
不减
易分
除杂原则
不增
不减
易分
不引入新的杂质。
除杂原则
不增
不减
易分
不引入新的杂质。
不消耗被提纯的物质
除杂原则
不增
不减
易分
不引入新的杂质。
不消耗被提纯的物质
杂质转化为沉淀、气体等,易分离出去。
除杂原则
注意事项:
1、除杂试剂要过量
2、过量试剂要除尽
3、去除多种杂质时要考虑加入试剂的顺序
4、选择最佳的除杂途径
学与问(P5)
在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗?
