第三节 硫的氧化物和硫酸
图片预览







文档简介
(共54张PPT)
自然界中的硫
1.不同价态硫的转化
(1)地表
地层深处硫元素
(2)地下
熔融态的硫与有关物质反应生成矿物,如黄铁矿( FeS2 ),雄黄( As4S4),雌黄( As2S3 ),辰砂( HgS )等,它们与O2、H2O等作用生成新的物质,如石膏( CaSO4·2H2O ),芒硝(Na2SO4·10H2O)等。
火山喷发
H2S
SO2、SO3
O2、H2O
阳光
H2SO3、H2SO4、
微生物
S、H2S
第三节 硫的氧化物和硫酸
2.硫的存在及物理性质
硫单质俗名硫黄,主要存在于火山口附近或地壳的岩层里。
硫单质是一种 淡黄 色的固体,
硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
熔点:113℃ 沸点:444.6℃
(1).存在形态
A.游离态:
如硫铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)和芒硝(Na2SO4·10H2O)等。
B.化合态:
主要以金属硫化物和硫酸盐的形式存在,
(2)物理性质
难溶于水,微溶于酒精,易溶于CS2。(用于洗去试管壁上的硫);
S+
(2)与非金属反应
S+
点燃
300℃
产生具有 臭鸡蛋 气味的气体硫作氧化剂。
④与 Na 加热 或研磨爆炸:2Na+S == Na2S
Cu2S
产生红热现象,生成 黑 色物质
①Cu
②Fe
FeS
产生红热现象,生成 黑 色固体
③Hg
HgS
此反应易发生,可用于除去撒落 的Hg
3.硫的化学性质
(1)与金属反应
⑤
Al
Al2S3
不能有水
①O2
SO2
产生 蓝紫 色火焰(在纯氧中)和刺激性气味的气体
②H2
H2S
③ C
CS2
(3)与某些化合物反应
①硫跟浓硫酸反应的方程式:
S+2H2SO4(浓) 3SO2↑+2H2O
②硫与浓硝酸反应的方程式为:
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
③与碱反应:
3S+6KOH 2K2S+K2SO3+3H2O
④ S+2KNO3+3C K2S ↑ + N2 ↑ + 3CO2 ↑
4.用途:大量用于制造硫酸、硫化天然橡胶,
也用于制药、黑火药 、农药 、火柴。
硫的性质小结:
1.从硫是非金属单质且熔、沸点较低,可以判断出硫是分子晶体。
2.比较硫与铁、铜反应及氯气与铁、铜反应生成物中金属元素的化合价,可判断氯原子得电子能力比硫原子强,从而推断出氯气的氧化性比硫强。
3.实验室中的仪器如果粘有硫,可以用二硫化碳进行洗涤,也可用热的氢氧化钠溶液洗涤。
4.在单质硫中,硫元素的化合价是0价,处于中间价态,所以硫既有氧化性又有还原性,如上述化学性质。
物理性质 气味
毒性
溶解性
化
学
性
质
与水的反应
与碱的
反应
二、硫的氧化物 —— SO2
SO2
CO2
无色有刺激性气味易液化(-10℃)
无色无味
有毒 、密度比空气大
无毒 密度比空气大
易溶(体积比1∶40)
可溶(体积比1∶1)
SO2+H2O??H2SO3
CO2+H2O ?H2CO3
SO2气体通入澄清石灰水中,先生成沉淀,当气体过量时
沉淀又溶解Ca(OH)2+SO2
=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
CO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+CO2
=CaCO3↓+H2O
CaCO3+CO2+H2O
=Ca(HCO3)2
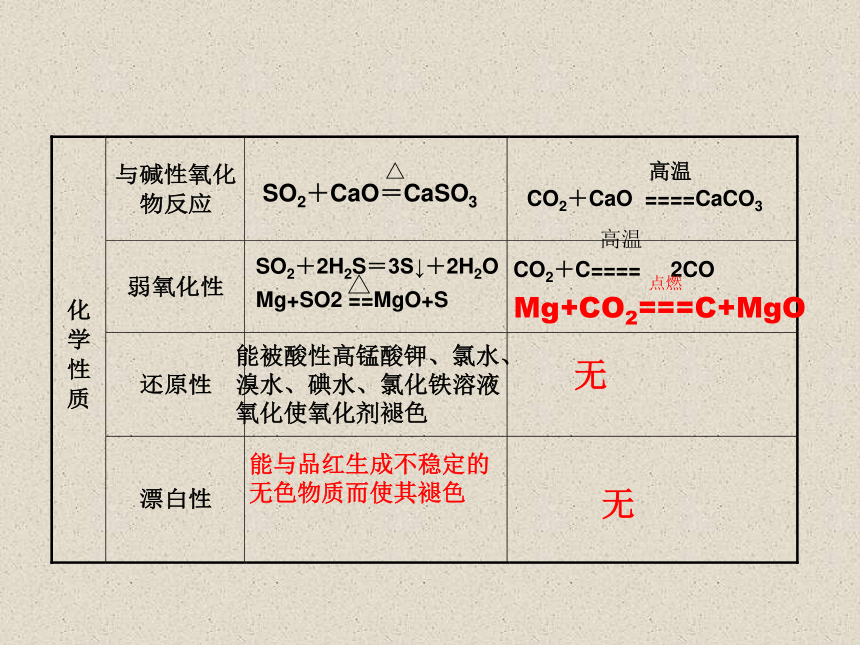
SO2+2H2S=3S↓+2H2O
Mg+SO2 ==MgO+S
CO2+C==== 2CO
高温
Mg+CO2===C+MgO
点燃
能被酸性高锰酸钾、氯水、
溴水、碘水、氯化铁溶液
氧化使氧化剂褪色
CO2+CaO ====CaCO3
高温
能与品红生成不稳定的
无色物质而使其褪色
无
无
SO2+CaO=CaSO3
△
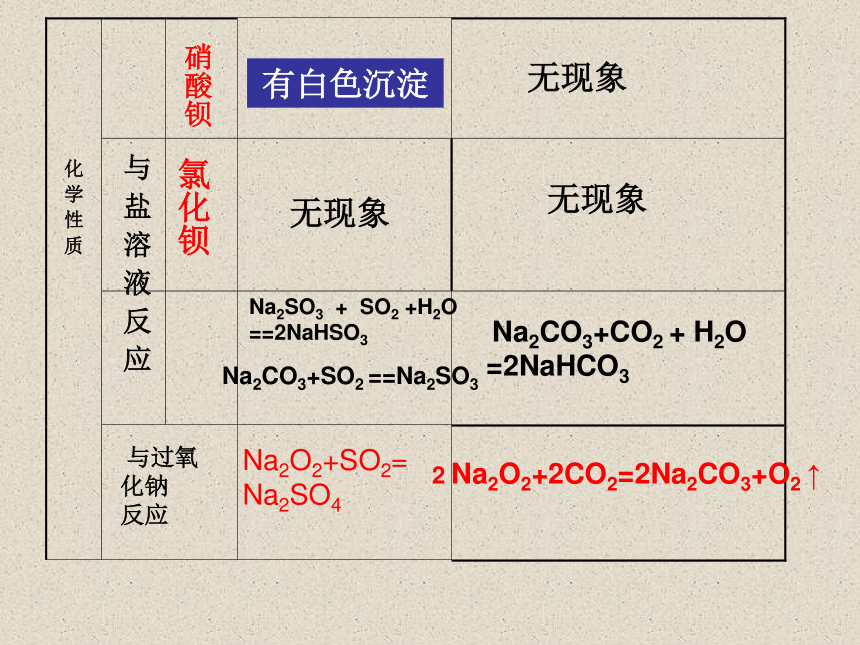
与盐溶液反应
硝酸钡
氯化钡
有白色沉淀
无现象
无现象
无现象
Na2SO3 + SO2 +H2O
==2NaHSO3
Na2CO3+SO2 ==Na2SO3
Na2CO3+CO2 + H2O =2NaHCO3
与过氧
化钠
反应
Na2O2+SO2=
Na2SO4
2 Na2O2+2CO2=2Na2CO3+O2 ↑
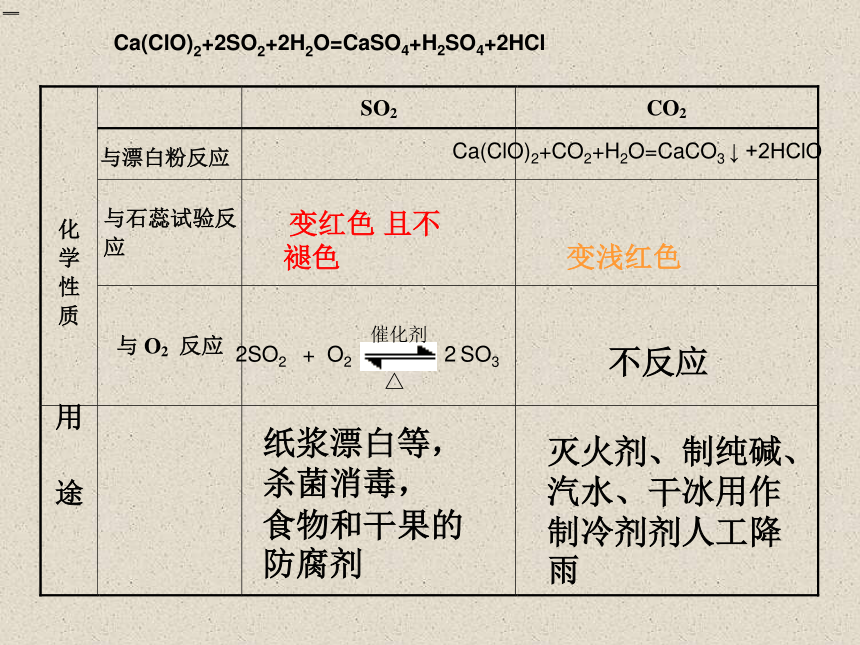
变红色 且不褪色
变浅红色
2SO2 + O2 2 SO3
催化剂
△
不反应
用 途
纸浆漂白等,
杀菌消毒,
食物和干果的防腐剂
与漂白粉反应
Ca(ClO)2+2SO2+2H2O=CaSO4+H2SO4+2HCl
Ca(ClO)2+CO2+H2O=CaCO3 ↓ +2HClO
灭火剂、制纯碱、汽水、干冰用作制冷剂剂人工降雨
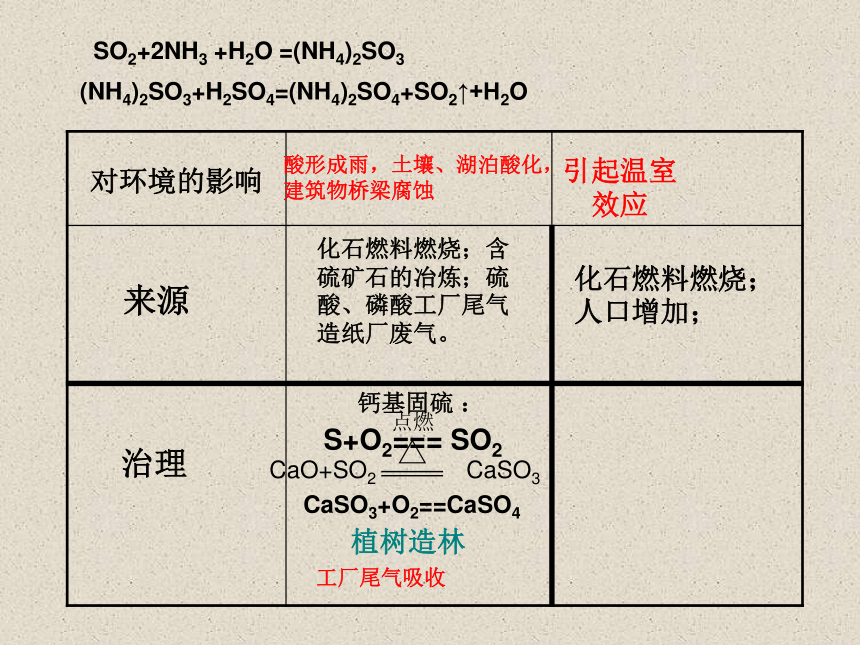
对环境的影响
酸形成雨,土壤、湖泊酸化,
建筑物桥梁腐蚀
引起温室效应
来源
化石燃料燃烧;含硫矿石的冶炼;硫酸、磷酸工厂尾气
造纸厂废气。
化石燃料燃烧;人口增加;
治理
钙基固硫 :
S+O2=== SO2
点燃
CaO+SO2 CaSO3
CaSO3+O2==CaSO4
植树造林
工厂尾气吸收
SO2+2NH3 +H2O =(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O
4.
现每隔一定时间测定某处雨水样品的pH值(见下表)
测定时间(h) 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH 4.74 4.63 4.57 4.53 4.53
1.请你写出酸雨形成的化学方程式。
2.这种雨水的pH逐渐减小,其原因何在?
雨水水样pH随时间推移而下降,原因有是其中中强酸H2SO3被氧化为强酸H2SO4的原故。
[例3】
3.酸雨可导致下列危害中的 ( )
A腐蚀建筑物 B.影响鱼类的生长。
C.导致树木枯死
4.你认为减小酸雨产生的途径可采取的下列措施是( )
A.少用煤作燃料。B.把工厂的烟囱造高。
C.燃料脱硫。 D.开发新能源
E.在已酸化的土壤中加石灰。
A.B.C
A.C.D
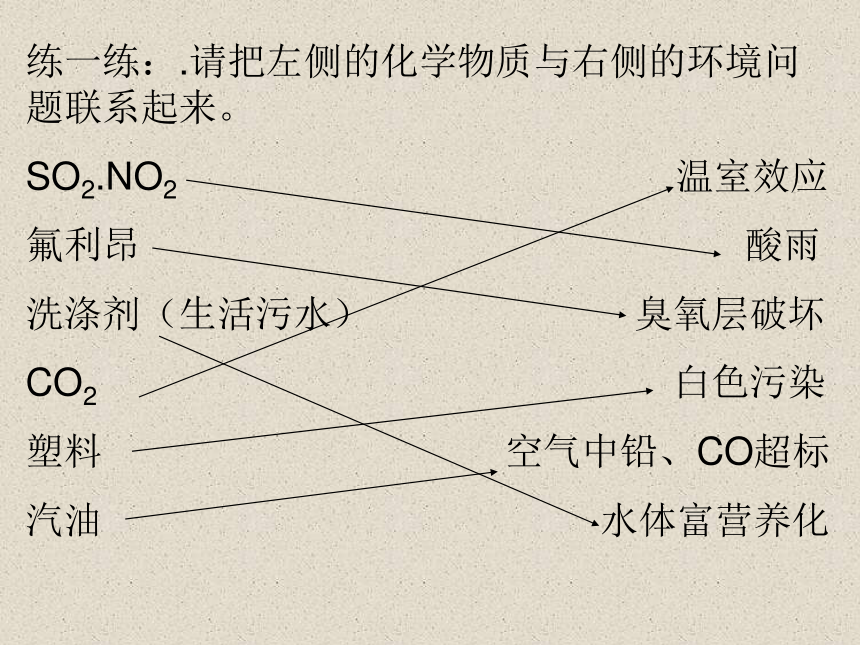
练一练:.请把左侧的化学物质与右侧的环境问题联系起来。
SO2.NO2 温室效应
氟利昂 酸雨
洗涤剂(生活污水) 臭氧层破坏
CO2 白色污染
塑料 空气中铅、CO超标
汽油 水体富营养化
B
自行设计实验
1.如何检验SO2中是否含有CO2?
2.如何除去CO2中的SO2?
?
思考
鉴别SO2和CO2的方法
二氧化硫和二氧化碳都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清的石灰水鉴别二氧化硫和二氧化碳。通常可用以下方法:
(1)用品红溶液,
使品红溶液褪色的是二氧化硫,
不能使品红溶液褪色的是二氧化碳
(2)用高锰酸钾溶液
紫色褪去的是二氧化硫,无明显现象的 是二氧化碳
2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
(3)用溴水
使橙褪去的是二氧化硫色无明显现象的是二氧化碳
Br2+2H2O+SO2=2HBr+H2SO4
(4)用硝酸酸化的硝酸钡溶液
产生白色沉淀的是二氧化硫,
无明显现象的是二氧化碳。
2H2O+2HNO3+3SO2=3H2SO4+2NO↑
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
(5)用FeCl3溶液,使棕黄色颜色变浅的是二氧化硫,
无明显现象的是二氧化碳。
2FeCl3+SO2+2H2O= FeCl2+FeSO4+4HCl
3.实验室制法
哪些反应可以得到二氧化硫?
哪些适宜于二氧化硫的制备?
装浓硫酸
1.
练习
2.下列说法不正确的是( )。
A。SO2具有刺激性气味,因而在实验的最后要用澄清石灰水除尾气
B.SO2、NH3. 、Cl2是常见的易液化的气体
C。二氧化硫密度比空气大,因而可用向下排空气法收集气体
D.二氧化硫可以与水配合做喷泉实验。
AC
木炭和浓硫酸反应产物检验装置图
①
②
③
虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件反应产生的所有气体产物,填写下列空白
(1)如果将装置中①、 ②、③三部分 仪器的顺序变为 ②、①、③则可检出的物质是————;不能检出的物质是————————。
(2)如果将仪器的连 接顺序变为①、③、②则可以检出的物质是————; 不能检出的物质是——————。
(3)如果将仪器的连接顺序变为②、③、①则可以检出的物质是————;不能检出的物质是
(1)、SO2,CO2;H2O ( 2 )H2O;SO2 、CO2 ( 3 )SO2 、CO2 ;H2O
2009年全国统一卷27)
浓硫酸和木炭在加热时发生反应的化学方程式是
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓硫酸、木炭和酸性高锰酸钾溶液
其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器接连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用
C 浓H2SO4和木炭 反应器(或发生气体)
B 无水CuSO4 检出H2O
A 品红溶液 检出SO2
A 酸性KmnO4溶液 吸收余下的SO2
A 澄清石灰水 检出CO2
液态
三.三氧化硫
(1)物理性质
熔点16.8 ℃,沸点44.8 ℃,常温下为____________,标准状况下为_______。
(2)化学性质
酸性氧化物,与H2O、CaO、Ca(OH)2、NaHSO3反应的方程式为:
H2O+SO3=____________(放出大量的热)
CaO+SO3=____________
Ca(OH)2+SO3=____________
2NaHSO3+SO3=Na2SO4+2SO2↑+H2O(除去SO2中的SO3)
固态
H2SO4
CaSO4
CaSO4+H2O
可以被浓硫酸吸收
C2H=OH CH3CHO CH3COOH
O2
O2
四、
五、硫酸
高三化学第一轮复习
(1)、硫酸的物理性质
纯硫酸是 液体,常用的浓硫酸中H2SO4的质量分数是 ,其密度为1.84g·cm3,物质的量浓度为 ,沸点是 。
硫酸是一种 挥发的强酸, 溶于水,能与水以 比例互溶,溶于水放出大量的热。
98%
18mol/L
任意
无色黏稠油状
3380C
难
易
如何稀释浓硫酸?
答:将浓H2SO4 沿器壁缓慢地注入水中,并不断搅拌,使
其散热,防止飞溅。
SO3
是无水硫酸铜变白
CuSO4· 5 H2O ===CuSO4 + 5H2O
浓硫酸
必修一的“黑面包实验”中,体现出浓硫酸
什么性质?写出相关的方程式。
答:脱水性(使蔗糖炭化)、强氧化性(有刺激性气味气体产生):
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(3)与非金属单质反应
C+2H2SO4(浓)=CO2↑ + 2SO2↑+ 2H2O
2P+5H2SO4(浓)=2H3PO4+5SO2↑ +2H2O
(4)与还原性化合物反应
2HBr+H2SO4 (浓)= Br2+SO2↑+2H2O
2FeO+4H2SO4(浓)= Fe2(SO4)3+SO2↑+4H2O
2Fe(少)+6H2SO4(浓) = Fe2 (SO4)3+ 3SO2↑+6H2O
二,浓硫酸
(1)常温使 Al, Fe 钝化
(2)加热与金属反应
SO2
Cu+2H2SO4 (浓)==CuSO4+2H2O+2SO2 ↑
1.皮肤上一旦沾有浓硫酸,先 ,
再 ,最后再涂上 溶液。
用干布擦去
用大量水冲洗
NaHCO3
(浓硫酸具有很强的腐蚀性)
2.浓硫酸使蓝色石蕊试纸先变 色,后变 色。
红
黑
练 习
⑴ ⑵ ⑶ ⑷
3.下列木炭和浓硫酸反应产物检验装置应如何连接:
练 习
品红
溶液
浓硫酸
稀硫酸
H2SO4
H2SO4= 2H++SO42-
酸的通性
稀释
自身特性
主要以分子
形式存在
完全电离
(吸水性、脱水性、强氧化性)
根据硫酸的性质列举出鉴别浓硫酸和稀硫酸的方法。
讨 论
例1
小结:
3.
强调
接 触 法 制 硫酸 小 结
3 . 三氧化硫的吸收和硫酸的生成
三阶段
1 . 二氧化硫的的制取和净化
2 . 二氧化硫氧化成三氧化硫
三方程
三设备
高温
V2O5
2SO2 +O2 2SO3
△
4FeS2 +11O2 2Fe2O3 + 8SO2
沸腾炉
接触室
吸收塔
SO3 +H2O H2SO4
工业上常用硫酸的年产量来衡量一个国家的化工生产能力
归纳:硫及其化合物间的转化关系
练 习
1.
2.
3.
4.
5.
自然界中的硫
1.不同价态硫的转化
(1)地表
地层深处硫元素
(2)地下
熔融态的硫与有关物质反应生成矿物,如黄铁矿( FeS2 ),雄黄( As4S4),雌黄( As2S3 ),辰砂( HgS )等,它们与O2、H2O等作用生成新的物质,如石膏( CaSO4·2H2O ),芒硝(Na2SO4·10H2O)等。
火山喷发
H2S
SO2、SO3
O2、H2O
阳光
H2SO3、H2SO4、
微生物
S、H2S
第三节 硫的氧化物和硫酸
2.硫的存在及物理性质
硫单质俗名硫黄,主要存在于火山口附近或地壳的岩层里。
硫单质是一种 淡黄 色的固体,
硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
熔点:113℃ 沸点:444.6℃
(1).存在形态
A.游离态:
如硫铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)和芒硝(Na2SO4·10H2O)等。
B.化合态:
主要以金属硫化物和硫酸盐的形式存在,
(2)物理性质
难溶于水,微溶于酒精,易溶于CS2。(用于洗去试管壁上的硫);
S+
(2)与非金属反应
S+
点燃
300℃
产生具有 臭鸡蛋 气味的气体硫作氧化剂。
④与 Na 加热 或研磨爆炸:2Na+S == Na2S
Cu2S
产生红热现象,生成 黑 色物质
①Cu
②Fe
FeS
产生红热现象,生成 黑 色固体
③Hg
HgS
此反应易发生,可用于除去撒落 的Hg
3.硫的化学性质
(1)与金属反应
⑤
Al
Al2S3
不能有水
①O2
SO2
产生 蓝紫 色火焰(在纯氧中)和刺激性气味的气体
②H2
H2S
③ C
CS2
(3)与某些化合物反应
①硫跟浓硫酸反应的方程式:
S+2H2SO4(浓) 3SO2↑+2H2O
②硫与浓硝酸反应的方程式为:
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
③与碱反应:
3S+6KOH 2K2S+K2SO3+3H2O
④ S+2KNO3+3C K2S ↑ + N2 ↑ + 3CO2 ↑
4.用途:大量用于制造硫酸、硫化天然橡胶,
也用于制药、黑火药 、农药 、火柴。
硫的性质小结:
1.从硫是非金属单质且熔、沸点较低,可以判断出硫是分子晶体。
2.比较硫与铁、铜反应及氯气与铁、铜反应生成物中金属元素的化合价,可判断氯原子得电子能力比硫原子强,从而推断出氯气的氧化性比硫强。
3.实验室中的仪器如果粘有硫,可以用二硫化碳进行洗涤,也可用热的氢氧化钠溶液洗涤。
4.在单质硫中,硫元素的化合价是0价,处于中间价态,所以硫既有氧化性又有还原性,如上述化学性质。
物理性质 气味
毒性
溶解性
化
学
性
质
与水的反应
与碱的
反应
二、硫的氧化物 —— SO2
SO2
CO2
无色有刺激性气味易液化(-10℃)
无色无味
有毒 、密度比空气大
无毒 密度比空气大
易溶(体积比1∶40)
可溶(体积比1∶1)
SO2+H2O??H2SO3
CO2+H2O ?H2CO3
SO2气体通入澄清石灰水中,先生成沉淀,当气体过量时
沉淀又溶解Ca(OH)2+SO2
=CaSO3↓+H2O
CaSO3+SO2+H2O=Ca(HSO3)2
CO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:Ca(OH)2+CO2
=CaCO3↓+H2O
CaCO3+CO2+H2O
=Ca(HCO3)2
SO2+2H2S=3S↓+2H2O
Mg+SO2 ==MgO+S
CO2+C==== 2CO
高温
Mg+CO2===C+MgO
点燃
能被酸性高锰酸钾、氯水、
溴水、碘水、氯化铁溶液
氧化使氧化剂褪色
CO2+CaO ====CaCO3
高温
能与品红生成不稳定的
无色物质而使其褪色
无
无
SO2+CaO=CaSO3
△
与盐溶液反应
硝酸钡
氯化钡
有白色沉淀
无现象
无现象
无现象
Na2SO3 + SO2 +H2O
==2NaHSO3
Na2CO3+SO2 ==Na2SO3
Na2CO3+CO2 + H2O =2NaHCO3
与过氧
化钠
反应
Na2O2+SO2=
Na2SO4
2 Na2O2+2CO2=2Na2CO3+O2 ↑
变红色 且不褪色
变浅红色
2SO2 + O2 2 SO3
催化剂
△
不反应
用 途
纸浆漂白等,
杀菌消毒,
食物和干果的防腐剂
与漂白粉反应
Ca(ClO)2+2SO2+2H2O=CaSO4+H2SO4+2HCl
Ca(ClO)2+CO2+H2O=CaCO3 ↓ +2HClO
灭火剂、制纯碱、汽水、干冰用作制冷剂剂人工降雨
对环境的影响
酸形成雨,土壤、湖泊酸化,
建筑物桥梁腐蚀
引起温室效应
来源
化石燃料燃烧;含硫矿石的冶炼;硫酸、磷酸工厂尾气
造纸厂废气。
化石燃料燃烧;人口增加;
治理
钙基固硫 :
S+O2=== SO2
点燃
CaO+SO2 CaSO3
CaSO3+O2==CaSO4
植树造林
工厂尾气吸收
SO2+2NH3 +H2O =(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O
4.
现每隔一定时间测定某处雨水样品的pH值(见下表)
测定时间(h) 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH 4.74 4.63 4.57 4.53 4.53
1.请你写出酸雨形成的化学方程式。
2.这种雨水的pH逐渐减小,其原因何在?
雨水水样pH随时间推移而下降,原因有是其中中强酸H2SO3被氧化为强酸H2SO4的原故。
[例3】
3.酸雨可导致下列危害中的 ( )
A腐蚀建筑物 B.影响鱼类的生长。
C.导致树木枯死
4.你认为减小酸雨产生的途径可采取的下列措施是( )
A.少用煤作燃料。B.把工厂的烟囱造高。
C.燃料脱硫。 D.开发新能源
E.在已酸化的土壤中加石灰。
A.B.C
A.C.D
练一练:.请把左侧的化学物质与右侧的环境问题联系起来。
SO2.NO2 温室效应
氟利昂 酸雨
洗涤剂(生活污水) 臭氧层破坏
CO2 白色污染
塑料 空气中铅、CO超标
汽油 水体富营养化
B
自行设计实验
1.如何检验SO2中是否含有CO2?
2.如何除去CO2中的SO2?
?
思考
鉴别SO2和CO2的方法
二氧化硫和二氧化碳都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清的石灰水鉴别二氧化硫和二氧化碳。通常可用以下方法:
(1)用品红溶液,
使品红溶液褪色的是二氧化硫,
不能使品红溶液褪色的是二氧化碳
(2)用高锰酸钾溶液
紫色褪去的是二氧化硫,无明显现象的 是二氧化碳
2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
(3)用溴水
使橙褪去的是二氧化硫色无明显现象的是二氧化碳
Br2+2H2O+SO2=2HBr+H2SO4
(4)用硝酸酸化的硝酸钡溶液
产生白色沉淀的是二氧化硫,
无明显现象的是二氧化碳。
2H2O+2HNO3+3SO2=3H2SO4+2NO↑
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
(5)用FeCl3溶液,使棕黄色颜色变浅的是二氧化硫,
无明显现象的是二氧化碳。
2FeCl3+SO2+2H2O= FeCl2+FeSO4+4HCl
3.实验室制法
哪些反应可以得到二氧化硫?
哪些适宜于二氧化硫的制备?
装浓硫酸
1.
练习
2.下列说法不正确的是( )。
A。SO2具有刺激性气味,因而在实验的最后要用澄清石灰水除尾气
B.SO2、NH3. 、Cl2是常见的易液化的气体
C。二氧化硫密度比空气大,因而可用向下排空气法收集气体
D.二氧化硫可以与水配合做喷泉实验。
AC
木炭和浓硫酸反应产物检验装置图
①
②
③
虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件反应产生的所有气体产物,填写下列空白
(1)如果将装置中①、 ②、③三部分 仪器的顺序变为 ②、①、③则可检出的物质是————;不能检出的物质是————————。
(2)如果将仪器的连 接顺序变为①、③、②则可以检出的物质是————; 不能检出的物质是——————。
(3)如果将仪器的连接顺序变为②、③、①则可以检出的物质是————;不能检出的物质是
(1)、SO2,CO2;H2O ( 2 )H2O;SO2 、CO2 ( 3 )SO2 、CO2 ;H2O
2009年全国统一卷27)
浓硫酸和木炭在加热时发生反应的化学方程式是
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓硫酸、木炭和酸性高锰酸钾溶液
其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器接连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用
C 浓H2SO4和木炭 反应器(或发生气体)
B 无水CuSO4 检出H2O
A 品红溶液 检出SO2
A 酸性KmnO4溶液 吸收余下的SO2
A 澄清石灰水 检出CO2
液态
三.三氧化硫
(1)物理性质
熔点16.8 ℃,沸点44.8 ℃,常温下为____________,标准状况下为_______。
(2)化学性质
酸性氧化物,与H2O、CaO、Ca(OH)2、NaHSO3反应的方程式为:
H2O+SO3=____________(放出大量的热)
CaO+SO3=____________
Ca(OH)2+SO3=____________
2NaHSO3+SO3=Na2SO4+2SO2↑+H2O(除去SO2中的SO3)
固态
H2SO4
CaSO4
CaSO4+H2O
可以被浓硫酸吸收
C2H=OH CH3CHO CH3COOH
O2
O2
四、
五、硫酸
高三化学第一轮复习
(1)、硫酸的物理性质
纯硫酸是 液体,常用的浓硫酸中H2SO4的质量分数是 ,其密度为1.84g·cm3,物质的量浓度为 ,沸点是 。
硫酸是一种 挥发的强酸, 溶于水,能与水以 比例互溶,溶于水放出大量的热。
98%
18mol/L
任意
无色黏稠油状
3380C
难
易
如何稀释浓硫酸?
答:将浓H2SO4 沿器壁缓慢地注入水中,并不断搅拌,使
其散热,防止飞溅。
SO3
是无水硫酸铜变白
CuSO4· 5 H2O ===CuSO4 + 5H2O
浓硫酸
必修一的“黑面包实验”中,体现出浓硫酸
什么性质?写出相关的方程式。
答:脱水性(使蔗糖炭化)、强氧化性(有刺激性气味气体产生):
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(3)与非金属单质反应
C+2H2SO4(浓)=CO2↑ + 2SO2↑+ 2H2O
2P+5H2SO4(浓)=2H3PO4+5SO2↑ +2H2O
(4)与还原性化合物反应
2HBr+H2SO4 (浓)= Br2+SO2↑+2H2O
2FeO+4H2SO4(浓)= Fe2(SO4)3+SO2↑+4H2O
2Fe(少)+6H2SO4(浓) = Fe2 (SO4)3+ 3SO2↑+6H2O
二,浓硫酸
(1)常温使 Al, Fe 钝化
(2)加热与金属反应
SO2
Cu+2H2SO4 (浓)==CuSO4+2H2O+2SO2 ↑
1.皮肤上一旦沾有浓硫酸,先 ,
再 ,最后再涂上 溶液。
用干布擦去
用大量水冲洗
NaHCO3
(浓硫酸具有很强的腐蚀性)
2.浓硫酸使蓝色石蕊试纸先变 色,后变 色。
红
黑
练 习
⑴ ⑵ ⑶ ⑷
3.下列木炭和浓硫酸反应产物检验装置应如何连接:
练 习
品红
溶液
浓硫酸
稀硫酸
H2SO4
H2SO4= 2H++SO42-
酸的通性
稀释
自身特性
主要以分子
形式存在
完全电离
(吸水性、脱水性、强氧化性)
根据硫酸的性质列举出鉴别浓硫酸和稀硫酸的方法。
讨 论
例1
小结:
3.
强调
接 触 法 制 硫酸 小 结
3 . 三氧化硫的吸收和硫酸的生成
三阶段
1 . 二氧化硫的的制取和净化
2 . 二氧化硫氧化成三氧化硫
三方程
三设备
高温
V2O5
2SO2 +O2 2SO3
△
4FeS2 +11O2 2Fe2O3 + 8SO2
沸腾炉
接触室
吸收塔
SO3 +H2O H2SO4
工业上常用硫酸的年产量来衡量一个国家的化工生产能力
归纳:硫及其化合物间的转化关系
练 习
1.
2.
3.
4.
5.
