氧化还原反应教学课件
图片预览







文档简介
(共27张PPT)
氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟以后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
一、氧化还原反应
概念:
特征: ( 判断依据)
本质:
凡有电子转移(得失或偏移)的化学反应
电子转移
化合价发生了变化
小试牛刀
判断下列哪些是氧化还原反应,四种基本反应类型与氧化还原反应的关系:
1. CaO + H2O == Ca (OH)2
2. C + O2 === CO2
3. CaCO3 === CaO + CO2
4. 2KMnO4 === K2MnO4 + MnO2 + O2
5. Zn + 2HCl === ZnCl2 + H2
6. CuO + 2HCl == CuCl2 + H2O
氧化还原反应:2、4、5
四大基本反应类型:
化合化应:
A+B=AB
分解反应:
置换反应:
复分解反应:
AB=A+B
A+BC=AC+B
AB+CD=AD+CB
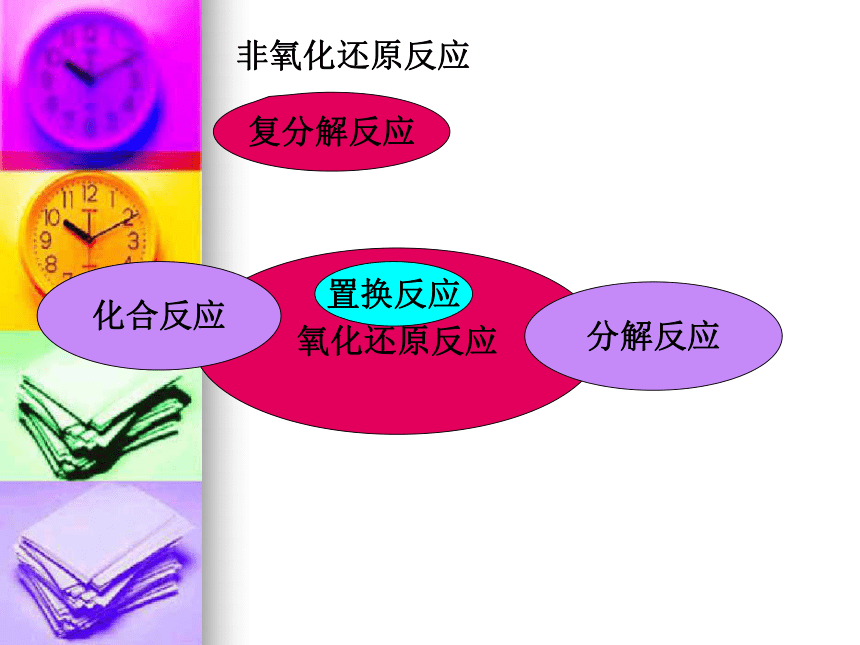
氧化还原反应
置换反应
复分解反应
非氧化还原反应
化合反应
分解反应
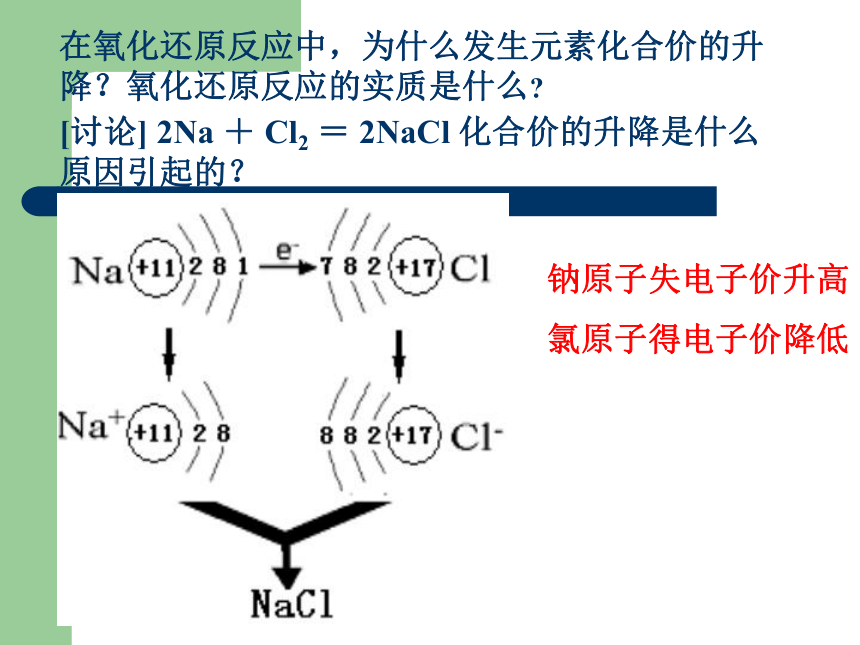
在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么
[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?
钠原子失电子价升高
氯原子得电子价降低
Cl
●●
●
●
●●
●
+
我想要一个电子。
Na
老兄,干嘛愁眉苦脸的?
●
●●
●
●
●●
Cl
●
●
Na
+
你给我一个电子,好吗?
让我想想
那好吧
●
●●
●
●
●●
●
谢谢你!
Cl
﹣
没关系,互相帮助嘛。
Na
﹢
●
●
Na
Cl
●●
●
●
●●
●
●●
●
●
●●
●
●
Cl-
Na+
还原反应
氧化反应
氧化剂
还原剂
得到电子,被还原
失去电子,被氧化
n个e-
化合价升降的原因:
电子的转移,包括得失或偏移,
综上所述,可以给氧化还原反应下一个更为本质的定义:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。
二、氧化剂和还原剂的相关概念
氧化剂:
得到电子的物质
生成还原产物
化合价降低
发生还原反应
失去电子的物质
还原剂:
生成氧化产物
发生氧化反应
化合价升高
得电子,化合价降低,还原反应
失电子,化合价升高,氧化反应
还原剂 + 氧化剂 = 氧化产物 + 还原产物
氧化还原在反应中相伴而生,即得失电子必然同时进行,且得失电子总数必然相等。
记忆方法
2、判断下列反应哪些是氧化剂、还原剂、氧化产物、还原产物
4、 2FeCl2 + Cl2 = 2FeCl3
3、4HCl+MnO2=MnCl2+Cl2↑+2H2O
△
1、Zn+CuSO4=Cu+ZnSO4
△
2、3CO+Fe2O3=2Fe+3CO2
三、双线桥法表示电子转移情况的步骤及特点2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等:
1 、标化合价,找变价
2、画线桥:箭头从反应物指向生成物,起止为同一元素,箭头不代表电子转移方向
3、写数目:电子转移的数目用a×b e-的形式(a表示共有多少个原子得失电子,b表示每个原子得失电子数)
4、检查:电子有得必有失,电子得失总数应相等(得电子总数=失电子总数,化合价升高总数=化合价降低总数)
氧化还原反应中电子转移
的表示方法
双线桥
0
0
+1
-1
失去 2×e-
得到 2×e-
还原剂
氧化剂
2Na + Cl2 === 2NaCl
点燃
氧化还原反应中电子转移
的表示方法
单线桥
0
0
+1
-1
2×e-
还原剂
氧化剂
2Na + Cl2 === 2NaCl
点燃
0
0
+1
-1
失去 2×e-
得到 2×e-
0
0
+1
-1
2×e-
双线桥与单线桥的比较
2Na + Cl2 === 2NaCl
点燃
2Na + Cl2 === 2NaCl
点燃
写出工业制Cl2,实验室制Cl2及工业制漂白粉的化学反应方程式,用双线桥表示电子转移,并注明还原剂,氧化剂,还原产物和氧化产物
你会多少?
用双线桥表示电子转移
4、 2FeCl2 + Cl2 = 2FeCl3
3、4HCl+MnO2=MnCl2+Cl2↑+2H2O
△
1、Zn+CuSO4=Cu+ZnSO4
△
2、3CO+Fe2O3=2Fe+3CO2
四、物质氧化性和还原性的强弱比较
问题组2
①从氧化性、还原性角度分析,金属的活动性顺序也是什么性质的递变顺序?
②金属失电子后生成的阳离子具有什么性质?在活动性顺序表中该性质如何递变?
③写出Zn与CuSO4反应的化学方程式,据Zn、Cu的还原性强弱,以及Zn2+、Cu2+氧化性强弱,总结同一反应中还原剂与还原产物的还原性强弱、氧化剂与氧化产物的氧化性强弱。
还原性
氧化性
K> Ca > Na > Mg > Al > Zn > Fe > … > Cu > …
K+< Ca2+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ < … < Cu 2+ < …
还原性:还原剂强于还原产物
氧化性:氧化剂强于氧化产物
据下列反应比较物质的氧化性(Cl2、 Br2、 I2)、还原性(Cl-、Br-、I-):
①Cl2+2NaI = 2NaCl+I2
②Cl2+2NaBr = 2NaCl+Br2
③Br2+2NaI = 2NaBr+I2
氧化性:
还原性:
Cl2>Br2 > I2
Cl-<Br- < I-
【学以致用】
【拓展延伸】
分析以下两组反应:
①找出每组中的氧化剂、还原剂,并比较其强弱。
②想一想,你还可以从哪些角度比较物质的氧化性强弱。
(1)氯气的两种制取方法
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
2KMnO4+ 16HCl(浓)=2MnCl2+ 5Cl2↑+2KCl+8H2O
(2)2Fe+3Cl2 2FeCl3 Fe+S FeS
氧化剂
氧化剂
还原剂
还原剂
氧化剂
氧化剂
还原剂
还原剂
板书设计 (即小结)如下:
一、氧化还原反应:1、定义: 2、特征:
二、氧化剂和还原剂
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化
三、双线桥法表示电子转移情况的步骤及特点
1 、标化合价,找变价
2、画线桥:
3、写数目:
4、检查:
四、物质氧化性和还原性的强弱比较
氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟以后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
一、氧化还原反应
概念:
特征: ( 判断依据)
本质:
凡有电子转移(得失或偏移)的化学反应
电子转移
化合价发生了变化
小试牛刀
判断下列哪些是氧化还原反应,四种基本反应类型与氧化还原反应的关系:
1. CaO + H2O == Ca (OH)2
2. C + O2 === CO2
3. CaCO3 === CaO + CO2
4. 2KMnO4 === K2MnO4 + MnO2 + O2
5. Zn + 2HCl === ZnCl2 + H2
6. CuO + 2HCl == CuCl2 + H2O
氧化还原反应:2、4、5
四大基本反应类型:
化合化应:
A+B=AB
分解反应:
置换反应:
复分解反应:
AB=A+B
A+BC=AC+B
AB+CD=AD+CB
氧化还原反应
置换反应
复分解反应
非氧化还原反应
化合反应
分解反应
在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么
[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?
钠原子失电子价升高
氯原子得电子价降低
Cl
●●
●
●
●●
●
+
我想要一个电子。
Na
老兄,干嘛愁眉苦脸的?
●
●●
●
●
●●
Cl
●
●
Na
+
你给我一个电子,好吗?
让我想想
那好吧
●
●●
●
●
●●
●
谢谢你!
Cl
﹣
没关系,互相帮助嘛。
Na
﹢
●
●
Na
Cl
●●
●
●
●●
●
●●
●
●
●●
●
●
Cl-
Na+
还原反应
氧化反应
氧化剂
还原剂
得到电子,被还原
失去电子,被氧化
n个e-
化合价升降的原因:
电子的转移,包括得失或偏移,
综上所述,可以给氧化还原反应下一个更为本质的定义:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。
二、氧化剂和还原剂的相关概念
氧化剂:
得到电子的物质
生成还原产物
化合价降低
发生还原反应
失去电子的物质
还原剂:
生成氧化产物
发生氧化反应
化合价升高
得电子,化合价降低,还原反应
失电子,化合价升高,氧化反应
还原剂 + 氧化剂 = 氧化产物 + 还原产物
氧化还原在反应中相伴而生,即得失电子必然同时进行,且得失电子总数必然相等。
记忆方法
2、判断下列反应哪些是氧化剂、还原剂、氧化产物、还原产物
4、 2FeCl2 + Cl2 = 2FeCl3
3、4HCl+MnO2=MnCl2+Cl2↑+2H2O
△
1、Zn+CuSO4=Cu+ZnSO4
△
2、3CO+Fe2O3=2Fe+3CO2
三、双线桥法表示电子转移情况的步骤及特点2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等:
1 、标化合价,找变价
2、画线桥:箭头从反应物指向生成物,起止为同一元素,箭头不代表电子转移方向
3、写数目:电子转移的数目用a×b e-的形式(a表示共有多少个原子得失电子,b表示每个原子得失电子数)
4、检查:电子有得必有失,电子得失总数应相等(得电子总数=失电子总数,化合价升高总数=化合价降低总数)
氧化还原反应中电子转移
的表示方法
双线桥
0
0
+1
-1
失去 2×e-
得到 2×e-
还原剂
氧化剂
2Na + Cl2 === 2NaCl
点燃
氧化还原反应中电子转移
的表示方法
单线桥
0
0
+1
-1
2×e-
还原剂
氧化剂
2Na + Cl2 === 2NaCl
点燃
0
0
+1
-1
失去 2×e-
得到 2×e-
0
0
+1
-1
2×e-
双线桥与单线桥的比较
2Na + Cl2 === 2NaCl
点燃
2Na + Cl2 === 2NaCl
点燃
写出工业制Cl2,实验室制Cl2及工业制漂白粉的化学反应方程式,用双线桥表示电子转移,并注明还原剂,氧化剂,还原产物和氧化产物
你会多少?
用双线桥表示电子转移
4、 2FeCl2 + Cl2 = 2FeCl3
3、4HCl+MnO2=MnCl2+Cl2↑+2H2O
△
1、Zn+CuSO4=Cu+ZnSO4
△
2、3CO+Fe2O3=2Fe+3CO2
四、物质氧化性和还原性的强弱比较
问题组2
①从氧化性、还原性角度分析,金属的活动性顺序也是什么性质的递变顺序?
②金属失电子后生成的阳离子具有什么性质?在活动性顺序表中该性质如何递变?
③写出Zn与CuSO4反应的化学方程式,据Zn、Cu的还原性强弱,以及Zn2+、Cu2+氧化性强弱,总结同一反应中还原剂与还原产物的还原性强弱、氧化剂与氧化产物的氧化性强弱。
还原性
氧化性
K> Ca > Na > Mg > Al > Zn > Fe > … > Cu > …
K+< Ca2+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ < … < Cu 2+ < …
还原性:还原剂强于还原产物
氧化性:氧化剂强于氧化产物
据下列反应比较物质的氧化性(Cl2、 Br2、 I2)、还原性(Cl-、Br-、I-):
①Cl2+2NaI = 2NaCl+I2
②Cl2+2NaBr = 2NaCl+Br2
③Br2+2NaI = 2NaBr+I2
氧化性:
还原性:
Cl2>Br2 > I2
Cl-<Br- < I-
【学以致用】
【拓展延伸】
分析以下两组反应:
①找出每组中的氧化剂、还原剂,并比较其强弱。
②想一想,你还可以从哪些角度比较物质的氧化性强弱。
(1)氯气的两种制取方法
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
2KMnO4+ 16HCl(浓)=2MnCl2+ 5Cl2↑+2KCl+8H2O
(2)2Fe+3Cl2 2FeCl3 Fe+S FeS
氧化剂
氧化剂
还原剂
还原剂
氧化剂
氧化剂
还原剂
还原剂
板书设计 (即小结)如下:
一、氧化还原反应:1、定义: 2、特征:
二、氧化剂和还原剂
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化
三、双线桥法表示电子转移情况的步骤及特点
1 、标化合价,找变价
2、画线桥:
3、写数目:
4、检查:
四、物质氧化性和还原性的强弱比较
