湖北省“荆、荆、襄、宜“四地七校联盟2020-2021学年高二上学期期中考试化学试题 含答案
文档属性
| 名称 | 湖北省“荆、荆、襄、宜“四地七校联盟2020-2021学年高二上学期期中考试化学试题 含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 602.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-26 20:27:01 | ||
图片预览

文档简介
2020年秋“荆、荆、襄、宜四地七校考试联盟”
高二期中联考
化 学 试 题
考试时间:11月25日下午14:30~16:00 试卷页数:8页 全卷满分:100分 考试用时:90分钟
★祝考试顺利★
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Cl-35.5
一、选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.在西汉刘安组织编撰的《淮南万毕术》中,有“曾青得铁则化为铜”的记载。这说明早在西汉时期,我国劳动人民就已经发现铁能从某些含铜(+2价)化合物的溶液中置换出铜,这个反应是现代湿法冶金的基础。下列关于该反应的说法中,正确的是
A.该反应说明历史上铁的应用比铜早
B.该反应的离子方程式为:Fe+Cu2+= Cu+Fe2+
C.该反应说明金属单质与盐溶液的反应均为置换反应
D.该反应说明金属单质都能与盐发生反应
2.下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.食物因氧化而腐败时,化学能转化热能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
3.下列实验装置正确且能达到实验目的的是
A.用甲装置除去食盐水中混有的不溶杂质 B.用乙装置提纯Al(OH)3胶体
C.用丙装置制备无水酒精 D.用装置丁制取乙酸乙酯
4.短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质组成的混合物中通入黄绿色气体单质Z,得到化合物甲和化学式为WX的气体乙,气体乙会与血红蛋白结合导致人体中毒;②金属Y形成的淡黄色氧化物可用于呼吸面具。在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛。下列说法不正确的是
A.W的氢化物的沸点一定小于X的氢化物
B.简单离子半径:Z>X>Y
C.W与Z形成的化合物可用做工业上的重要有机溶剂
D.含Z元素的某种盐具有强氧化性,可用于饮用水消毒
5.食用自制“酸汤子”(用玉米水磨发酵后做的一种粗面条样的主食)会因椰毒假单胞菌污染产生米酵菌酸引发食物中毒。米酵菌酸的结构如图,下列说法错误的是
A.能与Br2发生加成反应
B.含有3种官能团
C.能与碳酸氢钠溶液反应
D.不能使稀酸性高锰酸钾溶液褪色
6.在已经处于化学平衡的体系中,如果下列量发生变化,化学平衡一定发生了移动的是
A.反应混合物的浓度 B.反应体系的压强 C.正、逆反应的速率 D.反应体系的温度
7. 2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g)+Cl2(g)PCl5(g),达平衡时PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再次达平衡时PCl5的物质的量是
A.0.40 mol???? B.0.20 mol C.小于0.20 mol??? ?D.大于0.20 mol,小于0.40 mol
8. 在密闭容器中,一定量的混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得物质A的浓度为
0.50 mol·L-1,保持温度不变,将容器的容积扩大到原来的3倍,再次达平衡时,测得A的浓度降低为
0.20 mol·L-1。下列有关判断正确的是
A.x+y C.B的转化率降低 D.C的体积分数增大
9.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.加热 B.改用98%的浓硫酸 C.滴加少量CuSO4溶液 D.用铁粉代替铁片
10.可逆反应2NO2 (g) N2O4 (g) ΔH= ?56.9 kJ·mol?1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。某同学的部分实验报告如下。
1.向左侧烧杯中加入NH4NO3晶体,甲瓶的红棕色变浅。
2.向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。
下列说法不正确的是
A.甲瓶的红棕色变浅,说明平衡2NO2 (g)N2O4 (g)向正反应方向移动
B.可根据现象判断NH4NO3晶体溶于水吸热,CaO固体溶于水放热
C.甲瓶中反应的化学平衡常数(K)增大
D.乙瓶中由于反应的化学平衡常数(K)改变,使Qc<K,平衡发生移动
二、选择题:本题共5个小题,每小题4分,共20分。每小题有一个或者两个选项符合题目要求,全部选对得4分,选对但不全得2分,有选错的得0分。
11.下列措施或事实不能用勒夏特列原理解释的是
A.使用催化剂可加快氨的合成速率
B.H2、I2、HI平衡混合气加压后颜色变深
C.新制的氯水在光照下颜色变浅
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
12.二甲醚(CH3OCH3)是制冷剂、局部麻醉药和燃料。工业上可利用CO2催化加氢合成二甲醚,其过程中主要发生下列反应。 反应I:CO2(g)+H2(g)CO(g)+H2O(g) ?H1>0
反应II:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ?H2<0
一定条件下,于密闭容器中投入一定量CO2和H2发生上述反应。下列说法正确的是
A.其他条件不变,升高温度CO2的平衡转化率一定降低
B.其他条件不变,给体系加压反应I平衡不移动
C.其他条件不变,增大H2投入量一定能提高CH3OCH3平衡产率
D.其他条件不变,使用不同催化剂对CH3OCH3的平衡产率不产生影响
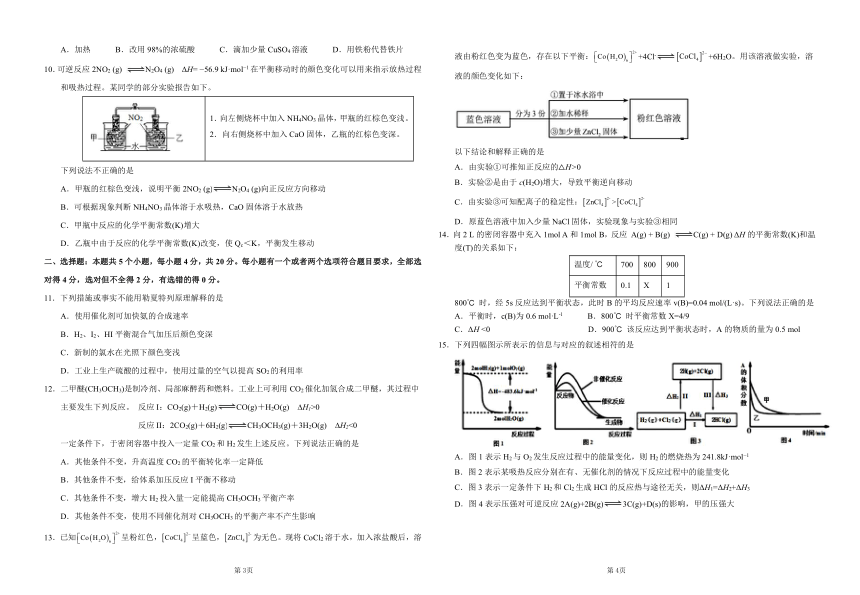
13.已知呈粉红色,呈蓝色,为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:+4Cl-+6H2O。用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A.由实验①可推知正反应的△H>0
B.实验②是由于c(H2O)增大,导致平衡逆向移动
C.由实验③可知配离子的稳定性:
D.原蓝色溶液中加入少量NaCl固体,实验现象与实验③相同
14.向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g) C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃ 700 800 900
平衡常数 0.1 X 1
800℃ 时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法正确的是
A.平衡时,c(B)为0.6 mol·L-1 B.800℃ 时平衡常数X=4/9
C.ΔH <0 D.900℃ 该反应达到平衡状态时,A的物质的量为0.5 mol
15.下列四幅图示所表示的信息与对应的叙述相符的是
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol?1
B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则ΔH1=ΔH2+ΔH3
D.图4表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,甲的压强大
三、非选择题:本题共5小题,共60分。
16.(12分)化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题:
(1)理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)HNC(g) ?H=_________kJ·mol-1。 HCN与HNC稳定性较强的是______。正反应的活化能 (填“大于”、“小于”或“等于”)逆反应的活化能。
(2)已知:
化学键种类 C—H N—H
键能(kJ/mol) a b
计算可得:HCN(g)HNC(g) ?H=_________kJ·mol-1(用含a、b的式子表示)。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧热的热化学方程式为________________________________。
(4)右图所示装置可以说明有化学能转化为电能的实验现象为_______________________________________、正极的电极反应式为_________________________。
实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验。
①实验装置中尚缺少的一种玻璃用品是_________________________。
②若测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
17.(12分)纯过氧化氢(H2O2)是_?·?è??è??_的黏稠液体,可任意比例与水_?··???_,广泛应用于医疗消毒、绿色化学合成等领域。回答下列问题:
(1)已知: H2(g)+O2(g)=H2O(l) ?H1=-286 kJ·mol-1
H2(g)+O2(g)=H2O2(l) ?H2=-188 kJ·mol?1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的?H=______kJ·mol-1。
(2)100℃ 时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 加入量(mg·L?1) 分解率% 离子 加入量(mg·L?1) 分解率%
无 0 2 Fe3+ 1.0 15
Al3+ 10 2 Cu2+ 0.1 86
Zn2+ 10 10 Cr3+ 0.1 96
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+O2(g) K= 2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的 (填编号)。
A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_______。
(4)过氧化氢的制备方法很多,早期制备方法如下:
①Ⅰ为分解反应,产物除 BaO、O2 外,还有一种红棕色气体。该反应的化学方程式是 。
② Ⅱ为可逆反应,促进该反应正向进行的措施是 (答一条即可)。
18.(14分) CO和H2是合成气,这两种气体都可以通过CH4通过一定的反应制得。
(1) CH4和CO2反应可以制得CO气体,CH4(g)+3CO2(g)2H2O(g)+4CO(g) ΔH=+330kJ·mol-1。
下图1表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]
① a1= ; ② 判断T1的T2的大小关系,T1 T2。(填“>”、“<”或“=”)
(2)CH4和H2O(g)催化重整可以制取H2和CO2,化学反应为:CH4+2H2O(g)4H2+CO2。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以明显提高H2的体积分数。对比实验的结果如图2所示。
投CaO时H2的体积分数增大的原因是 。
微米CaO和纳米CaO对H2体积分数的影响不同的原因是 。
(3)生成的CO和H2可用于合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g) ΔH= -90.1kJ·mol-1,根据反应回答问题。
①初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。反应初始时两容器的反应速率
A B(填“>”、“<”或“=”,下同);平衡时CO的转化率A B。
②温度T时,在容积为2L的某密闭容器中进行上述反应,反应开始至平衡的相关数据如图3所示。
下列能表明该反应已达到平衡状态的是 。
A.v(H2)=2v(CH3OH) B.c(CO)/c(CH3OH)=7: 3时
C.容器中气体的压强不再变化 D.c(H2)/c(CH3OH)=2: 1时
③该化学反应10min内H2的反应速率v(H2)= 。该温度下,反应的平衡常数为 (保留1位小数)。
19.(10分)研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。碘钟反应是一种化学_???è????????_,其体现了_????????¨??????_的原理。某小组同学在室温下对某“碘钟实验”的原理进行探究。
资料:该“碘钟实验”反应分A、B两步进行:
反应A:S2O+2I-=2SO+I2(慢) 反应B:I2+2S2O=2I-+S4O(快)
(1)该“碘钟实验”的总反应是 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。
试剂X是______、试剂Y是 。
(3)已知A反应的速率方程为:v=kcm(S2O)·cn(I-),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01 mol/L)
实验 序号 试剂体积 V/ mL 显色时间
t/s
K2S2O8溶液 KI溶液 水 Na2S2O3溶液 淀粉溶液
① 10 10 0 4 1 27.0
② 5 10 5 4 1 54.0
③ 2.5 10 V1 4 1 108.0
④ 10 5 5 4 1 54.0
①表中V1=________mL,理由是_________________________________________;
②通过数据计算得知:m= n=_________。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验III。(溶液浓度均为0.01 mol/L)
试剂体积 V/ mL
K2S2O8溶液 KI溶液 水 Na2S2O3溶液 淀粉溶液
10 5 3 6 1
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验III未产生颜色变化的原因: 。
20.(12分)三氯化碘(ICl3)是一种黄色晶体,遇水易分解,熔点:33 ℃,沸点:73 ℃,在药物合成中用途非常广泛。某学习小组从海带中提取碘,并用于制备三氯化碘。
(1)从干海带中提取粗碘
①写出加入过氧化氢后的反应方程式 。
②操作Y用到的玻璃仪器有烧杯、 ,操作Z的名称为 。
(2)利用制得的碘单质制取 ICl3
①仪器a的名称是 。
②制备氯气选用的药品为高锰酸钾和浓盐酸,相关反应的离子方程式为 。
③装置B能监测实验进行时装置C中是否发生堵塞,此外还有什么作用 。
④试剂X为 ,X的作用是 。
⑤氯气与单质碘反应温度稍低于70℃,则装置D适宜的加热方式为 。
2020年秋高二期中七校联考化学答案
1-10 B A B A D D C C B D
11.AB 12.D 13.AC 14.BD 15.C
16.(12分)
(1) +59.3 (1分) HCN (1分) 大于 (1分)
(2) (a-b) (2分)
(3) CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH = -890 KJ/mol (2分)
(4)电流表指针发生偏转(1分,多答“铜片上有气泡产生、锌片上有气泡产生”不扣分)
2H++2e-=H2↑(1分)
(5)环形玻璃搅拌棒(1分) ABD (2分) (有错无分、掉一个扣1分、只选一个不给分)
17.(12分)
(1)-196 (2分)
(2)①Cr3+ (1分) B (1分) ②CD(2分)(有错无分、掉一个扣1分)
(3)氧气或者O2(2分)
(4)① (2分)
②增大压强或增大氧气的浓度(2分)(答一条即可)
18.(14分)
(1)①1:3 (2分) ② <(2分)
(2)CaO可以吸收CO2,使CO2浓度减小,生成H2 的反应正向移动,H2百分含量增大(2分)
纳米CaO表面积比微米CaO大,吸收CO2能力比微米CaO强(合理即可1分)
(3) ① = (1分) >(1分) ② BC(2分) ③ 0.06mol·L-1·min-1(1分) 2.7(2分)
(10分)
(1)S2O+2S2O=2SO+S4O(2分)
(2)淀粉碘化钾 (1分) Na2S2O3(1分)
(3)7.5 (1分) 保持溶液总体积不变 (1分) 1(1分) 1 (1分)
(4)由于n(K2S2O8)∶n(Na2S2O3)<1:2,v(A)< v(B),所以未出现溶液变蓝的现象。 (2分,答出一个要点给1分)
20.(12分)
(1)①2H+ + 2I- +H2O2 == 2H2O +I2 (2分) ②分液漏斗(1分) 蒸馏(1分)
① 蒸馏烧瓶(1分)
②2MnO4-+16H++10Cl- == 5Cl2↑+ 2Mn2+ + 8H2O(2分)
③吸收氯气中的氯化氢气体(1分)
④碱石灰(1分)吸收未反应的氯气,并防止空气中的水蒸气进入D装置使三氯化碘分解(2分,答出一个要点给1分)
⑤水浴加热(1分)
第1*2-1 11页 第1*212页
高二期中联考
化 学 试 题
考试时间:11月25日下午14:30~16:00 试卷页数:8页 全卷满分:100分 考试用时:90分钟
★祝考试顺利★
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Cl-35.5
一、选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.在西汉刘安组织编撰的《淮南万毕术》中,有“曾青得铁则化为铜”的记载。这说明早在西汉时期,我国劳动人民就已经发现铁能从某些含铜(+2价)化合物的溶液中置换出铜,这个反应是现代湿法冶金的基础。下列关于该反应的说法中,正确的是
A.该反应说明历史上铁的应用比铜早
B.该反应的离子方程式为:Fe+Cu2+= Cu+Fe2+
C.该反应说明金属单质与盐溶液的反应均为置换反应
D.该反应说明金属单质都能与盐发生反应
2.下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.食物因氧化而腐败时,化学能转化热能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
3.下列实验装置正确且能达到实验目的的是
A.用甲装置除去食盐水中混有的不溶杂质 B.用乙装置提纯Al(OH)3胶体
C.用丙装置制备无水酒精 D.用装置丁制取乙酸乙酯
4.短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质组成的混合物中通入黄绿色气体单质Z,得到化合物甲和化学式为WX的气体乙,气体乙会与血红蛋白结合导致人体中毒;②金属Y形成的淡黄色氧化物可用于呼吸面具。在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛。下列说法不正确的是
A.W的氢化物的沸点一定小于X的氢化物
B.简单离子半径:Z>X>Y
C.W与Z形成的化合物可用做工业上的重要有机溶剂
D.含Z元素的某种盐具有强氧化性,可用于饮用水消毒
5.食用自制“酸汤子”(用玉米水磨发酵后做的一种粗面条样的主食)会因椰毒假单胞菌污染产生米酵菌酸引发食物中毒。米酵菌酸的结构如图,下列说法错误的是
A.能与Br2发生加成反应
B.含有3种官能团
C.能与碳酸氢钠溶液反应
D.不能使稀酸性高锰酸钾溶液褪色
6.在已经处于化学平衡的体系中,如果下列量发生变化,化学平衡一定发生了移动的是
A.反应混合物的浓度 B.反应体系的压强 C.正、逆反应的速率 D.反应体系的温度
7. 2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g)+Cl2(g)PCl5(g),达平衡时PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再次达平衡时PCl5的物质的量是
A.0.40 mol???? B.0.20 mol C.小于0.20 mol??? ?D.大于0.20 mol,小于0.40 mol
8. 在密闭容器中,一定量的混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得物质A的浓度为
0.50 mol·L-1,保持温度不变,将容器的容积扩大到原来的3倍,再次达平衡时,测得A的浓度降低为
0.20 mol·L-1。下列有关判断正确的是
A.x+y
9.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.加热 B.改用98%的浓硫酸 C.滴加少量CuSO4溶液 D.用铁粉代替铁片
10.可逆反应2NO2 (g) N2O4 (g) ΔH= ?56.9 kJ·mol?1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。某同学的部分实验报告如下。
1.向左侧烧杯中加入NH4NO3晶体,甲瓶的红棕色变浅。
2.向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。
下列说法不正确的是
A.甲瓶的红棕色变浅,说明平衡2NO2 (g)N2O4 (g)向正反应方向移动
B.可根据现象判断NH4NO3晶体溶于水吸热,CaO固体溶于水放热
C.甲瓶中反应的化学平衡常数(K)增大
D.乙瓶中由于反应的化学平衡常数(K)改变,使Qc<K,平衡发生移动
二、选择题:本题共5个小题,每小题4分,共20分。每小题有一个或者两个选项符合题目要求,全部选对得4分,选对但不全得2分,有选错的得0分。
11.下列措施或事实不能用勒夏特列原理解释的是
A.使用催化剂可加快氨的合成速率
B.H2、I2、HI平衡混合气加压后颜色变深
C.新制的氯水在光照下颜色变浅
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
12.二甲醚(CH3OCH3)是制冷剂、局部麻醉药和燃料。工业上可利用CO2催化加氢合成二甲醚,其过程中主要发生下列反应。 反应I:CO2(g)+H2(g)CO(g)+H2O(g) ?H1>0
反应II:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ?H2<0
一定条件下,于密闭容器中投入一定量CO2和H2发生上述反应。下列说法正确的是
A.其他条件不变,升高温度CO2的平衡转化率一定降低
B.其他条件不变,给体系加压反应I平衡不移动
C.其他条件不变,增大H2投入量一定能提高CH3OCH3平衡产率
D.其他条件不变,使用不同催化剂对CH3OCH3的平衡产率不产生影响
13.已知呈粉红色,呈蓝色,为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:+4Cl-+6H2O。用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A.由实验①可推知正反应的△H>0
B.实验②是由于c(H2O)增大,导致平衡逆向移动
C.由实验③可知配离子的稳定性:
D.原蓝色溶液中加入少量NaCl固体,实验现象与实验③相同
14.向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g) C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃ 700 800 900
平衡常数 0.1 X 1
800℃ 时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法正确的是
A.平衡时,c(B)为0.6 mol·L-1 B.800℃ 时平衡常数X=4/9
C.ΔH <0 D.900℃ 该反应达到平衡状态时,A的物质的量为0.5 mol
15.下列四幅图示所表示的信息与对应的叙述相符的是
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol?1
B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则ΔH1=ΔH2+ΔH3
D.图4表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,甲的压强大
三、非选择题:本题共5小题,共60分。
16.(12分)化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题:
(1)理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)HNC(g) ?H=_________kJ·mol-1。 HCN与HNC稳定性较强的是______。正反应的活化能 (填“大于”、“小于”或“等于”)逆反应的活化能。
(2)已知:
化学键种类 C—H N—H
键能(kJ/mol) a b
计算可得:HCN(g)HNC(g) ?H=_________kJ·mol-1(用含a、b的式子表示)。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧热的热化学方程式为________________________________。
(4)右图所示装置可以说明有化学能转化为电能的实验现象为_______________________________________、正极的电极反应式为_________________________。
实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验。
①实验装置中尚缺少的一种玻璃用品是_________________________。
②若测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
17.(12分)纯过氧化氢(H2O2)是_?·?è??è??_的黏稠液体,可任意比例与水_?··???_,广泛应用于医疗消毒、绿色化学合成等领域。回答下列问题:
(1)已知: H2(g)+O2(g)=H2O(l) ?H1=-286 kJ·mol-1
H2(g)+O2(g)=H2O2(l) ?H2=-188 kJ·mol?1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的?H=______kJ·mol-1。
(2)100℃ 时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
离子 加入量(mg·L?1) 分解率% 离子 加入量(mg·L?1) 分解率%
无 0 2 Fe3+ 1.0 15
Al3+ 10 2 Cu2+ 0.1 86
Zn2+ 10 10 Cr3+ 0.1 96
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+O2(g) K= 2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的 (填编号)。
A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是_______。
(4)过氧化氢的制备方法很多,早期制备方法如下:
①Ⅰ为分解反应,产物除 BaO、O2 外,还有一种红棕色气体。该反应的化学方程式是 。
② Ⅱ为可逆反应,促进该反应正向进行的措施是 (答一条即可)。
18.(14分) CO和H2是合成气,这两种气体都可以通过CH4通过一定的反应制得。
(1) CH4和CO2反应可以制得CO气体,CH4(g)+3CO2(g)2H2O(g)+4CO(g) ΔH=+330kJ·mol-1。
下图1表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]
① a1= ; ② 判断T1的T2的大小关系,T1 T2。(填“>”、“<”或“=”)
(2)CH4和H2O(g)催化重整可以制取H2和CO2,化学反应为:CH4+2H2O(g)4H2+CO2。实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以明显提高H2的体积分数。对比实验的结果如图2所示。
投CaO时H2的体积分数增大的原因是 。
微米CaO和纳米CaO对H2体积分数的影响不同的原因是 。
(3)生成的CO和H2可用于合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g) ΔH= -90.1kJ·mol-1,根据反应回答问题。
①初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。反应初始时两容器的反应速率
A B(填“>”、“<”或“=”,下同);平衡时CO的转化率A B。
②温度T时,在容积为2L的某密闭容器中进行上述反应,反应开始至平衡的相关数据如图3所示。
下列能表明该反应已达到平衡状态的是 。
A.v(H2)=2v(CH3OH) B.c(CO)/c(CH3OH)=7: 3时
C.容器中气体的压强不再变化 D.c(H2)/c(CH3OH)=2: 1时
③该化学反应10min内H2的反应速率v(H2)= 。该温度下,反应的平衡常数为 (保留1位小数)。
19.(10分)研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。碘钟反应是一种化学_???è????????_,其体现了_????????¨??????_的原理。某小组同学在室温下对某“碘钟实验”的原理进行探究。
资料:该“碘钟实验”反应分A、B两步进行:
反应A:S2O+2I-=2SO+I2(慢) 反应B:I2+2S2O=2I-+S4O(快)
(1)该“碘钟实验”的总反应是 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向K2S2O8溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入试剂Y溶液,溶液的蓝色褪去。
试剂X是______、试剂Y是 。
(3)已知A反应的速率方程为:v=kcm(S2O)·cn(I-),式中k为常数。为确定m、n值进行实验II。(溶液浓度均为0.01 mol/L)
实验 序号 试剂体积 V/ mL 显色时间
t/s
K2S2O8溶液 KI溶液 水 Na2S2O3溶液 淀粉溶液
① 10 10 0 4 1 27.0
② 5 10 5 4 1 54.0
③ 2.5 10 V1 4 1 108.0
④ 10 5 5 4 1 54.0
①表中V1=________mL,理由是_________________________________________;
②通过数据计算得知:m= n=_________。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验III。(溶液浓度均为0.01 mol/L)
试剂体积 V/ mL
K2S2O8溶液 KI溶液 水 Na2S2O3溶液 淀粉溶液
10 5 3 6 1
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验III未产生颜色变化的原因: 。
20.(12分)三氯化碘(ICl3)是一种黄色晶体,遇水易分解,熔点:33 ℃,沸点:73 ℃,在药物合成中用途非常广泛。某学习小组从海带中提取碘,并用于制备三氯化碘。
(1)从干海带中提取粗碘
①写出加入过氧化氢后的反应方程式 。
②操作Y用到的玻璃仪器有烧杯、 ,操作Z的名称为 。
(2)利用制得的碘单质制取 ICl3
①仪器a的名称是 。
②制备氯气选用的药品为高锰酸钾和浓盐酸,相关反应的离子方程式为 。
③装置B能监测实验进行时装置C中是否发生堵塞,此外还有什么作用 。
④试剂X为 ,X的作用是 。
⑤氯气与单质碘反应温度稍低于70℃,则装置D适宜的加热方式为 。
2020年秋高二期中七校联考化学答案
1-10 B A B A D D C C B D
11.AB 12.D 13.AC 14.BD 15.C
16.(12分)
(1) +59.3 (1分) HCN (1分) 大于 (1分)
(2) (a-b) (2分)
(3) CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH = -890 KJ/mol (2分)
(4)电流表指针发生偏转(1分,多答“铜片上有气泡产生、锌片上有气泡产生”不扣分)
2H++2e-=H2↑(1分)
(5)环形玻璃搅拌棒(1分) ABD (2分) (有错无分、掉一个扣1分、只选一个不给分)
17.(12分)
(1)-196 (2分)
(2)①Cr3+ (1分) B (1分) ②CD(2分)(有错无分、掉一个扣1分)
(3)氧气或者O2(2分)
(4)① (2分)
②增大压强或增大氧气的浓度(2分)(答一条即可)
18.(14分)
(1)①1:3 (2分) ② <(2分)
(2)CaO可以吸收CO2,使CO2浓度减小,生成H2 的反应正向移动,H2百分含量增大(2分)
纳米CaO表面积比微米CaO大,吸收CO2能力比微米CaO强(合理即可1分)
(3) ① = (1分) >(1分) ② BC(2分) ③ 0.06mol·L-1·min-1(1分) 2.7(2分)
(10分)
(1)S2O+2S2O=2SO+S4O(2分)
(2)淀粉碘化钾 (1分) Na2S2O3(1分)
(3)7.5 (1分) 保持溶液总体积不变 (1分) 1(1分) 1 (1分)
(4)由于n(K2S2O8)∶n(Na2S2O3)<1:2,v(A)< v(B),所以未出现溶液变蓝的现象。 (2分,答出一个要点给1分)
20.(12分)
(1)①2H+ + 2I- +H2O2 == 2H2O +I2 (2分) ②分液漏斗(1分) 蒸馏(1分)
① 蒸馏烧瓶(1分)
②2MnO4-+16H++10Cl- == 5Cl2↑+ 2Mn2+ + 8H2O(2分)
③吸收氯气中的氯化氢气体(1分)
④碱石灰(1分)吸收未反应的氯气,并防止空气中的水蒸气进入D装置使三氯化碘分解(2分,答出一个要点给1分)
⑤水浴加热(1分)
第1*2-1 11页 第1*212页
同课章节目录
