华东师大版九年级科学上册第三章第三节《常见的盐》同步练习(含答案) (1)
文档属性
| 名称 | 华东师大版九年级科学上册第三章第三节《常见的盐》同步练习(含答案) (1) |  | |
| 格式 | docx | ||
| 文件大小 | 174.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-11-27 14:20:53 | ||
图片预览



文档简介
常见的盐(同步练习)
总分
100
分,共
2
大题
15
题
单选题(总分
60
分,共
12
题)
1.
(5分)
某学生有以下的认为,其中不合理的是()
A.
盛放烧碱溶液的试剂瓶敞口放置,烧碱会变质
B.
用稀硫酸可以把氯化钡溶液、碳酸钠溶液和氢氧化钠溶液鉴别开来
C.
要除去氯化钠溶液中混有的少量硫酸铜,可以向溶液中加入氢氧化钡溶液
D.
可以按溶解、过滤、蒸发的顺序分离氧化钙和CaCO3
2.
(5分)
某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.分析以上实验现象,对原固体组成的推断正确的是(?)
A.
肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.
肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.
肯定有Na2CO3、Na2SO4,无FeCl3
D.
肯定有Na2CO3,无FeCl3、KCl
3.
(5分)
下列药品与水接触后,温度降低的是(?)
A.
烧碱
B.
硝酸铵
C.
浓硫酸
D氯化钠
4.
(5分)
向AgNO3、Cu(NO3)2、Mg(NO3)2的混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是(
??)
A.
滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.
滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.
滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.
滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
5.
(5分)
下列各组物质在给定的条件下能大量共存的是(
)
A.
在PH=1的溶液中:NaCl?
Na2SO4?
Na2CO3
B.
在PH=2的溶液中:KCl?
Na2SO4?
HNO3
C.
在PH=13的溶液中:BaCl2?
Na2CO3
NaOH
D.
在PH=14的溶液中:FeCl3?
Ba(NO3)2?
CaCl2
6.
(5分)
在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是(?)
A.
滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.
滴入几滴酚酞试液,酚酞试液不变色
C.
测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.
滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
7.
(5分)
有一包白色固体,可能含有BaCl
2、KCl、K
2SO
4、K
2CO
3中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如右图所示。由此推断白色固体中(?)
A.
肯定只存在BaCl2??????
B.
可能存在K2SO4
C.
可能存在KCl
D.
肯定不存在K2CO3
8.
(5分)
氯化钠的下列用途中,主要反映其具有杀菌防腐作用的是(?)
A.
制生理盐水
B.
作调味剂
C.
腌制鱼肉
D.
制取氢氧化钠
9.
(5分)
下列各组物质的溶液,不另加试剂无法一一鉴别的是(????)
A.
NaOH??
HCl??
CuSO4??MgSO4??????
B.
Na2CO3??
K2SO4??
BaCl2???
HCl
C.
KNO3??
NaCl??
FeCl3???
NaOH???????
D.
NH4NO3??H2SO4
??NaOH??
MgCl2
10.
(5分)
用如图装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是
(???)
A.
省去装置甲和丁
B.
将丙中的NaOH溶液换成Ca(OH)2溶液
C.
装置乙不再产生气泡时,立即停止抽气
D.
滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
11.
(5分)
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性。现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X是??(?????)
A.
水
B.
澄清石灰水
C.
纯碱溶液
D.
稀盐酸
12.
(5分)
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(???)
A.
C?CO
CO2
Na2CO3溶液
B.
CuCu(NO3)2溶液Cu(OH)2
C.
FeFe2O3Fe2(SO4)3溶液
D.
CaOCa(OH)2溶液NaOH溶液
问答题(总分
40
分,共
3
题)
13.(12分)
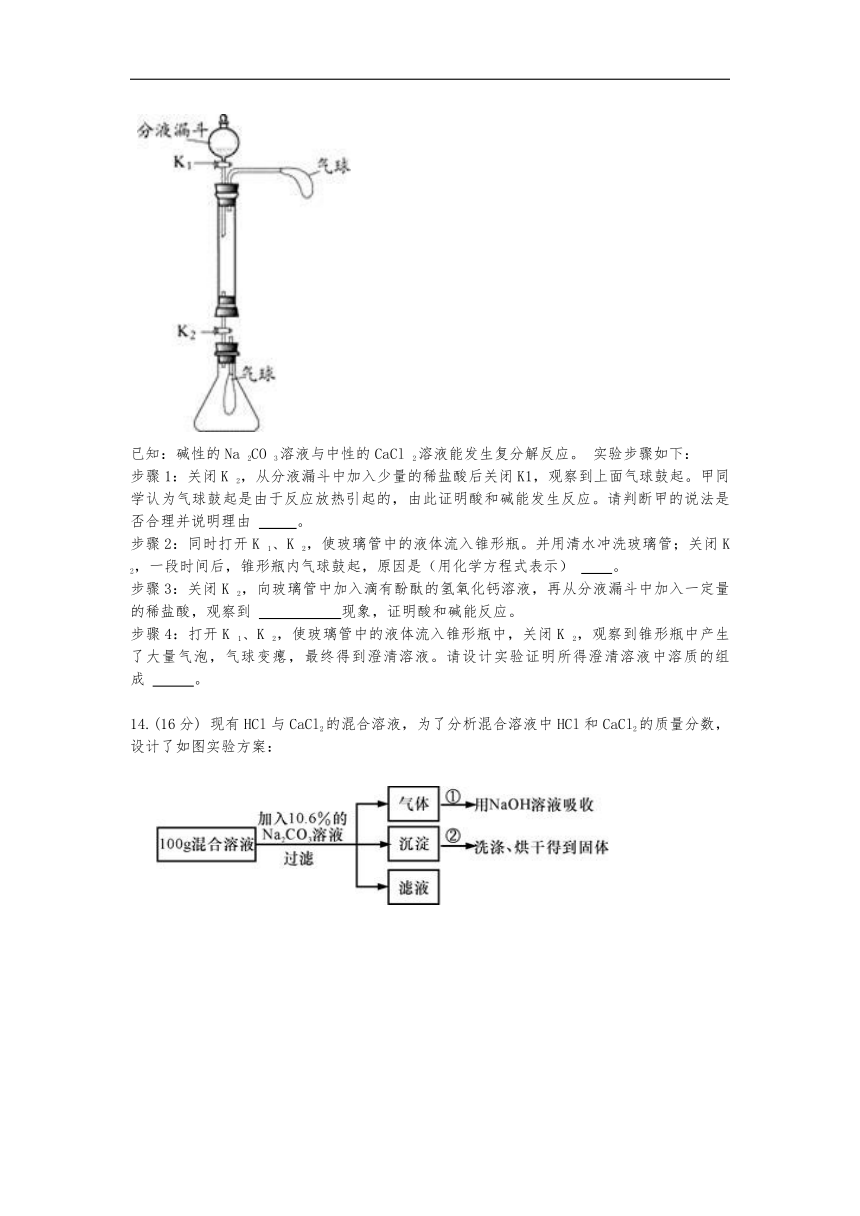
化学小组同学利用下图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体。
已知:碱性的Na
2CO
3溶液与中性的CaCl
2溶液能发生复分解反应。
实验步骤如下:
步骤1:关闭K
2,从分液漏斗中加入少量的稀盐酸后关闭K1,观察到上面气球鼓起。甲同学认为气球鼓起是由于反应放热引起的,由此证明酸和碱能发生反应。请判断甲的说法是否合理并说明理由
???????????。
步骤2:同时打开K
1、K
2,使玻璃管中的液体流入锥形瓶。并用清水冲洗玻璃管;关闭K
2,一段时间后,锥形瓶内气球鼓起,原因是(用化学方程式表示)
?????????。
步骤3:关闭K
2,向玻璃管中加入滴有酚酞的氢氧化钙溶液,再从分液漏斗中加入一定量的稀盐酸,观察到
????????????????????????现象,证明酸和碱能反应。
步骤4:打开K
1、K
2,使玻璃管中的液体流入锥形瓶中,关闭K
2,观察到锥形瓶中产生了大量气泡,气球变瘪,最终得到澄清溶液。请设计实验证明所得澄清溶液中溶质的组成
????????????。
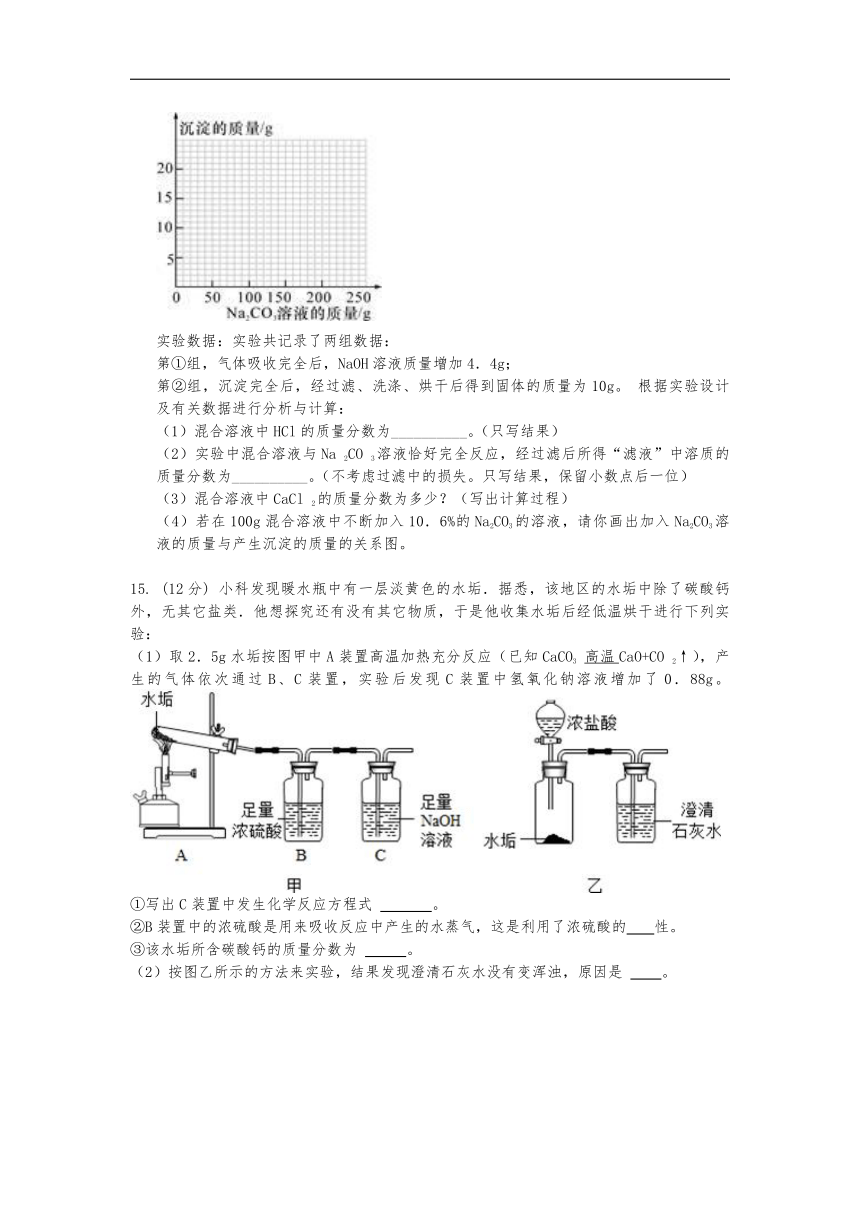
14.(16分)
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:
?
实验数据:实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)实验中混合溶液与Na
2CO
3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留小数点后一位)
(3)混合溶液中CaCl
2的质量分数为多少?(写出计算过程)
(4)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
15.
(12分)
小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中A装置高温加热充分反应(已知CaCO3
高温CaO+CO
2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式
???????????????。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的????????性。
③该水垢所含碳酸钙的质量分数为
????????????。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是
?????????。
常见的盐(答案)
总分
100
分,共
2
大题
15
题
单选题(总分
60
分,共
12
题)
1.
(5分)
某学生有以下的认为,其中不合理的是()
A.
盛放烧碱溶液的试剂瓶敞口放置,烧碱会变质
B.
用稀硫酸可以把氯化钡溶液、碳酸钠溶液和氢氧化钠溶液鉴别开来
C.
要除去氯化钠溶液中混有的少量硫酸铜,可以向溶液中加入氢氧化钡溶液
D.
可以按溶解、过滤、蒸发的顺序分离氧化钙和CaCO3
【答案】D
2.
(5分)
某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.分析以上实验现象,对原固体组成的推断正确的是(?)
A.
肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.
肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.
肯定有Na2CO3、Na2SO4,无FeCl3
D.
肯定有Na2CO3,无FeCl3、KCl
【答案】B
3.
(5分)
下列药品与水接触后,温度降低的是(?)
A.
烧碱
B.
硝酸铵
C.
浓硫酸
D氯化钠
【答案】B
4.
(5分)
向AgNO3、Cu(NO3)2、Mg(NO3)2的混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是(
??)
A.
滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.
滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.
滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.
滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
【答案】D
5.
(5分)
下列各组物质在给定的条件下能大量共存的是(
)
A.
在PH=1的溶液中:NaCl?
Na2SO4?
Na2CO3
B.
在PH=2的溶液中:KCl?
Na2SO4?
HNO3
C.
在PH=13的溶液中:BaCl2?
Na2CO3
NaOH
D.
在PH=14的溶液中:FeCl3?
Ba(NO3)2?
CaCl2
【答案】B
6.
(5分)
在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是(?)
A.
滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.
滴入几滴酚酞试液,酚酞试液不变色
C.
测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.
滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
【答案】C
7.
(5分)
有一包白色固体,可能含有BaCl
2、KCl、K
2SO
4、K
2CO
3中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如右图所示。由此推断白色固体中(?)
A.
肯定只存在BaCl2??????
B.
可能存在K2SO4
C.
可能存在KCl
D.
肯定不存在K2CO3
【答案】A
8.
(5分)
氯化钠的下列用途中,主要反映其具有杀菌防腐作用的是(?)
A.
制生理盐水
B.
作调味剂
C.
腌制鱼肉
D.
制取氢氧化钠
【答案】C
9.
(5分)
下列各组物质的溶液,不另加试剂无法一一鉴别的是(????)
A.
NaOH??
HCl??
CuSO4??MgSO4??????
B.
Na2CO3??
K2SO4??
BaCl2???
HCl
C.
KNO3??
NaCl??
FeCl3???
NaOH???????
D.
NH4NO3??H2SO4
??NaOH??
MgCl2
【答案】C
10.
(5分)
用如图装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是
(???)
A.
省去装置甲和丁
B.
将丙中的NaOH溶液换成Ca(OH)2溶液
C.
装置乙不再产生气泡时,立即停止抽气
D.
滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
【答案】D
11.
(5分)
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性。现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X是??(?????)
A.
水
B.
澄清石灰水
C.
纯碱溶液
D.
稀盐酸
【答案】C
12.
(5分)
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(???)
A.
C?CO
CO2
Na2CO3溶液
B.
CuCu(NO3)2溶液Cu(OH)2
C.
FeFe2O3Fe2(SO4)3溶液
D.
CaOCa(OH)2溶液NaOH溶液
【答案】D
问答题(总分
40
分,共
3
题)
13.(12分)
化学小组同学利用下图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体。
已知:碱性的Na
2CO
3溶液与中性的CaCl
2溶液能发生复分解反应。
实验步骤如下:
步骤1:关闭K
2,从分液漏斗中加入少量的稀盐酸后关闭K1,观察到上面气球鼓起。甲同学认为气球鼓起是由于反应放热引起的,由此证明酸和碱能发生反应。请判断甲的说法是否合理并说明理由
???????????。
步骤2:同时打开K
1、K
2,使玻璃管中的液体流入锥形瓶。并用清水冲洗玻璃管;关闭K
2,一段时间后,锥形瓶内气球鼓起,原因是(用化学方程式表示)
?????????。
步骤3:关闭K
2,向玻璃管中加入滴有酚酞的氢氧化钙溶液,再从分液漏斗中加入一定量的稀盐酸,观察到
????????????????????????现象,证明酸和碱能反应。
步骤4:打开K
1、K
2,使玻璃管中的液体流入锥形瓶中,关闭K
2,观察到锥形瓶中产生了大量气泡,气球变瘪,最终得到澄清溶液。请设计实验证明所得澄清溶液中溶质的组成
????????????。
14.(16分)
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:
?
实验数据:实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)实验中混合溶液与Na
2CO
3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留小数点后一位)
(3)混合溶液中CaCl
2的质量分数为多少?(写出计算过程)
(4)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
【答案】
15.
(12分)
小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中A装置高温加热充分反应(已知CaCO3
高温CaO+CO
2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式
???????????????。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的????????性。
③该水垢所含碳酸钙的质量分数为
????????????。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是
?????????。
总分
100
分,共
2
大题
15
题
单选题(总分
60
分,共
12
题)
1.
(5分)
某学生有以下的认为,其中不合理的是()
A.
盛放烧碱溶液的试剂瓶敞口放置,烧碱会变质
B.
用稀硫酸可以把氯化钡溶液、碳酸钠溶液和氢氧化钠溶液鉴别开来
C.
要除去氯化钠溶液中混有的少量硫酸铜,可以向溶液中加入氢氧化钡溶液
D.
可以按溶解、过滤、蒸发的顺序分离氧化钙和CaCO3
2.
(5分)
某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.分析以上实验现象,对原固体组成的推断正确的是(?)
A.
肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.
肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.
肯定有Na2CO3、Na2SO4,无FeCl3
D.
肯定有Na2CO3,无FeCl3、KCl
3.
(5分)
下列药品与水接触后,温度降低的是(?)
A.
烧碱
B.
硝酸铵
C.
浓硫酸
D氯化钠
4.
(5分)
向AgNO3、Cu(NO3)2、Mg(NO3)2的混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是(
??)
A.
滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.
滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.
滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.
滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
5.
(5分)
下列各组物质在给定的条件下能大量共存的是(
)
A.
在PH=1的溶液中:NaCl?
Na2SO4?
Na2CO3
B.
在PH=2的溶液中:KCl?
Na2SO4?
HNO3
C.
在PH=13的溶液中:BaCl2?
Na2CO3
NaOH
D.
在PH=14的溶液中:FeCl3?
Ba(NO3)2?
CaCl2
6.
(5分)
在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是(?)
A.
滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.
滴入几滴酚酞试液,酚酞试液不变色
C.
测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.
滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
7.
(5分)
有一包白色固体,可能含有BaCl
2、KCl、K
2SO
4、K
2CO
3中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如右图所示。由此推断白色固体中(?)
A.
肯定只存在BaCl2??????
B.
可能存在K2SO4
C.
可能存在KCl
D.
肯定不存在K2CO3
8.
(5分)
氯化钠的下列用途中,主要反映其具有杀菌防腐作用的是(?)
A.
制生理盐水
B.
作调味剂
C.
腌制鱼肉
D.
制取氢氧化钠
9.
(5分)
下列各组物质的溶液,不另加试剂无法一一鉴别的是(????)
A.
NaOH??
HCl??
CuSO4??MgSO4??????
B.
Na2CO3??
K2SO4??
BaCl2???
HCl
C.
KNO3??
NaCl??
FeCl3???
NaOH???????
D.
NH4NO3??H2SO4
??NaOH??
MgCl2
10.
(5分)
用如图装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是
(???)
A.
省去装置甲和丁
B.
将丙中的NaOH溶液换成Ca(OH)2溶液
C.
装置乙不再产生气泡时,立即停止抽气
D.
滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
11.
(5分)
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性。现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X是??(?????)
A.
水
B.
澄清石灰水
C.
纯碱溶液
D.
稀盐酸
12.
(5分)
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(???)
A.
C?CO
CO2
Na2CO3溶液
B.
CuCu(NO3)2溶液Cu(OH)2
C.
FeFe2O3Fe2(SO4)3溶液
D.
CaOCa(OH)2溶液NaOH溶液
问答题(总分
40
分,共
3
题)
13.(12分)
化学小组同学利用下图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体。
已知:碱性的Na
2CO
3溶液与中性的CaCl
2溶液能发生复分解反应。
实验步骤如下:
步骤1:关闭K
2,从分液漏斗中加入少量的稀盐酸后关闭K1,观察到上面气球鼓起。甲同学认为气球鼓起是由于反应放热引起的,由此证明酸和碱能发生反应。请判断甲的说法是否合理并说明理由
???????????。
步骤2:同时打开K
1、K
2,使玻璃管中的液体流入锥形瓶。并用清水冲洗玻璃管;关闭K
2,一段时间后,锥形瓶内气球鼓起,原因是(用化学方程式表示)
?????????。
步骤3:关闭K
2,向玻璃管中加入滴有酚酞的氢氧化钙溶液,再从分液漏斗中加入一定量的稀盐酸,观察到
????????????????????????现象,证明酸和碱能反应。
步骤4:打开K
1、K
2,使玻璃管中的液体流入锥形瓶中,关闭K
2,观察到锥形瓶中产生了大量气泡,气球变瘪,最终得到澄清溶液。请设计实验证明所得澄清溶液中溶质的组成
????????????。
14.(16分)
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:
?
实验数据:实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)实验中混合溶液与Na
2CO
3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留小数点后一位)
(3)混合溶液中CaCl
2的质量分数为多少?(写出计算过程)
(4)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
15.
(12分)
小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中A装置高温加热充分反应(已知CaCO3
高温CaO+CO
2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式
???????????????。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的????????性。
③该水垢所含碳酸钙的质量分数为
????????????。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是
?????????。
常见的盐(答案)
总分
100
分,共
2
大题
15
题
单选题(总分
60
分,共
12
题)
1.
(5分)
某学生有以下的认为,其中不合理的是()
A.
盛放烧碱溶液的试剂瓶敞口放置,烧碱会变质
B.
用稀硫酸可以把氯化钡溶液、碳酸钠溶液和氢氧化钠溶液鉴别开来
C.
要除去氯化钠溶液中混有的少量硫酸铜,可以向溶液中加入氢氧化钡溶液
D.
可以按溶解、过滤、蒸发的顺序分离氧化钙和CaCO3
【答案】D
2.
(5分)
某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.分析以上实验现象,对原固体组成的推断正确的是(?)
A.
肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.
肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.
肯定有Na2CO3、Na2SO4,无FeCl3
D.
肯定有Na2CO3,无FeCl3、KCl
【答案】B
3.
(5分)
下列药品与水接触后,温度降低的是(?)
A.
烧碱
B.
硝酸铵
C.
浓硫酸
D氯化钠
【答案】B
4.
(5分)
向AgNO3、Cu(NO3)2、Mg(NO3)2的混合物溶液中加入一些锌粉,完全反应后过滤.不可能存在的情况是(
??)
A.
滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.
滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.
滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.
滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
【答案】D
5.
(5分)
下列各组物质在给定的条件下能大量共存的是(
)
A.
在PH=1的溶液中:NaCl?
Na2SO4?
Na2CO3
B.
在PH=2的溶液中:KCl?
Na2SO4?
HNO3
C.
在PH=13的溶液中:BaCl2?
Na2CO3
NaOH
D.
在PH=14的溶液中:FeCl3?
Ba(NO3)2?
CaCl2
【答案】B
6.
(5分)
在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是(?)
A.
滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.
滴入几滴酚酞试液,酚酞试液不变色
C.
测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.
滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
【答案】C
7.
(5分)
有一包白色固体,可能含有BaCl
2、KCl、K
2SO
4、K
2CO
3中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如右图所示。由此推断白色固体中(?)
A.
肯定只存在BaCl2??????
B.
可能存在K2SO4
C.
可能存在KCl
D.
肯定不存在K2CO3
【答案】A
8.
(5分)
氯化钠的下列用途中,主要反映其具有杀菌防腐作用的是(?)
A.
制生理盐水
B.
作调味剂
C.
腌制鱼肉
D.
制取氢氧化钠
【答案】C
9.
(5分)
下列各组物质的溶液,不另加试剂无法一一鉴别的是(????)
A.
NaOH??
HCl??
CuSO4??MgSO4??????
B.
Na2CO3??
K2SO4??
BaCl2???
HCl
C.
KNO3??
NaCl??
FeCl3???
NaOH???????
D.
NH4NO3??H2SO4
??NaOH??
MgCl2
【答案】C
10.
(5分)
用如图装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是
(???)
A.
省去装置甲和丁
B.
将丙中的NaOH溶液换成Ca(OH)2溶液
C.
装置乙不再产生气泡时,立即停止抽气
D.
滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
【答案】D
11.
(5分)
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性。现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X是??(?????)
A.
水
B.
澄清石灰水
C.
纯碱溶液
D.
稀盐酸
【答案】C
12.
(5分)
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(???)
A.
C?CO
CO2
Na2CO3溶液
B.
CuCu(NO3)2溶液Cu(OH)2
C.
FeFe2O3Fe2(SO4)3溶液
D.
CaOCa(OH)2溶液NaOH溶液
【答案】D
问答题(总分
40
分,共
3
题)
13.(12分)
化学小组同学利用下图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质。玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体。
已知:碱性的Na
2CO
3溶液与中性的CaCl
2溶液能发生复分解反应。
实验步骤如下:
步骤1:关闭K
2,从分液漏斗中加入少量的稀盐酸后关闭K1,观察到上面气球鼓起。甲同学认为气球鼓起是由于反应放热引起的,由此证明酸和碱能发生反应。请判断甲的说法是否合理并说明理由
???????????。
步骤2:同时打开K
1、K
2,使玻璃管中的液体流入锥形瓶。并用清水冲洗玻璃管;关闭K
2,一段时间后,锥形瓶内气球鼓起,原因是(用化学方程式表示)
?????????。
步骤3:关闭K
2,向玻璃管中加入滴有酚酞的氢氧化钙溶液,再从分液漏斗中加入一定量的稀盐酸,观察到
????????????????????????现象,证明酸和碱能反应。
步骤4:打开K
1、K
2,使玻璃管中的液体流入锥形瓶中,关闭K
2,观察到锥形瓶中产生了大量气泡,气球变瘪,最终得到澄清溶液。请设计实验证明所得澄清溶液中溶质的组成
????????????。
14.(16分)
现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:
?
实验数据:实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)实验中混合溶液与Na
2CO
3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留小数点后一位)
(3)混合溶液中CaCl
2的质量分数为多少?(写出计算过程)
(4)若在100g混合溶液中不断加入10.6%的Na2CO3的溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
【答案】
15.
(12分)
小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取2.5g水垢按图甲中A装置高温加热充分反应(已知CaCO3
高温CaO+CO
2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g。
①写出C装置中发生化学反应方程式
???????????????。
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的????????性。
③该水垢所含碳酸钙的质量分数为
????????????。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是
?????????。
