人教版选修四高中化学1.3《化学反应热的计算》ppt课件(26张PPT)
文档属性
| 名称 | 人教版选修四高中化学1.3《化学反应热的计算》ppt课件(26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 672.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-30 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
第三节
化学反应热的计算
强调:正逆反应的反应热效应数值相等,符号相反。“+”不能省去。
知识回顾
已知石墨的燃烧热:△H=-393.5kJ/mol
1)写出石墨的完全燃烧的热化学方程式
2)二氧化碳转化为石墨和氧气的热化学方程式
[思考]
298K,101kPa时,合成氨反应的热化学方程式:
N2(g)+3H2(g)=2NH3(g);△H
=
-92.38kJ/mol
在该温度下,取1
mol
N2(g)和3
mol
H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么?
该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态,
1
mol
N2(g)和3
mol
H2(g)不能完全反应生成2
mol
NH3(g),因而放出的热量总小于92.38kJ
如何测定如下反应:
C(s)+1/2O2(g)=CO(g)
的反应热△H1
①能直接测定吗?如何测?
②若不能直接测,怎么办?
[思考]
计算
一.盖斯定律:
1.盖斯定律的内容:不管化学反应是一步完成或分几步完成,其反应热相同。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
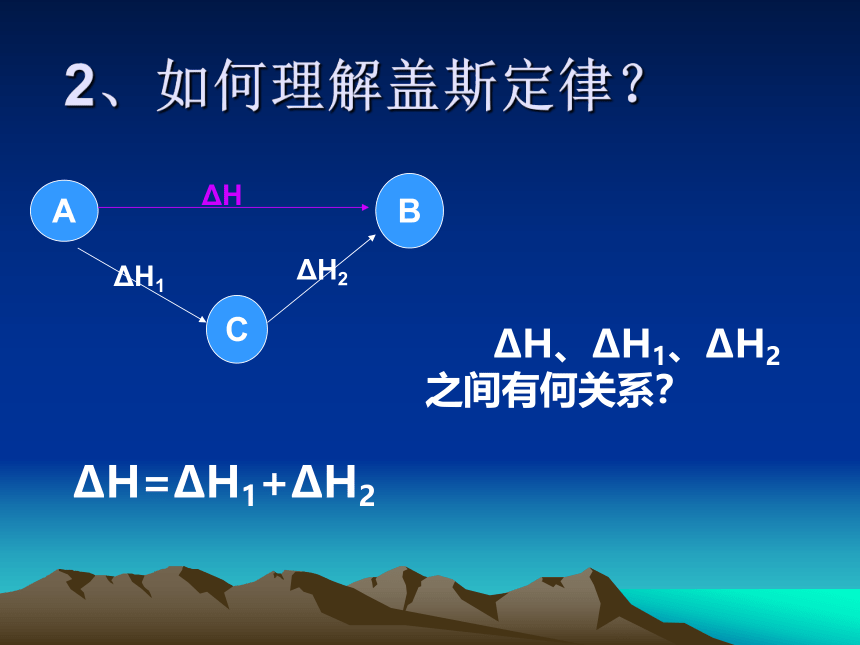
2、如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
CO(g)
C(s)
CO2(g)
H1
H3
H2
例1
C(s)+1/2O2(g)
=
CO(g)
△H1=?
CO(g)+1/2O2(g)
=
CO2(g)
△H2=-283.0
kJ/mol
C(s)+O2(g)
=
CO2(g)
△H3=-393.5
kJ/mol
+)
△H1
+
△H2
=
△H3
∴△H1
=
△H3
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
下列数据表示H2的燃烧热吗?Why?
H2(g)+1/2O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
已知
H2(g)+1/2O2(g)
=
H2O
(l)
△H=△H1+
△H2=-285.8kJ/mol
实例2
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
2.盖斯定律的应用
关键:目标方程式的“四则运算式”的导出
方法:
1.写出目标方程式确定“过渡物质”
(要消去的物质)
2.
然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
盖斯简介
【例1】已知①
CO(g)
+
1/2
O2(g)
=
CO2(g)
;
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
;
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)
+
3
O2(g)
=
2
CO2(g)
+
3H2O(l);
ΔH3=-1370
kJ/mol
试计算:
④2CO(g)+
4
H2(g)
=
H2O(l)+
C2H5OH
(l)
的ΔH
【解】:①×2
+
②×4
-
③
=
④
ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?=-283.2×2
-285.8×4
+1370
=-339.2
kJ/mol
你知道神六的火箭燃料是什么吗?
例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)
=
2NO2(g)
;
△H1=+67.2kJ/mol
N2H4(g)+O2(g)
=
N2(g)+2H2O(l);
△H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭
反应的热化学方程式。
2
N2H4(g)+
2NO2(g)
=
3N2(g)+4H2O(l)
;
△H=-1135.2kJ/mol
例3:已知:
CH4
(g)
+
2O2(g)=
CO2
(g)
+
2H2
O
(l);
△
H=
-Q1
KJ/mol
2H2(g)+O2(g)
=
2H2
O
(g);
△
H=
-Q2
KJ/mol
2H2(g)+O2(g)
=
2H2
O
(l);
△
H=-
Q3
KJ/mol
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
0.4Q1+0.05Q3
1.
已知25℃、101kPa下,石墨、金刚
石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是(
)
A.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高;
C.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
①C(石墨,s)+O2(g)=
CO2(g)
△H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=
CO2(g)
△H2=-395.0kJ/mol
练习:
2.
在100
g
碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)
+1/2O2(g)
=
CO(g);
=
-110.35
kJ/mol
CO(g)
+
1/2O2(g)
=
CO2(g);
=
-282.57
kJ/mol
与这些碳完全燃烧相比,损失的热量是(
)
392.92
kJ
B.
2489.44
kJ
C.
784.92
kJ
D.
3274.3
kJ
H
H
C
练习:
二.反应热的计算:
利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算:
题型一:有关热化学反应方程式的的含义及书写
题型二:燃烧热、中和热的判断、求算及测量
具体内容:
1.
已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算:
(1)盖斯定律及其应用
(2)
根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
(3)利用键能计算反应热
课本P12
例1:
【解】钠与氯气起反应的化学方程式如下
Na(s)
+
1/2Cl2(g)
=
NaCl
(s)
23g/mol
△H
1.0g
-17.87kJ
△H=23g/mol×(-17.87kJ)÷
1.0g
=-411kJ/mol
答:略
注意热化学方程式正确书写,特别注意有关单位的正确书写。
课本P12
例2:
【解】
C2H6O(l)
+
3O2(g)==
2CO2(g)
+3H2O
(l)
46g/mol
-1366.8kJ/mol
1000g
X
X=(-1366.8kJ/mol
×
1000g)/
46g/mol
=-29710kJ
答:1kg乙醇燃烧后放出29710kJ热量
设1kg乙醇燃烧后放出的热量为X
已知:
C(s)+O2(g)
=
CO2(g)
△H=-393.5kJ/mol
H2(g)+1/2O2(g)
=
H2O
(l)
△H
=-
41.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
(
)
A.
2:3.25
B.
12:3.25
C.
1:1
D.
393.5:241.8
B
变式练习1
变式练习2
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时放出热量最少的是(
)
A.
H2(g)
B.
CO(g)
C.
C8H18(l)
D.
CH4(g)
B
1.已知:2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比
课堂练习:
列方程求解
若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q
kJ,则金刚石和石墨的物质的量之比为:
。
2.已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
①
C(金刚石、s)+O2(g)
=
CO2(g)
△H1=-395.41kJ/mol
②
C(石墨、s)+O2(g)
=
CO2(g)
△H2=-393.51kJ/mol
课堂练习:
课堂练习:
3.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s)
=
CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则(
)
A.Q1>Q2
B.Q1=Q2
C.Q1D.无法确定
A
盖斯定律的灵活应用
G.H.Germain?Henri?Hess?(1802~1850)俄国化学家。1802年8月7日生于瑞士日内瓦,1850年12月12日卒于俄国圣彼得堡(现为列宁格勒)。3岁随父侨居俄国,并在俄国受教育。1825年于多尔帕特大学获医学专业证书,同时受到了化学和地质学的基础教育。1826~1827年,在斯德哥尔摩J.J.贝采利乌斯的实验室工作并从其学习化学。回俄国后在乌拉尔作地质勘探工作,后在伊尔库茨克做医生并研究矿物。1830年当选为圣彼得堡科学院院士,专门研究化学,任圣彼得堡工艺学院理论化学教授并在中央师范学院和矿业学院讲授化学。1838年成为俄国科学院院士。
盖斯简介
????盖斯早期研究了巴库附近的矿物和天然气;发现了蔗糖氧化生成糖二酸。他研究了炼铁中的热现象,作了大量的量热工作。1836年发现,在任何一个化学反应过程中,不论该反应过程是一步完成还是分成几步完成,反应所放出的总热量相同,并于1840年以热的加和性守恒定律公诸于世,后被称为盖斯定律。此定律为能量守恒定律的先驱。当一个反应不能直接发生时,应用此定律可间接求得反应热。因此,盖斯也是热化学的先驱者。著有《纯粹化学基础》(1834),曾用作俄国教科书达40年。
盖斯简介
盖斯定律是在热力学第一定律之前发现的,实际上是热力学第一定律在化学反应的具体体现,是状态函数的性质。盖斯定律奠定了热化学计算的基础,使化学方程式像普通代数方程那样进行运算,从而可以根据已经准确测定的热力学数据计算难以测定的反应热。
盖斯简介
第三节
化学反应热的计算
强调:正逆反应的反应热效应数值相等,符号相反。“+”不能省去。
知识回顾
已知石墨的燃烧热:△H=-393.5kJ/mol
1)写出石墨的完全燃烧的热化学方程式
2)二氧化碳转化为石墨和氧气的热化学方程式
[思考]
298K,101kPa时,合成氨反应的热化学方程式:
N2(g)+3H2(g)=2NH3(g);△H
=
-92.38kJ/mol
在该温度下,取1
mol
N2(g)和3
mol
H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么?
该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态,
1
mol
N2(g)和3
mol
H2(g)不能完全反应生成2
mol
NH3(g),因而放出的热量总小于92.38kJ
如何测定如下反应:
C(s)+1/2O2(g)=CO(g)
的反应热△H1
①能直接测定吗?如何测?
②若不能直接测,怎么办?
[思考]
计算
一.盖斯定律:
1.盖斯定律的内容:不管化学反应是一步完成或分几步完成,其反应热相同。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
CO(g)
C(s)
CO2(g)
H1
H3
H2
例1
C(s)+1/2O2(g)
=
CO(g)
△H1=?
CO(g)+1/2O2(g)
=
CO2(g)
△H2=-283.0
kJ/mol
C(s)+O2(g)
=
CO2(g)
△H3=-393.5
kJ/mol
+)
△H1
+
△H2
=
△H3
∴△H1
=
△H3
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
下列数据表示H2的燃烧热吗?Why?
H2(g)+1/2O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
已知
H2(g)+1/2O2(g)
=
H2O
(l)
△H=△H1+
△H2=-285.8kJ/mol
实例2
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
2.盖斯定律的应用
关键:目标方程式的“四则运算式”的导出
方法:
1.写出目标方程式确定“过渡物质”
(要消去的物质)
2.
然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
盖斯简介
【例1】已知①
CO(g)
+
1/2
O2(g)
=
CO2(g)
;
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
;
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)
+
3
O2(g)
=
2
CO2(g)
+
3H2O(l);
ΔH3=-1370
kJ/mol
试计算:
④2CO(g)+
4
H2(g)
=
H2O(l)+
C2H5OH
(l)
的ΔH
【解】:①×2
+
②×4
-
③
=
④
ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?=-283.2×2
-285.8×4
+1370
=-339.2
kJ/mol
你知道神六的火箭燃料是什么吗?
例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)
=
2NO2(g)
;
△H1=+67.2kJ/mol
N2H4(g)+O2(g)
=
N2(g)+2H2O(l);
△H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭
反应的热化学方程式。
2
N2H4(g)+
2NO2(g)
=
3N2(g)+4H2O(l)
;
△H=-1135.2kJ/mol
例3:已知:
CH4
(g)
+
2O2(g)=
CO2
(g)
+
2H2
O
(l);
△
H=
-Q1
KJ/mol
2H2(g)+O2(g)
=
2H2
O
(g);
△
H=
-Q2
KJ/mol
2H2(g)+O2(g)
=
2H2
O
(l);
△
H=-
Q3
KJ/mol
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
0.4Q1+0.05Q3
1.
已知25℃、101kPa下,石墨、金刚
石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是(
)
A.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高;
C.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
①C(石墨,s)+O2(g)=
CO2(g)
△H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=
CO2(g)
△H2=-395.0kJ/mol
练习:
2.
在100
g
碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)
+1/2O2(g)
=
CO(g);
=
-110.35
kJ/mol
CO(g)
+
1/2O2(g)
=
CO2(g);
=
-282.57
kJ/mol
与这些碳完全燃烧相比,损失的热量是(
)
392.92
kJ
B.
2489.44
kJ
C.
784.92
kJ
D.
3274.3
kJ
H
H
C
练习:
二.反应热的计算:
利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算:
题型一:有关热化学反应方程式的的含义及书写
题型二:燃烧热、中和热的判断、求算及测量
具体内容:
1.
已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算:
(1)盖斯定律及其应用
(2)
根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
(3)利用键能计算反应热
课本P12
例1:
【解】钠与氯气起反应的化学方程式如下
Na(s)
+
1/2Cl2(g)
=
NaCl
(s)
23g/mol
△H
1.0g
-17.87kJ
△H=23g/mol×(-17.87kJ)÷
1.0g
=-411kJ/mol
答:略
注意热化学方程式正确书写,特别注意有关单位的正确书写。
课本P12
例2:
【解】
C2H6O(l)
+
3O2(g)==
2CO2(g)
+3H2O
(l)
46g/mol
-1366.8kJ/mol
1000g
X
X=(-1366.8kJ/mol
×
1000g)/
46g/mol
=-29710kJ
答:1kg乙醇燃烧后放出29710kJ热量
设1kg乙醇燃烧后放出的热量为X
已知:
C(s)+O2(g)
=
CO2(g)
△H=-393.5kJ/mol
H2(g)+1/2O2(g)
=
H2O
(l)
△H
=-
41.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为
(
)
A.
2:3.25
B.
12:3.25
C.
1:1
D.
393.5:241.8
B
变式练习1
变式练习2
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时放出热量最少的是(
)
A.
H2(g)
B.
CO(g)
C.
C8H18(l)
D.
CH4(g)
B
1.已知:2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比
课堂练习:
列方程求解
若取金刚石和石墨的混合晶体共1mol在O2中完全燃烧,产生的热量为Q
kJ,则金刚石和石墨的物质的量之比为:
。
2.已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
①
C(金刚石、s)+O2(g)
=
CO2(g)
△H1=-395.41kJ/mol
②
C(石墨、s)+O2(g)
=
CO2(g)
△H2=-393.51kJ/mol
课堂练习:
课堂练习:
3.已知胆矾溶于水时溶液温度降低,
胆矾分解的热化学方程式为:
CuSO4?5H2O(s)
=
CuSO4(s)+5H2O(l)
△H=+Q1kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液
时放热Q2kJ,则(
)
A.Q1>Q2
B.Q1=Q2
C.Q1
A
盖斯定律的灵活应用
G.H.Germain?Henri?Hess?(1802~1850)俄国化学家。1802年8月7日生于瑞士日内瓦,1850年12月12日卒于俄国圣彼得堡(现为列宁格勒)。3岁随父侨居俄国,并在俄国受教育。1825年于多尔帕特大学获医学专业证书,同时受到了化学和地质学的基础教育。1826~1827年,在斯德哥尔摩J.J.贝采利乌斯的实验室工作并从其学习化学。回俄国后在乌拉尔作地质勘探工作,后在伊尔库茨克做医生并研究矿物。1830年当选为圣彼得堡科学院院士,专门研究化学,任圣彼得堡工艺学院理论化学教授并在中央师范学院和矿业学院讲授化学。1838年成为俄国科学院院士。
盖斯简介
????盖斯早期研究了巴库附近的矿物和天然气;发现了蔗糖氧化生成糖二酸。他研究了炼铁中的热现象,作了大量的量热工作。1836年发现,在任何一个化学反应过程中,不论该反应过程是一步完成还是分成几步完成,反应所放出的总热量相同,并于1840年以热的加和性守恒定律公诸于世,后被称为盖斯定律。此定律为能量守恒定律的先驱。当一个反应不能直接发生时,应用此定律可间接求得反应热。因此,盖斯也是热化学的先驱者。著有《纯粹化学基础》(1834),曾用作俄国教科书达40年。
盖斯简介
盖斯定律是在热力学第一定律之前发现的,实际上是热力学第一定律在化学反应的具体体现,是状态函数的性质。盖斯定律奠定了热化学计算的基础,使化学方程式像普通代数方程那样进行运算,从而可以根据已经准确测定的热力学数据计算难以测定的反应热。
盖斯简介
