人教版选修四高中化学3.2:水的电离和溶液的酸碱性(68张PPT)
文档属性
| 名称 | 人教版选修四高中化学3.2:水的电离和溶液的酸碱性(68张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-30 15:56:11 | ||
图片预览










文档简介
(共68张PPT)
第三章
水溶液中的离子平衡
第二节
水的电离和溶液的酸碱性
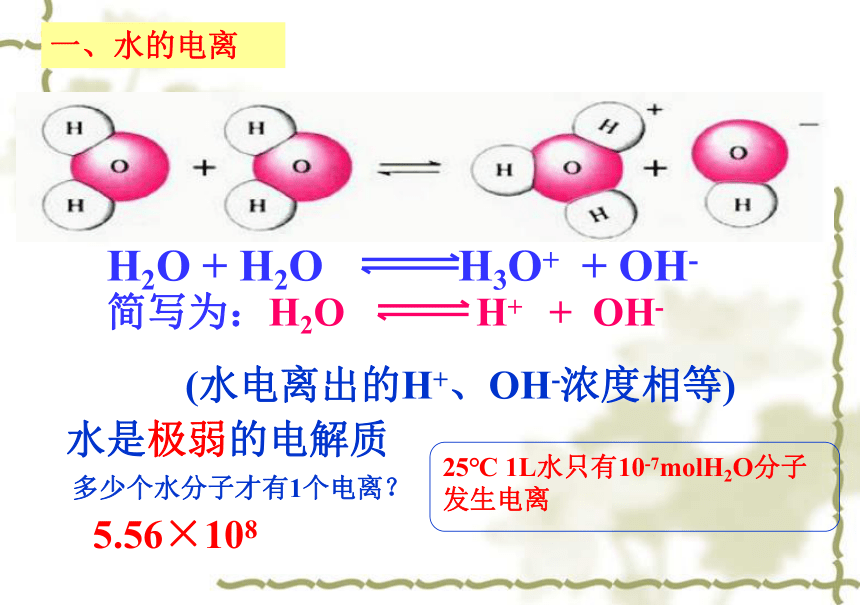
一、水的电离
H2O
+
H2O
H3O+
+
OH-
简写为:H2O
H+ +
OH-
(水电离出的H+、OH-浓度相等)
水是极弱的电解质
25℃
1L水只有10-7molH2O分子发生电离
多少个水分子才有1个电离?
5.56×108
K
电离=
c(H+)×c(OH-)
c(H2O)
K电离
.
=
c
(
H+)
.c(
OH-)
c(H2O)
Kw
=
c
(
H+)
.c(
OH-)
其中常数K与常数c(H2O)的积记为Kw,称为水的离子积常数,简称为离子积
H2O
H+ +
OH-
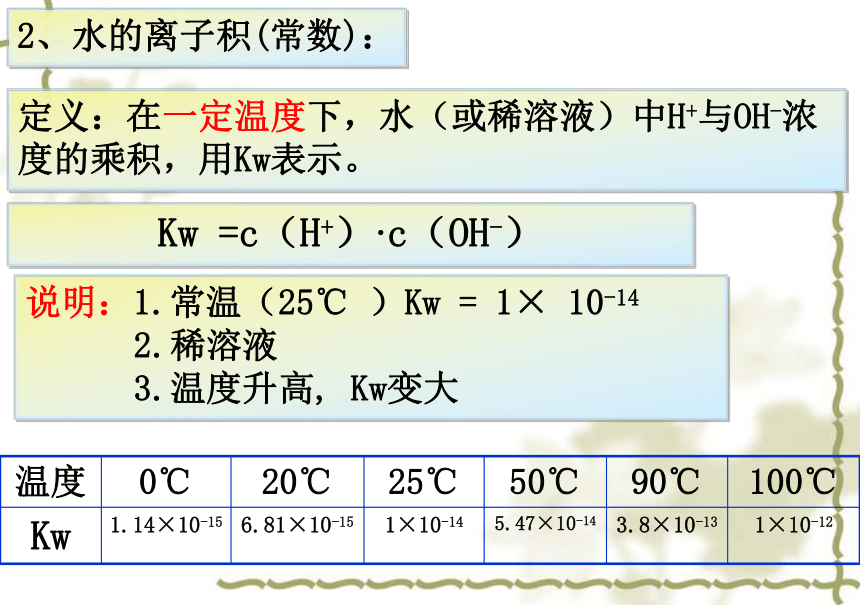
1、水的离子积常数
Kw
=c(H+)·c(OH-)
说明:1.常温(25℃
)Kw
=
1×
10-14
2.稀溶液
3.温度升高,
Kw变大
2、水的离子积(常数):
定义:在一定温度下,水(或稀溶液)中H+与OH-浓度的乘积,用Kw表示。
温度
0℃
20℃
25℃
50℃
90℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
3.8×10-13
1×10-12
问题与讨论
1、在水中加入强酸(HCl)后,水的离子积是否发生改变?
2、在水中加入强碱(NaOH)后,水的离子积是否发生改变?升温呢?
3、在酸碱溶液中,水电离出来的c(H+)和c(OH-)是否相等?
4、100℃时,水的离子积为10-12,求纯水中c(H+)为多少?
5、在酸溶液中水电离出来的c(H+)和酸电离出来的c(H+)
有什么关系?
二、影响水的电离平衡的因素
1、酸
2、碱
3、温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大.
4、加入能消耗H+和OH-的物质
如:①Na、②Cu2+、③CH3COO-
三、溶液的酸、碱性跟c(H+)、c(OH-)的关系
1.重要规律:
在一定温度时,稀电解质溶液里c(H+)与c(OH-)的乘积是一个常数。
C(稀)
≤1mol/L
例:25℃时,Kw=1×10-14
100℃时,Kw=1×10-12
三、溶液的酸、碱性跟c(H+)、c(OH-)的关系
2.关系(25℃):
中性溶液:
酸性溶液:
碱性溶液:
注
意
①水溶液中H+与OH-始终共存
②酸性溶液:c(H+)>c(OH-)
;c(H+)越大酸性越强
③碱性溶液:c(H+);c(OH-)越大碱性越强
c(H+)=c(OH-)=1×10-7mol/L
c(H+)>c(OH-)
c(H+)>1×10-7mol/L
c(H+)c(H+)<1×10-7mol/L
(2)常温下,浓度为1×10-5mol/l的NaOH溶液中,由水电离产生的c(OH-)是多少?
思考1.(1)常温下,浓度为1×10-5mol/l的盐酸溶液中,由水电离产生的c(H+)是多少?
1×10-9mol/L
1×10-9mol/L
思考题:在常温下,由水电离产生的c(H+)=1×10-9
mol/L的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
思考2:10mL10-4mol/LHCl,加水至100mL,此时溶液中c(H+)=
mol/L;若加水至105mL,此时溶液中
c(H+)又是
10-5
接近10-7mol/L,略大于10-7mol/L
说明
①酸性溶液中c(H+),以酸所电离出的H+浓度为准,若酸过度稀释,c(H+)接近10-7mol/L,但略大于10-7mol/L
②碱性溶液中c(OH-),以碱所电离出的OH-浓度为准,若碱过度稀释,c(OH-)接近10-7mol/L,但略大于10-7mol/L
练习1、纯水在10℃和50℃的H+浓度,前者与后者的关系是
A.前者大
B.后者大
C.相等
D.无法确定
练习2、下列微粒中不能破坏水的电离平衡的是
A、H+
B、OH-
C、S2-
D、Na+
练习3、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是
A、CH3COONa
B、Na2SO4
C、NH4Cl
D、CH3COOH
练习4、某温度下纯水中C(H+)
=
2×10-7
mol/L,则此时溶液中的c(OH-)
=
___________。
若温度不变,滴入稀盐酸使C(H+)
=
5×10-6
mol/L,则此时溶液中的c(OH-)
=
___________。
B
D
A
2×10-7
mol/L
8×10-9
mol/L
练习5、在25
℃,在某无色溶液中由水电离出的c(OH-)=
1×10-13mol/L,一定能大量共存的离子组是
NH4+、K+、NO3-
、Cl-
B.NO3-、CO32-、K+、Na+
C.
K+、Na+、Cl-、SO42-
D.Mg2+、Cu2+、SO42-、
Cl-
C
练习6、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为Kw(25℃)=1×10-14,
Kw(35℃)
=2.1
×10-14。则下列叙述正确的是:
A、c(H+)随着温度的升高而降低
B、在35℃时,纯水中
c(H+)>c(OH-)
C、水的电离常数K(25℃)>K(35℃)
D、水的电离是一个吸热过程
D
练习8、
25℃、浓度均为0.1mol/L的下列溶液中C(H+)由大到小的排列顺序:①氨水
②NaOH
③盐酸
④醋酸
练习7、判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性)
,都存在Kw=10-14
。
③某温度下,某液体c(H+)=
10-7mol/L,则该溶液一定是纯水。
√
×
×
③>④
>
①
>
②
安陆一中化学组
第二节
水的电离和溶液的酸碱性
溶液pH的计算
二、溶液的酸碱性与pH值
1、定义:化学上常采用H+浓度的负对数来表示溶液的酸碱性。
3、溶液的酸碱性与pH值的关系
酸性溶液:
c(H+)>c(OH—)
pH<7
中性溶液:
c(H+)=c(OH—)
pH=7
碱性溶液:
c(H+)pH>7
2、表示方法:pH=-lg
c(H+)
pOH=-lg
c(OH—)
注意:
①溶液呈中性的标志是c(H+)=
c(OH-),此时pH不一定为7
②酸性越强,pH越小;碱性越强,pH越大。对于酸而言:pH减小一个单位,c(H+)就增大到原来的10倍,pH减小n个单位,c(H+)就增大到原来的10n倍。
③任意水溶液中c(H+)≠0,但pH可为0,此时c(H+)=1mol/L。一般,当c(H+)>1mol/L时,故直接用c(H+)表示。
有关溶液pH的计算
1、单一溶液的计算:
①强酸溶液:
如:0.1mol/L的HCl溶液,pH=1
一般而言对于强酸HnA,设浓度为c
mol/l,
则c(H+)=nc
mol/L,pH=-lgc(H+)=-lgnc
②强碱溶液:
如:0.1mol/L的NaOH溶液,pH=13
一般而言对于强碱B(OH)n,设浓度为c
mol/l,则c(H+)=10-14/nc
mol/L,pH=-lgc(H+)=14+lgnc
思考:
①已知弱酸HA的浓度为c
mol/L,电离度为α,则pH=
②已知弱碱BOH的浓度为c
mol/L,电离度为α,则pH=
-lgcα
14+lgcα
2、强酸、强碱的稀释:
例1、0.001
mol/L盐酸的pH
=____,加水稀释到原来体积的10倍,pH=___,加水到原来的103倍,pH
=___,加水到原来的104
倍pH=
__,加水到原来的106倍,pH=__
例2、pH=10的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____,pH=10的NaOH溶液加水稀释到原来的102倍,则溶液的pH=_______
3
4
6
9
8
②pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:①强酸(碱)每稀释10倍,pH向7靠拢一个单位。
例3、pH=3HAc加水稀释到原来10倍,溶液的pH值范围________________;
pH=12氨水加水稀释到原来10倍,溶液的pH值范围________________。
?
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位
3、弱酸、弱碱的稀释
3—4之间
11—12之间
4、两种pH值不同的同种强酸(碱)溶液混合
例5、①pH=11和pH=9的两种NaOH溶液等体积混合,求混合溶液的pH值。
例4、①pH=3和pH=5的两种盐酸以2:1的体积比混合,求混合溶液的pH值
c(H+)=(10-3×2+10-5×1)/3=6.7×10-4mol/L
pH=3.2
c(OH-)=
(10-3+10-5)/2=5.05×10-4mol/L
c(H+)=2×10-11mol/L
pH=10.7
例6、①
pH=1盐酸和pH=12的NaOH溶液等体积混合,求
混合后溶液的pH值。
5、强酸、强碱溶液的混合
c(H+)=(10-1-10-2)/2=0.045mol/L
pH=1.35
②pH=4盐酸和pH=12的NaOH溶液等体积混合,求混合后溶液的pH值。
c(OH-)=
(10-2-10-4)/2=5×10-3mol/L
c(H+)=2×10-12mol/L
pH=11.7
pH=8和pH=10的两种NaOH溶液等体积混合后pH=9.7
错解:c(H+)=(10-8+10-10)/2=5.05×10-9mol/L
pH=8.3
pH=8
c(H+)=10-8mol/L
c(OH-)=10-6mol/L
pH=10
c(H+)=10-10mol/L
c(OH-)=10-4mol/L
c(H+)混=
(10-8+10-10)/2=5×10-9mol/L
c(OH-)混=(10-6+10-4)/2=5×10-5mol/L
c(H+)混×
c(OH-)混>Kw,平衡逆向移动
H2O
=
H+ +
OH-
5×10-9
5×10-5
5×10-9-x
5×10-5-x
∴(5×10-9-x)(5×10-5-x)=10-14
X<5×10-9
5×10-5
∴c(H+)=10-14÷(5×10-5)=2×10-10mol/L
平衡浓度
起始浓度
高考典型题型
pH=13的强碱和pH=2的强酸混合所得溶液的pH=11,则强碱与强酸的体积比为
1:9
设碱为XL,酸为1L,则
c(OH-)=
(10-1×x-10-2×1)/(x+1)=10-3mol/L
X=1/9
6、弱酸强碱或强酸弱碱混合
例7、
(1)pH为12的NaOH溶液和pH为2的醋酸溶液等体积相混合,则混合液呈_____性
(2)pH为12的氨水和pH为2
的盐酸等体积相混合,则混合液呈
____性
(3)pH为2的盐酸和pH为12
的某碱等体积相混合,则混合液pH_______
(4)pH为12的NaOH溶液和pH为2的某酸溶液等体积相混合,则混合液pH
_____
(5)pH为12的氨水和pH=2的醋酸溶液等体积混合,则混合液的pH_____。
酸
碱
≥7
≤7
比较α大小
1、某酸溶液的pH为2,某碱溶液的pH为12,两者等体积相混合后,有关pH值的变化正确的是
A、大于7
B、小于7
C、等于7
D、都有可能
2、常温下一种pH为2
的酸溶液与一种pH为12
的碱溶液等体积相混合,对溶液的酸碱性的说法正确的是
A、若是二元强酸和一元强碱,混合液为酸性
B、若是浓的强酸和稀的强碱,混合液中呈酸性
C、若是浓的弱酸和稀的强碱,混合液呈碱性
D、若是强酸和强碱相混合,溶液反应后呈中性
D
D
3、同体积的pH为3
的盐酸、硫酸、醋酸和硝酸四种溶液,分别加入足量的锌粉,叙述正确的是
A、硫酸溶液中放出的氢气的量最多
B、醋酸溶液中放出的氢气的量最多
C、盐酸和硝酸中放出的氢气的量相等
D、盐酸比硝酸放出的氢气的量多
BD
4、向体积均是1L,pH值也相等的盐酸和醋酸两溶液中加入表面积质量均相等的锌块,下列叙述正确的是
A、反应开始时,盐酸的速率比醋酸快
B、反应过程中,醋酸的速率比盐酸快
C、充分反应后,两者产生的氢气的体积可能相等
D、充分反应后,若有一种溶液中的锌有多余,则一定是盐酸的锌有余
BCD
5、酸HA、HB两溶液的pH值为3,且体积相同,加水稀释两溶液,pH值与加入水的体积关系如图所示,则两者酸性较强的是
加水体积
pH
HB
HA
HB
6、酸HA、HB、HC三溶液的物质的量浓度相同,体积也相同,测得它们的pH值分别为2、2.7、3,分别与足量的锌反应,产生的氢气的物质的量
,初始时,三者的反应速率
,若三种酸的体积与pH值均相等时,分别加入足量的表面积和质量均相等的锌,初始时,三者的反应速率
,反应过程中的平均速率
;充分反应后,产生的氢气的物质的量的大小关系
相同
相同
7、关于水的离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是
A、Kw和Kc都随温度的升高而减小
B、Kw和Kc的数值不同,但单位相同
C、Kw和Kc数值相同,但单位不同
D、Kw和Kc数值和单位都不同
D
8、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A、向水中投入一小块金属钠
B、将水加热煮沸
C、向水中通入CO2气体
D、向水中加入食盐晶体
C
9、pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是
A、盐酸>醋酸
B、醋酸>盐酸
C、盐酸=醋酸
D、无法判断
A
10、某次酸雨分析数据如下:c(NH4+)=2.0×10-5mol/L,c(Cl-)=6.0×10-5mol/L,
c(Na+)=1.9×10-5mol/L,
c(NO3-)=2.3×10-5mol/L,
c(SO42-)=5.6×10-5mol/L,则此次酸雨的pH大约为
A、3
B、4
C、5
D、6
B
11、两种不同浓度的NaOH溶液,c(H+)分别为
1×10-14mol/L和1×10-10mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是
A、1×(10-14+10-10)mol/L
B、0.5×(10-14+10-10)mol/L
C、2×10-10mol/L
D、2×10-14mol/L
D
12、有人建议用AG表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。下列表述正确的是
A、在25℃时,若溶液呈中性,则pH=7,AG=1
B、在25℃时,若溶液呈酸性,则pH<7,AG<0
C、在25℃时,若溶液呈碱性,则pH>7,AG<0
D、在25℃时,溶液的pH和AG的换算公式为:AG=14-2pH
CD
14、设某pH的硫酸中水电离出的c(H+)=
1.0×10-amol/L,设相同的pH的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。
、
。
13、在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为Amol/L与Bmol/L,则A与B的关系为
A
.A>B
B.A=10-4B
C.B=10-4A
D.A=B
B
a+b=14
a>b
安陆一中化学组
第二节
水的电离和溶液的酸碱性
第三课时
pH的应用
酸碱中和滴定
☆实验:酸碱中和滴定
1、定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2、原理:在酸碱中和反应中,用一种已知浓度的酸(或碱)溶液跟未知浓度的碱(或酸)溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。
3、公式:
4、实验的关键:
(1)准确测量参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全反应
c酸v酸=c碱v碱(一元酸和一元碱)
5、实验仪器
酸式滴定管、碱式滴定管、锥形瓶、
铁架台、滴定管夹、烧杯、白纸(有时还需要移液管)
☆滴定管的构造
1、滴定管是内径均匀、带有刻度的细长玻璃管,下端有控制液体流量的玻璃活塞(或由橡胶管和玻璃球组成的阀)
2、有“0”刻度,且小刻度在上。
3、精确度:0.01mL
滴定管的用途
滴定管主要用来精确地放出一定体积的液体。
☆滴定管的使用方法
a、检查仪器:使用前先检查滴定管活塞是否漏水
b、润洗仪器:在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗2—3遍。
c、加入反应液:分别将反应液加入到相应滴定管中,使液面位于滴定管刻度“0”以上2—3cm处。
d、调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,然后调节滴定管液面,使其处于某一刻度,准确读取数值并记录。
☆读数的方法:
←你能读得准吗?
25.60mL
思考1:酸式滴定管和碱式滴定管的结构有什么不同,为什么?盛放溶液时有何要求?
酸式滴定管:酸性溶液,强氧化性溶液
碱式滴定管:碱性溶液
思考2:如果滴定管下端尖嘴中有气泡存在,对实验结果有什么影响?如何除去气泡?
酸式滴定管:快速的打开玻璃塞,放出一小股液体
碱式滴定管:用手指挤压玻璃球,快速放出一小股液体
所需试剂
1、标准液
2、待测液
3、指示剂
a、酸碱中和滴定中通常用甲基橙和酚酞作指示剂,一般不用石蕊试液。
b、根据中和反应恰好完全反应时溶液的pH应在指示剂的变色范围之内,来选择指示剂。
c、选择指示剂时,滴定终点前后溶液颜色改变由浅到深,颜色变化对比明显。
2、酸碱指示剂:一般是有机弱酸或有机弱碱溶液(定性测定)
1、原则:
①终点时,指示剂的颜色变化须明显
②变色范围越窄越好,对溶液的酸碱性变化较灵敏
☆二、指示剂的选择:
种类
对应溶液的颜色
变色范围
甲基橙溶液
橙色
红3.1橙4.4黄
酚酞溶液
无色
无色8.2浅红10红
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多必将消耗一部分酸碱溶液(一般为1→2滴)。
a、强酸强碱间的滴定:
b、强酸滴定弱碱
两者正好完全反应,生成强酸弱碱盐,反应后溶液呈酸性选用甲基橙作指示剂
c、强碱滴定弱酸
3、酸碱中和滴定中指示剂的选择:
两者正好完全反应,生成强碱弱酸盐,反应后溶液呈碱性选用酚酞作指示剂
酚酞溶液、甲基橙
c、操作:用镊子取一小块pH试纸放在洁净的表面皿或玻璃片上,然后用玻璃棒沾取少量待测液点在试纸中央,试纸显色后再与标准比色卡比较,即知溶液的pH值。
4、pH试纸(定量测定)
a、成分:含有多种酸碱指示剂
b、本身颜色:淡黄色
d、种类:常用的pH试纸有广泛pH试纸和精密pH试纸,次外,还有用于酸性、中性或碱性溶液的专用pH试纸。
思考2:如何判断酸碱溶液恰好中和?
可用甲基橙或酚酞判断终点。
思考3:酸碱中和滴定选用酚酞或甲基橙作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
甲基橙:3.3—4.4
酚酞:8--10
练习:25℃在20.00mL
0.10mol/L的盐酸中,逐滴滴入0.10mol/L
NaOH溶液20.00mL。
⑴判断下列情况下溶液的pH。
①滴加NaOH溶液到完全反应少一滴(一滴溶液的体积是0.04mL),这时溶液的pH;
②完全反应后再多加一滴NaOH溶液时的pH;
(pH=4)
(pH=10)
一滴酸/碱引起的突变:
⑵
跟完全反应所需NaOH(20.00mL)溶液相比,若少(多)加一滴NaOH溶液,计算测得的盐酸的物质的量浓度是多少?
少加一滴时:c(HCl)=0.0998mol/L
跟实际浓度0.1000mol/L相比,误差很小。故可利用甲基橙或者酚酞的突变来判断滴定的终点
多加一滴时:c(HCl)=0.1002mol/L
结论:
⑴在滴定终点前后,溶液的pH发生突跃。
⑵酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果是可以达到足够的准确度。
∴
酸碱中和滴定是一个非常精确的定量实验。
三、实验步骤:
1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;
2、洗涤:用蒸馏水洗涤2-3次后,各用少量待装液润洗滴定管2-3次;
3、装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱式滴定管中,使液面高于“0”刻度2-3cm
4、赶气泡:
酸式滴定管:快速放液
碱式滴定管:橡皮管向上翘起
5、调液:
调节滴定管中液面高度,使液面等于或低于“0”刻度,并记下读数。
6、取液:
①从碱式滴定管中放出10.00ml氢氧化钠溶液于锥形瓶中
②滴入1-2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。
7、滴定:一手____________________,一手
________________________________________________
眼睛_______________________________________
控制酸式滴定管活塞
拿住锥形瓶瓶颈,
边滴入盐酸,边不断摇动锥形瓶,
要始终注视锥形瓶中溶液的颜色变化。
9、计算:整理数据进行计算。
8、记录:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
★四、误差分析:
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠
3、滴定管尖嘴处有气泡,滴定后气泡消失
4、滴定操作时,有少量HCl滴于锥形瓶外
5、滴定前仰视刻度,滴定后俯视刻度
偏高
偏高
偏高
偏高
偏低
滴定前仰视,滴定后俯视。
分析:V标偏小,导致C测偏小。
滴定前
滴定后
读出值
实际值
滴定前俯视,滴定后仰视。
分析:V标偏大,导致C测偏大。
滴定前
滴定后
实际值
读出值
二、锥形瓶
6、锥形瓶内用蒸馏水洗涤后,再用待测NaOH润洗2-3次,将润洗液倒掉,再装NaOH溶液
7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液
8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。
9、指示剂滴加过多。
偏高
无影响
偏低
偏高
三、碱式滴定管
10、碱式滴定管用水洗后,未用待测液润洗
11、取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液
偏低
偏低
四、含杂质
12、在配制待测NaOH溶液过程中,称取一定质量的氢氧化钠时,内含少量的KOH,用标准盐酸溶液进行滴定。
13、同上情况,若NaOH中含有少量的Na2CO3,结果如何
偏低
偏低
练一练
练习1:读出以下液体体积的读数
7
8
滴定管
10
8
量筒
7.47mL
9.1mL
练一练
练习2:有一支50mL的滴定管,其中盛有溶液,液面恰好在10mL刻度处,把滴定管中的液体全部流下排除,承接在量筒中,量筒中的溶液的体积(
)
A.大于40.0mL
B.等于40.0mL
C.小于40.0mL
D.等于10.0mL
A
P47
P48
双指示剂法(酚酞、甲基橙)测定NaOH、Na2CO3、
NaHCO3的含量
将固体配成溶液,先加入酚酞作指示剂,滴定至溶液由红色变成无色,消耗盐酸的体积为V1
,
然后加入甲基橙作指示剂,滴定至溶液由黄色变成橙色,消耗盐酸的体积为V2。
V1
、
V2大小关系
样品成分
V1=V2>0
V1>V2>0
V2>V1>0
V2>V1=0
V1>V2=0
Na2CO3
NaOH
Na2CO3
Na2CO3
NaHCO3
NaHCO3
NaOH
分析过程
第三章
水溶液中的离子平衡
第二节
水的电离和溶液的酸碱性
一、水的电离
H2O
+
H2O
H3O+
+
OH-
简写为:H2O
H+ +
OH-
(水电离出的H+、OH-浓度相等)
水是极弱的电解质
25℃
1L水只有10-7molH2O分子发生电离
多少个水分子才有1个电离?
5.56×108
K
电离=
c(H+)×c(OH-)
c(H2O)
K电离
.
=
c
(
H+)
.c(
OH-)
c(H2O)
Kw
=
c
(
H+)
.c(
OH-)
其中常数K与常数c(H2O)的积记为Kw,称为水的离子积常数,简称为离子积
H2O
H+ +
OH-
1、水的离子积常数
Kw
=c(H+)·c(OH-)
说明:1.常温(25℃
)Kw
=
1×
10-14
2.稀溶液
3.温度升高,
Kw变大
2、水的离子积(常数):
定义:在一定温度下,水(或稀溶液)中H+与OH-浓度的乘积,用Kw表示。
温度
0℃
20℃
25℃
50℃
90℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
3.8×10-13
1×10-12
问题与讨论
1、在水中加入强酸(HCl)后,水的离子积是否发生改变?
2、在水中加入强碱(NaOH)后,水的离子积是否发生改变?升温呢?
3、在酸碱溶液中,水电离出来的c(H+)和c(OH-)是否相等?
4、100℃时,水的离子积为10-12,求纯水中c(H+)为多少?
5、在酸溶液中水电离出来的c(H+)和酸电离出来的c(H+)
有什么关系?
二、影响水的电离平衡的因素
1、酸
2、碱
3、温度
抑制水的电离,Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大.
4、加入能消耗H+和OH-的物质
如:①Na、②Cu2+、③CH3COO-
三、溶液的酸、碱性跟c(H+)、c(OH-)的关系
1.重要规律:
在一定温度时,稀电解质溶液里c(H+)与c(OH-)的乘积是一个常数。
C(稀)
≤1mol/L
例:25℃时,Kw=1×10-14
100℃时,Kw=1×10-12
三、溶液的酸、碱性跟c(H+)、c(OH-)的关系
2.关系(25℃):
中性溶液:
酸性溶液:
碱性溶液:
注
意
①水溶液中H+与OH-始终共存
②酸性溶液:c(H+)>c(OH-)
;c(H+)越大酸性越强
③碱性溶液:c(H+)
c(H+)=c(OH-)=1×10-7mol/L
c(H+)>c(OH-)
c(H+)>1×10-7mol/L
c(H+)
(2)常温下,浓度为1×10-5mol/l的NaOH溶液中,由水电离产生的c(OH-)是多少?
思考1.(1)常温下,浓度为1×10-5mol/l的盐酸溶液中,由水电离产生的c(H+)是多少?
1×10-9mol/L
1×10-9mol/L
思考题:在常温下,由水电离产生的c(H+)=1×10-9
mol/L的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
思考2:10mL10-4mol/LHCl,加水至100mL,此时溶液中c(H+)=
mol/L;若加水至105mL,此时溶液中
c(H+)又是
10-5
接近10-7mol/L,略大于10-7mol/L
说明
①酸性溶液中c(H+),以酸所电离出的H+浓度为准,若酸过度稀释,c(H+)接近10-7mol/L,但略大于10-7mol/L
②碱性溶液中c(OH-),以碱所电离出的OH-浓度为准,若碱过度稀释,c(OH-)接近10-7mol/L,但略大于10-7mol/L
练习1、纯水在10℃和50℃的H+浓度,前者与后者的关系是
A.前者大
B.后者大
C.相等
D.无法确定
练习2、下列微粒中不能破坏水的电离平衡的是
A、H+
B、OH-
C、S2-
D、Na+
练习3、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是
A、CH3COONa
B、Na2SO4
C、NH4Cl
D、CH3COOH
练习4、某温度下纯水中C(H+)
=
2×10-7
mol/L,则此时溶液中的c(OH-)
=
___________。
若温度不变,滴入稀盐酸使C(H+)
=
5×10-6
mol/L,则此时溶液中的c(OH-)
=
___________。
B
D
A
2×10-7
mol/L
8×10-9
mol/L
练习5、在25
℃,在某无色溶液中由水电离出的c(OH-)=
1×10-13mol/L,一定能大量共存的离子组是
NH4+、K+、NO3-
、Cl-
B.NO3-、CO32-、K+、Na+
C.
K+、Na+、Cl-、SO42-
D.Mg2+、Cu2+、SO42-、
Cl-
C
练习6、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为Kw(25℃)=1×10-14,
Kw(35℃)
=2.1
×10-14。则下列叙述正确的是:
A、c(H+)随着温度的升高而降低
B、在35℃时,纯水中
c(H+)>c(OH-)
C、水的电离常数K(25℃)>K(35℃)
D、水的电离是一个吸热过程
D
练习8、
25℃、浓度均为0.1mol/L的下列溶液中C(H+)由大到小的排列顺序:①氨水
②NaOH
③盐酸
④醋酸
练习7、判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性)
,都存在Kw=10-14
。
③某温度下,某液体c(H+)=
10-7mol/L,则该溶液一定是纯水。
√
×
×
③>④
>
①
>
②
安陆一中化学组
第二节
水的电离和溶液的酸碱性
溶液pH的计算
二、溶液的酸碱性与pH值
1、定义:化学上常采用H+浓度的负对数来表示溶液的酸碱性。
3、溶液的酸碱性与pH值的关系
酸性溶液:
c(H+)>c(OH—)
pH<7
中性溶液:
c(H+)=c(OH—)
pH=7
碱性溶液:
c(H+)
2、表示方法:pH=-lg
c(H+)
pOH=-lg
c(OH—)
注意:
①溶液呈中性的标志是c(H+)=
c(OH-),此时pH不一定为7
②酸性越强,pH越小;碱性越强,pH越大。对于酸而言:pH减小一个单位,c(H+)就增大到原来的10倍,pH减小n个单位,c(H+)就增大到原来的10n倍。
③任意水溶液中c(H+)≠0,但pH可为0,此时c(H+)=1mol/L。一般,当c(H+)>1mol/L时,故直接用c(H+)表示。
有关溶液pH的计算
1、单一溶液的计算:
①强酸溶液:
如:0.1mol/L的HCl溶液,pH=1
一般而言对于强酸HnA,设浓度为c
mol/l,
则c(H+)=nc
mol/L,pH=-lgc(H+)=-lgnc
②强碱溶液:
如:0.1mol/L的NaOH溶液,pH=13
一般而言对于强碱B(OH)n,设浓度为c
mol/l,则c(H+)=10-14/nc
mol/L,pH=-lgc(H+)=14+lgnc
思考:
①已知弱酸HA的浓度为c
mol/L,电离度为α,则pH=
②已知弱碱BOH的浓度为c
mol/L,电离度为α,则pH=
-lgcα
14+lgcα
2、强酸、强碱的稀释:
例1、0.001
mol/L盐酸的pH
=____,加水稀释到原来体积的10倍,pH=___,加水到原来的103倍,pH
=___,加水到原来的104
倍pH=
__,加水到原来的106倍,pH=__
例2、pH=10的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____,pH=10的NaOH溶液加水稀释到原来的102倍,则溶液的pH=_______
3
4
6
9
8
②pH=6或8时,不可忽略水的电离,只能接近7,酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于7
结论:①强酸(碱)每稀释10倍,pH向7靠拢一个单位。
例3、pH=3HAc加水稀释到原来10倍,溶液的pH值范围________________;
pH=12氨水加水稀释到原来10倍,溶液的pH值范围________________。
?
结论:弱酸(碱)每稀释10倍,pH值向7靠拢不到一个单位
3、弱酸、弱碱的稀释
3—4之间
11—12之间
4、两种pH值不同的同种强酸(碱)溶液混合
例5、①pH=11和pH=9的两种NaOH溶液等体积混合,求混合溶液的pH值。
例4、①pH=3和pH=5的两种盐酸以2:1的体积比混合,求混合溶液的pH值
c(H+)=(10-3×2+10-5×1)/3=6.7×10-4mol/L
pH=3.2
c(OH-)=
(10-3+10-5)/2=5.05×10-4mol/L
c(H+)=2×10-11mol/L
pH=10.7
例6、①
pH=1盐酸和pH=12的NaOH溶液等体积混合,求
混合后溶液的pH值。
5、强酸、强碱溶液的混合
c(H+)=(10-1-10-2)/2=0.045mol/L
pH=1.35
②pH=4盐酸和pH=12的NaOH溶液等体积混合,求混合后溶液的pH值。
c(OH-)=
(10-2-10-4)/2=5×10-3mol/L
c(H+)=2×10-12mol/L
pH=11.7
pH=8和pH=10的两种NaOH溶液等体积混合后pH=9.7
错解:c(H+)=(10-8+10-10)/2=5.05×10-9mol/L
pH=8.3
pH=8
c(H+)=10-8mol/L
c(OH-)=10-6mol/L
pH=10
c(H+)=10-10mol/L
c(OH-)=10-4mol/L
c(H+)混=
(10-8+10-10)/2=5×10-9mol/L
c(OH-)混=(10-6+10-4)/2=5×10-5mol/L
c(H+)混×
c(OH-)混>Kw,平衡逆向移动
H2O
=
H+ +
OH-
5×10-9
5×10-5
5×10-9-x
5×10-5-x
∴(5×10-9-x)(5×10-5-x)=10-14
X<5×10-9
5×10-5
∴c(H+)=10-14÷(5×10-5)=2×10-10mol/L
平衡浓度
起始浓度
高考典型题型
pH=13的强碱和pH=2的强酸混合所得溶液的pH=11,则强碱与强酸的体积比为
1:9
设碱为XL,酸为1L,则
c(OH-)=
(10-1×x-10-2×1)/(x+1)=10-3mol/L
X=1/9
6、弱酸强碱或强酸弱碱混合
例7、
(1)pH为12的NaOH溶液和pH为2的醋酸溶液等体积相混合,则混合液呈_____性
(2)pH为12的氨水和pH为2
的盐酸等体积相混合,则混合液呈
____性
(3)pH为2的盐酸和pH为12
的某碱等体积相混合,则混合液pH_______
(4)pH为12的NaOH溶液和pH为2的某酸溶液等体积相混合,则混合液pH
_____
(5)pH为12的氨水和pH=2的醋酸溶液等体积混合,则混合液的pH_____。
酸
碱
≥7
≤7
比较α大小
1、某酸溶液的pH为2,某碱溶液的pH为12,两者等体积相混合后,有关pH值的变化正确的是
A、大于7
B、小于7
C、等于7
D、都有可能
2、常温下一种pH为2
的酸溶液与一种pH为12
的碱溶液等体积相混合,对溶液的酸碱性的说法正确的是
A、若是二元强酸和一元强碱,混合液为酸性
B、若是浓的强酸和稀的强碱,混合液中呈酸性
C、若是浓的弱酸和稀的强碱,混合液呈碱性
D、若是强酸和强碱相混合,溶液反应后呈中性
D
D
3、同体积的pH为3
的盐酸、硫酸、醋酸和硝酸四种溶液,分别加入足量的锌粉,叙述正确的是
A、硫酸溶液中放出的氢气的量最多
B、醋酸溶液中放出的氢气的量最多
C、盐酸和硝酸中放出的氢气的量相等
D、盐酸比硝酸放出的氢气的量多
BD
4、向体积均是1L,pH值也相等的盐酸和醋酸两溶液中加入表面积质量均相等的锌块,下列叙述正确的是
A、反应开始时,盐酸的速率比醋酸快
B、反应过程中,醋酸的速率比盐酸快
C、充分反应后,两者产生的氢气的体积可能相等
D、充分反应后,若有一种溶液中的锌有多余,则一定是盐酸的锌有余
BCD
5、酸HA、HB两溶液的pH值为3,且体积相同,加水稀释两溶液,pH值与加入水的体积关系如图所示,则两者酸性较强的是
加水体积
pH
HB
HA
HB
6、酸HA、HB、HC三溶液的物质的量浓度相同,体积也相同,测得它们的pH值分别为2、2.7、3,分别与足量的锌反应,产生的氢气的物质的量
,初始时,三者的反应速率
,若三种酸的体积与pH值均相等时,分别加入足量的表面积和质量均相等的锌,初始时,三者的反应速率
,反应过程中的平均速率
;充分反应后,产生的氢气的物质的量的大小关系
相同
相同
7、关于水的离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是
A、Kw和Kc都随温度的升高而减小
B、Kw和Kc的数值不同,但单位相同
C、Kw和Kc数值相同,但单位不同
D、Kw和Kc数值和单位都不同
D
8、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A、向水中投入一小块金属钠
B、将水加热煮沸
C、向水中通入CO2气体
D、向水中加入食盐晶体
C
9、pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是
A、盐酸>醋酸
B、醋酸>盐酸
C、盐酸=醋酸
D、无法判断
A
10、某次酸雨分析数据如下:c(NH4+)=2.0×10-5mol/L,c(Cl-)=6.0×10-5mol/L,
c(Na+)=1.9×10-5mol/L,
c(NO3-)=2.3×10-5mol/L,
c(SO42-)=5.6×10-5mol/L,则此次酸雨的pH大约为
A、3
B、4
C、5
D、6
B
11、两种不同浓度的NaOH溶液,c(H+)分别为
1×10-14mol/L和1×10-10mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是
A、1×(10-14+10-10)mol/L
B、0.5×(10-14+10-10)mol/L
C、2×10-10mol/L
D、2×10-14mol/L
D
12、有人建议用AG表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。下列表述正确的是
A、在25℃时,若溶液呈中性,则pH=7,AG=1
B、在25℃时,若溶液呈酸性,则pH<7,AG<0
C、在25℃时,若溶液呈碱性,则pH>7,AG<0
D、在25℃时,溶液的pH和AG的换算公式为:AG=14-2pH
CD
14、设某pH的硫酸中水电离出的c(H+)=
1.0×10-amol/L,设相同的pH的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。
、
。
13、在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为Amol/L与Bmol/L,则A与B的关系为
A
.A>B
B.A=10-4B
C.B=10-4A
D.A=B
B
a+b=14
a>b
安陆一中化学组
第二节
水的电离和溶液的酸碱性
第三课时
pH的应用
酸碱中和滴定
☆实验:酸碱中和滴定
1、定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2、原理:在酸碱中和反应中,用一种已知浓度的酸(或碱)溶液跟未知浓度的碱(或酸)溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。
3、公式:
4、实验的关键:
(1)准确测量参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全反应
c酸v酸=c碱v碱(一元酸和一元碱)
5、实验仪器
酸式滴定管、碱式滴定管、锥形瓶、
铁架台、滴定管夹、烧杯、白纸(有时还需要移液管)
☆滴定管的构造
1、滴定管是内径均匀、带有刻度的细长玻璃管,下端有控制液体流量的玻璃活塞(或由橡胶管和玻璃球组成的阀)
2、有“0”刻度,且小刻度在上。
3、精确度:0.01mL
滴定管的用途
滴定管主要用来精确地放出一定体积的液体。
☆滴定管的使用方法
a、检查仪器:使用前先检查滴定管活塞是否漏水
b、润洗仪器:在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗2—3遍。
c、加入反应液:分别将反应液加入到相应滴定管中,使液面位于滴定管刻度“0”以上2—3cm处。
d、调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,然后调节滴定管液面,使其处于某一刻度,准确读取数值并记录。
☆读数的方法:
←你能读得准吗?
25.60mL
思考1:酸式滴定管和碱式滴定管的结构有什么不同,为什么?盛放溶液时有何要求?
酸式滴定管:酸性溶液,强氧化性溶液
碱式滴定管:碱性溶液
思考2:如果滴定管下端尖嘴中有气泡存在,对实验结果有什么影响?如何除去气泡?
酸式滴定管:快速的打开玻璃塞,放出一小股液体
碱式滴定管:用手指挤压玻璃球,快速放出一小股液体
所需试剂
1、标准液
2、待测液
3、指示剂
a、酸碱中和滴定中通常用甲基橙和酚酞作指示剂,一般不用石蕊试液。
b、根据中和反应恰好完全反应时溶液的pH应在指示剂的变色范围之内,来选择指示剂。
c、选择指示剂时,滴定终点前后溶液颜色改变由浅到深,颜色变化对比明显。
2、酸碱指示剂:一般是有机弱酸或有机弱碱溶液(定性测定)
1、原则:
①终点时,指示剂的颜色变化须明显
②变色范围越窄越好,对溶液的酸碱性变化较灵敏
☆二、指示剂的选择:
种类
对应溶液的颜色
变色范围
甲基橙溶液
橙色
红3.1橙4.4黄
酚酞溶液
无色
无色8.2浅红10红
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多必将消耗一部分酸碱溶液(一般为1→2滴)。
a、强酸强碱间的滴定:
b、强酸滴定弱碱
两者正好完全反应,生成强酸弱碱盐,反应后溶液呈酸性选用甲基橙作指示剂
c、强碱滴定弱酸
3、酸碱中和滴定中指示剂的选择:
两者正好完全反应,生成强碱弱酸盐,反应后溶液呈碱性选用酚酞作指示剂
酚酞溶液、甲基橙
c、操作:用镊子取一小块pH试纸放在洁净的表面皿或玻璃片上,然后用玻璃棒沾取少量待测液点在试纸中央,试纸显色后再与标准比色卡比较,即知溶液的pH值。
4、pH试纸(定量测定)
a、成分:含有多种酸碱指示剂
b、本身颜色:淡黄色
d、种类:常用的pH试纸有广泛pH试纸和精密pH试纸,次外,还有用于酸性、中性或碱性溶液的专用pH试纸。
思考2:如何判断酸碱溶液恰好中和?
可用甲基橙或酚酞判断终点。
思考3:酸碱中和滴定选用酚酞或甲基橙作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
甲基橙:3.3—4.4
酚酞:8--10
练习:25℃在20.00mL
0.10mol/L的盐酸中,逐滴滴入0.10mol/L
NaOH溶液20.00mL。
⑴判断下列情况下溶液的pH。
①滴加NaOH溶液到完全反应少一滴(一滴溶液的体积是0.04mL),这时溶液的pH;
②完全反应后再多加一滴NaOH溶液时的pH;
(pH=4)
(pH=10)
一滴酸/碱引起的突变:
⑵
跟完全反应所需NaOH(20.00mL)溶液相比,若少(多)加一滴NaOH溶液,计算测得的盐酸的物质的量浓度是多少?
少加一滴时:c(HCl)=0.0998mol/L
跟实际浓度0.1000mol/L相比,误差很小。故可利用甲基橙或者酚酞的突变来判断滴定的终点
多加一滴时:c(HCl)=0.1002mol/L
结论:
⑴在滴定终点前后,溶液的pH发生突跃。
⑵酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果是可以达到足够的准确度。
∴
酸碱中和滴定是一个非常精确的定量实验。
三、实验步骤:
1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;
2、洗涤:用蒸馏水洗涤2-3次后,各用少量待装液润洗滴定管2-3次;
3、装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱式滴定管中,使液面高于“0”刻度2-3cm
4、赶气泡:
酸式滴定管:快速放液
碱式滴定管:橡皮管向上翘起
5、调液:
调节滴定管中液面高度,使液面等于或低于“0”刻度,并记下读数。
6、取液:
①从碱式滴定管中放出10.00ml氢氧化钠溶液于锥形瓶中
②滴入1-2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。
7、滴定:一手____________________,一手
________________________________________________
眼睛_______________________________________
控制酸式滴定管活塞
拿住锥形瓶瓶颈,
边滴入盐酸,边不断摇动锥形瓶,
要始终注视锥形瓶中溶液的颜色变化。
9、计算:整理数据进行计算。
8、记录:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
★四、误差分析:
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠
3、滴定管尖嘴处有气泡,滴定后气泡消失
4、滴定操作时,有少量HCl滴于锥形瓶外
5、滴定前仰视刻度,滴定后俯视刻度
偏高
偏高
偏高
偏高
偏低
滴定前仰视,滴定后俯视。
分析:V标偏小,导致C测偏小。
滴定前
滴定后
读出值
实际值
滴定前俯视,滴定后仰视。
分析:V标偏大,导致C测偏大。
滴定前
滴定后
实际值
读出值
二、锥形瓶
6、锥形瓶内用蒸馏水洗涤后,再用待测NaOH润洗2-3次,将润洗液倒掉,再装NaOH溶液
7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液
8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。
9、指示剂滴加过多。
偏高
无影响
偏低
偏高
三、碱式滴定管
10、碱式滴定管用水洗后,未用待测液润洗
11、取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液
偏低
偏低
四、含杂质
12、在配制待测NaOH溶液过程中,称取一定质量的氢氧化钠时,内含少量的KOH,用标准盐酸溶液进行滴定。
13、同上情况,若NaOH中含有少量的Na2CO3,结果如何
偏低
偏低
练一练
练习1:读出以下液体体积的读数
7
8
滴定管
10
8
量筒
7.47mL
9.1mL
练一练
练习2:有一支50mL的滴定管,其中盛有溶液,液面恰好在10mL刻度处,把滴定管中的液体全部流下排除,承接在量筒中,量筒中的溶液的体积(
)
A.大于40.0mL
B.等于40.0mL
C.小于40.0mL
D.等于10.0mL
A
P47
P48
双指示剂法(酚酞、甲基橙)测定NaOH、Na2CO3、
NaHCO3的含量
将固体配成溶液,先加入酚酞作指示剂,滴定至溶液由红色变成无色,消耗盐酸的体积为V1
,
然后加入甲基橙作指示剂,滴定至溶液由黄色变成橙色,消耗盐酸的体积为V2。
V1
、
V2大小关系
样品成分
V1=V2>0
V1>V2>0
V2>V1>0
V2>V1=0
V1>V2=0
Na2CO3
NaOH
Na2CO3
Na2CO3
NaHCO3
NaHCO3
NaOH
分析过程
