华师大版科学九年级上册 2.1 生活中的酸和碱 同步检测(含解析)
文档属性
| 名称 | 华师大版科学九年级上册 2.1 生活中的酸和碱 同步检测(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 71.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-11-30 15:20:33 | ||
图片预览




文档简介
2.1生活中的酸和碱-华东师大版九年级科学上册同步检测
一、选择题
1.下列变化中前者是化学变化,后者是物理变化的是( )
A.食盐溶于水,火药爆炸 B.镁带燃烧,铁生锈
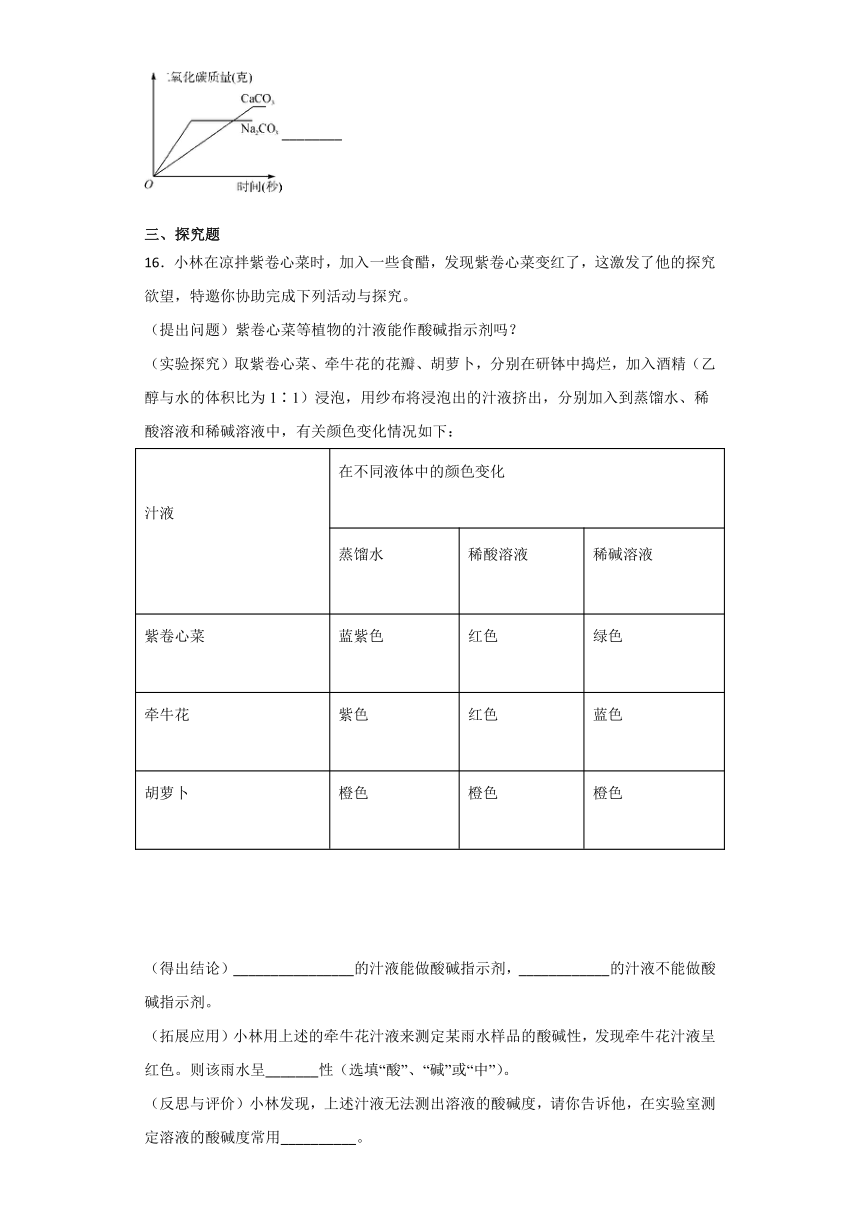
C.食物腐败,电灯发光 D.汽油挥发,酒精燃烧
2.将10克20%的稀硫酸和10克20%的氢氧化钾溶液混合后,加入指示剂,下列叙述中正确的是( )
A.紫色石蕊变红 B.石蕊不变色 C.无色酚酞变红 D.无法判断
3.(绍兴-12)除去下列物质中的少量杂质,所用试剂和方法正确的是( )
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A B.B C.C D.D
4.某些电子集成电路常用黄金镀膜。废旧电子产品上的黄金通过某种溶液的溶解后,加入某种金属,即可回收,对黄金在电子产品上的应用和回收过程,下列说法错误的是( )
A.集成电路用黄金镀膜可防止线路氧化
B.回收时往溶液中加入的金属可以选用铜
C.回收时溶解黄金的溶液不会是硫酸
D.回收时加入的金属与溶液发生了化合反应
5.下列说法不正确的是
A.pH越高,碱性越强
B.在食物链中,能量逐级递减
C.铜的导电性比铝强,铜导线的电阻比铝导线小
D.相同质量的实心铁块和铝块,铁块的体积小
6.土壤偏酸性,可用氢氧化钙溶液进行调节,要求此溶液具有适当的值,现有一氢氧化钙溶液偏高。下列方法中能确保达到目标的方法是( )
A.蒸发溶剂 B.加入碳酸钠
C.加入盐酸 D.用水稀释
7.下列实验能达到预期目的是( )
A.用稀硫酸与大理石反应制取二氧化碳气体
B.用铜,稀硫酸和氧气为原料制取硫酸铜
C.将酚酞试液滴入pH小于7的溶液中,使溶液显红色
D.二氧化碳气体中混有少量杂质氯化氢,将其通入氢氧化钠溶液中除去杂质
8.常温下,下列说法错误的是 ( )
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,酸性减弱
D.pH>10的土壤不适种植农作物,因为碱性太强
9.下列说法正确的是( )
①化学实验产生的废液应及时倒入下水道
②实验室的废酸或废碱可用中和法来处理
③如果酸流在实验桌上,立即用氢氧化钠溶液中和
A.① B.② C.③ D.①②
10.温州酸雨率居高不下。酸雨含有硫酸、硝酸等,下列建筑材料中,最不易受到酸雨侵蚀的是( )
A.大理石墙面 B.铜把手 C.铁艺门 D.铝合金窗
二、填空题
11.pH试纸测定的方法是:用洁净的_________蘸取被测试的溶液,滴在_________上,将试纸显示的颜色与____________对照,看与哪种颜色最接近,从而确定被测溶液的pH。根据pH便可判断溶液的酸碱性强弱。
12.生活中处处有化学,请用化学符号或化学式进行填空:
(1)供给人类呼吸的气体是______;
(2)最简单的有机物是______;
(3)形成酸雨的主要气体是______;
(4)中和土壤酸性的物质是______;
(5)地壳中含量最多的金属元素是______。
13.向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
12.9
12.7
12.5
12.3
11.9
7.0
2.1
1.9
(1)当加入稀盐酸的体积为________mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液显________色;当加入稀盐酸的体积为14 mL时,溶液显________色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有____________。
14.植物的生长需要营养元素,右图表示了土壤的pH和植物吸收这些元素的关系。
栅栏越宽,营养元素的吸收率越高。
(1)当pH=4时,在这种土壤中植物往往不能正常地生长,这是因为 。
(2)如果施用一种能使作物生长旺盛、茎杆粗壮、增强抗病虫害能力的肥料,当土壤的pH在 时,植物的吸收率较高。
15.在相同条件下,取质量相等的块状CaCO3和粉末状Na2CO3,分别与足量等质量分数的稀盐酸充分反应。根据实验测定:其中粉末状Na2CO3与稀盐酸反应产生CO2的质量随反应时间变化曲线如图所示。请在图中画出块状CaCO3与稀盐酸反应产生CO2的质量随反应时间变化大致曲线,并用科学原理加以解释。
________
三、探究题
16.小林在凉拌紫卷心菜时,加入一些食醋,发现紫卷心菜变红了,这激发了他的探究欲望,特邀你协助完成下列活动与探究。
(提出问题)紫卷心菜等植物的汁液能作酸碱指示剂吗?
(实验探究)取紫卷心菜、牵牛花的花瓣、胡萝卜,分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1∶1)浸泡,用纱布将浸泡出的汁液挤出,分别加入到蒸馏水、稀酸溶液和稀碱溶液中,有关颜色变化情况如下:
汁液
在不同液体中的颜色变化
蒸馏水
稀酸溶液
稀碱溶液
紫卷心菜
蓝紫色
红色
绿色
牵牛花
紫色
红色
蓝色
胡萝卜
橙色
橙色
橙色
(得出结论)________________的汁液能做酸碱指示剂,____________的汁液不能做酸碱指示剂。
(拓展应用)小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色。则该雨水呈_______性(选填“酸”、“碱”或“中”)。
(反思与评价)小林发现,上述汁液无法测出溶液的酸碱度,请你告诉他,在实验室测定溶液的酸碱度常用__________。
17.科学兴趣小组做了如下实验:将一镁条放入CuCl2溶液中,镁条表面覆盖了红色物质,但很快镁条表面又冒出很多气泡,他们觉得很奇怪。
(提出问题)这些气泡究竟是怎样产生的? 是什么气体呢?
(猜想)小科:是氧气;小丽:是氯化氢;小琪:是氨气(NH3);小梁:是氢气。小黄马上否定了小琪的猜想,他否定的依据是___________;
(实验探究)他们开始着手收集所产生的气体。
实验一:小科用带火星的木条检验该气体,木条不会复燃.说明生成的气体不是氧气;
实验二:为继续探究反应后生成的气体是否是氯化氢,小丽用湿润的蓝色石蕊试纸检验该气体,试纸不变红,说明生成的气体不是氯化氢;
实验三:为确定气体是否是氢气,小梁设计了如图的实验装置(每个装置的反应均完全)。
(实验结论)
(1)若该气体是氢气,则在乙装置中可以观察到的现象是___________。
(2)甲、丙装置中无水硫酸铜的作用是不同的,请指出它们的区别_____________。
(3)为确定该气体产生的本质原因,小梁用精密pH试纸测试实验所用的CuCl2溶液,pH约为5.5,最后确定CuCl2溶液呈酸性.查阅资料发现:CuCl2为强酸弱碱盐,其水溶液酸碱性与实验结果相符。
四、简答题
18.已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
第1次
第2次
第3次
第4次
加入氢氧化钠溶液的质量/g
25
25
25
25
生成沉淀的质量/g
2.9
x
8.7
8.7
(1)表中x = 。
(2)样品中氯化镁的质量分数是 。
(3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量分数的氢氧化钠溶液,还需加入水的质量是多少?
参考答案
1.C
【解析】
A、食盐溶于水过程中没有新物质生成,属于物理变化;火药爆炸过程中有新物质二氧化碳等生成,属于化学变化.
B、镁带燃烧,铁生锈过程中都有新物质生成,都属于化学变化.
C、食物腐败过程中有新物质生成,属于化学变化;电灯发光过程中没有新物质生成,属于物理变化.
D、汽油挥发过程中只是状态发生改变,没有新物质生成,属于物理变化;酒精燃烧过程中有新物质二氧化碳等生成,属于化学变化.
故选C.
【点评】本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.
2.A
【详解】
设与氢氧化钾反应的硫酸的质量为x,
x=1.75g,
剩余的硫酸质量为:10g×20%-1.75g=0.25g,即稀盐酸过量,溶液显酸性,能使石蕊试液变红色。
故选A。
3.D
【详解】
试题分析:A.盐酸与杂质碳酸钠反应生成氯化钠,引入新杂质,选项错误;B.硝酸钡与杂质硫酸钾反应生成硝酸钠新杂质,选项错误;C.通过灼热的氧化铜粉末,一氧化碳能与氧化铜反应生成二氧化碳,得不到一氧化碳,并且不能除去二氧化碳,选项错误;D.杂质氯化氢能与氢氧化钠反应生成水,先通过NaOH溶液能除去氯化氢,浓硫酸具有吸水性,再通过浓硫酸能除去水得到纯净的氢气,选项正确;故选D
考点: 除杂
4.D
【解析】
【详解】
A、金在金属活动性顺序表中排在最后面,活动性很差,在空气中不能被氧化,所以A不符合题意;
B、在金属活动性顺序表中铜排在金前面,所以,铜可以把金从它的盐溶液中置换出来,所以B不符合题意;
C、金在金属活动性顺序表中排在氢后面,金不会溶于稀硫酸,所以C不符合题意;
D、制取金属金的单质,说明回收时加入的金属与溶液发生了置换反应,所以D符合题意。
故选D。
5.C
【详解】
A.pH越大溶液的酸性越弱,碱性越强,故A正确不符合题意;
B. 生态系统中的能量传递的特点是单向流动、逐级递减,故B正确不符合题意;
C.电阻大小的决定因素有四个,这儿只告诉了两导体材料的关系,而导体的横截面积、长度和温度关系没告诉,故不能确定两者电阻大小。故C错误符合题意;
D. 已知实心的铝块和铁块质量相同,ρ铝<ρ铁,由公式V=知,铝块体积大。故D正确不符合题意。
6.D
【分析】
pH大于7,溶液显碱性,pH值越大,碱性越强。
【详解】
A、蒸发溶剂时,氢氧化钙溶液的浓度变大,使溶液的碱性更强,故A不正确;
B、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠显强碱性,故B不正确;
C、氢氧化钙和盐酸反应生成氯化钙和水,加入的盐酸能使溶液pH值降低,但是却降低了氢氧化钙含量,降低效果,增加成本,故C不正确;
D、氢氧化钙溶液加入水稀释时,溶液的碱性减弱,pH始终大于7,故D正确。故选D。
7.B
【解析】
【分析】
除杂要求:不引入新的杂质,加入的试剂不和原物质反应,金属活动性顺序表中,活动性排在氢前面的金属能和酸反应。
【详解】
A、实验室用稀盐酸与大理石反应制取CO2,用硫酸会因为生成硫酸钙阻碍反应的发生,故A不正确;
B、铜的活动性排在氢的后面不会与硫酸反应生成硫酸铜,但把铜加热会生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,故B正确;
C、能使酚酞变红色的溶液是碱性溶液,而pH小于7的溶液显酸性,故C不正确;
D、氢氧化钠溶液除去二氧化碳中混有的氯化氢气体,不能达到目的,因为这两种气体都能和氢氧化钠溶液反应,会把原物质也除去,故D不正确。故选B。
8.C
【详解】
【详解】A、pH小于7的溶液显酸性,所以pH=2的溶液显酸性,选项正确;
B、pH=7的溶液显中性,选项正确;
C、酸性越强,溶液的pH越小,溶液的pH由5变成2,则溶液的酸性增强,选项错误;
D、农作物在中性土壤中生长较好,pH>10的土壤不适种植农作物,因为碱性太强,选项正确,故选C。
9.B
【详解】
①化学实验产生的废液,可能会污染环境、腐蚀下水道,不能倒入下水道,故选项说法错误。
②实验室的废酸或废碱,可利用中和反应,用中和法来处理,故选项说法正确。
③如果酸流在实验桌上,不能立即用氢氧化钠溶液中和,因为氢氧化钠溶液具有腐蚀性,故选项说法错误。
故选B。
10.B
【分析】
酸雨是指pH小于5.6的雨雪或其他形式的降水,酸雨分为硝酸型酸雨和硫酸型酸雨。
【详解】
A、大理石的主要成分是碳酸钙,能和硫酸、硝酸反应,会受到腐蚀,故A不正确;
B、铜不和硫酸、硝酸反应,不易被腐蚀,故B正确;
C、铁和硫酸、硝酸反应,会受到腐蚀,故C不正确;
D、铝合金里面含有铝,会和硫酸、硝酸反应,会受到腐蚀,故D不正确。故选B。
11.玻璃棒 pH试纸 标准比色卡
【详解】
pH试纸测定的方法是:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH。根据pH便可判断溶液的酸碱性强弱。
12.(1)O2;(2)CH4;(3)SO2;(4)Ca(OH)2;(5)Al。
【详解】
(1)氧气可供给呼吸
(2)最简单的有机物为甲烷
(3)形成酸雨的主要气体为二氧化硫
(4)氢氧化钙常用来中和酸性土壤
(5)地壳中含量最多的金属元素为铝
13.(1)10 (2)红 无 (3)NaCl和HCl。
【解析】(1)pH=7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的氢氧化钠溶液的体积为10 mL。
(2)无色酚酞遇碱性溶液变红色,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3 mL时,烧杯中溶液的pH大于7,溶液显碱性,能使无色酚酞溶液变红;
(3)当pH=2.1时,稀盐酸过量,这时溶液中的溶质既有生成的氯化钠,又有未反应的盐酸。
14.(1)栅栏最窄,营养元素的吸收率最低 (2)6-8之间均可
【分析】
(1)根据土壤的pH和植物吸收营养元素的关系。栅栏越宽,营养元素的吸收率越高,进行解答。
(2)根据(氮浓绿,余两抗)能使作物根系发达、耐寒耐旱的肥料是K,P,依据题意图示的信息解答。
【详解】
(1)根据土壤的pH和植物吸收营养元素的关系。栅栏越宽,营养元素的吸收率越高,当pH=4时,土壤显 酸性,在这种土壤中植物往往不能正常生长,这是因为:因为土壤酸性较强时,氮、磷、钾元素的吸收率低。
(2)根据(氮浓绿,余两抗)能使作物根系发达、耐寒耐旱的肥料是K,P,当土壤的pH在6~8时,植物的吸收率较高。
【点睛】
土壤酸碱性影响农作物营养元素的吸收,在中性或接近中性时作物吸收营养元素的吸收率最高。
15.①其他条件均相同,因固体表面积越大反应速率越快,故块状CaCO3的表面积比粉末状Na2CO3的表面积小,反应速率比Na2CO3与稀盐酸的反应慢;②CaCO3+2HCl===CaCl2+H2O+CO2↑的反应中CaCO3与CO2的质量比为100∶44;Na2CO3+2HCl===2NaCl+H2O+CO2↑的反应中Na2CO3与CO2的质量比为106∶44,所以相同质量的CaCO3比Na2CO3与足量的稀盐酸完全反应产生的CO2多,折点高。
【详解】
①其他条件均相同,反应物接触面积更大,更利于反应的进行,反应速率更大。因固体表面积越大反应速率越快,故块状CaCO3的表面积比粉末状Na2CO3的表面积小,反应速率比Na2CO3与稀盐酸的反应慢,反应在图像上形成图像直线的斜率更大;②CaCO3+2HCl===CaCl2+H2O+CO2↑的反应中CaCO3与CO2的质量比为100∶44;Na2CO3+2HCl===2NaCl+H2O+CO2↑的反应中Na2CO3与CO2的质量比为106∶44,所以相同质量的CaCO3比Na2CO3与足量的稀盐酸完全反应产生的CO2多,表现在图像上即为转折点高。
【点睛】
其他条件均相同,反应物接触面积更大,更利于反应的进行,反应速率更大。
16.紫卷心菜 牵牛花 酸 pH试纸
【详解】
[得出结论]遇酸性溶液或碱性溶液能出现很明显的不同颜色的物质可做酸碱指示剂,根据以上实验可知,紫卷心菜的汁液能做酸碱指示剂,胡萝卜遇酸性溶液或碱性溶液颜色不变,故胡萝卜的汁液不能做酸碱指示剂。
[拓展应用] 小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色,则说明该雨水呈酸性。
[反思与评价],在实验室测定溶液的酸碱度常用pH试纸。
17.根据质量守恒定律或反应物中没有N元素 黑色粉末变红 甲是除去原气体中的水蒸气,丙是检验是否有水生成
【分析】
科学探究题,按照科学探究的步骤进行,发现并提出问题,提出猜想,设计实验方案进行验证,实施实验,观察记录现象,分析实验现象,得出结论,反思交流。依照步骤进行,解答此类题要弄清探究的步骤、原理、操作的要点和所涉及的基本化学知识,本题主要涉及的是氢气的检验方法,即干燥的氢气通过灼热的氧化铜固体,黑色粉末变成红色,并生成使无水硫酸铜变成蓝色的水。
【详解】
四位同学分别提出了自己的猜想,小科:是氧气;小丽:是氯化氢;小琪:是氨气(NH3);小梁:是氢气。小黄马上否定了小琪的猜想,因为根据质量守恒定律,反应物涉及的物质有镁条和CuCl2溶液,没有含有N元素的物质,不可能生成氨气(NH3);
实验三为了确定该气体是氢气,在检验氢气的实验中,按照如图的实验装置,甲装置的作用是吸收氢气中的水蒸气,乙和丙装置是利用氢气还原氧化铜、并验证产物中有水来说明气体是氢气,乙装置中发生的化学反应为,产生的水蒸气进入丙装置,白色无水硫酸铜粉末吸收水蒸气变成蓝色,证明有水生成,确定该气体是氢气。根据上述分析,我们可以知道:
(1)若该气体是氢气,则在乙装置中可以观察到的现象是黑色粉末变成红色;
(2)甲、丙装置中无水硫酸铜的作用是不同的,甲是除去原气体中的水蒸气,丙是检验是否有水生成。
18.(1)5.8 (2)95% (3)70g
【详解】
(1)第一次实验产生2.9g沉淀,第三次实验共产生8.7g沉淀,2.9g×3=8.7g,根据实验数据可知,25g氢氧化钠溶液与足量氯化镁反应生成2.9g沉淀,故第二次实验后产生沉淀的质量为2.9g×2=5.8g
(2)根据实验数据可知,该实验过程中共产生8.7g氢氧化镁沉淀,第三次实验是恰好反应,设样品中氯化镁的质量为x,参加反应的氢氧化钠的质量为y。
,解得x=14.25g,y=12g
样品中氯化镁的质量分数为:=95%
(3)该实验中氢氧化钠溶液的溶质质量分数为:=16%,溶液稀释前后溶质的质量相等,设需加入水的质量是z,则80g×30%=(80g+z)×16%,解得z=70g
答:(1)表中x =5.8。
(2)样品中氯化镁的质量分数是95%。
(3)还需加入水的质量是70g。
一、选择题
1.下列变化中前者是化学变化,后者是物理变化的是( )
A.食盐溶于水,火药爆炸 B.镁带燃烧,铁生锈
C.食物腐败,电灯发光 D.汽油挥发,酒精燃烧
2.将10克20%的稀硫酸和10克20%的氢氧化钾溶液混合后,加入指示剂,下列叙述中正确的是( )
A.紫色石蕊变红 B.石蕊不变色 C.无色酚酞变红 D.无法判断
3.(绍兴-12)除去下列物质中的少量杂质,所用试剂和方法正确的是( )
选项
物质
杂质
试剂和方法
A
NaNO3
Na2CO3
滴入足量稀盐酸至不再产生气泡
B
KCl
K2SO4
滴入适量Ba(NO3)2溶液、过滤
C
CO
CO2
通过灼热的氧化铜粉末
D
H2
HCl
先通过NaOH溶液,再通过浓硫酸
A.A B.B C.C D.D
4.某些电子集成电路常用黄金镀膜。废旧电子产品上的黄金通过某种溶液的溶解后,加入某种金属,即可回收,对黄金在电子产品上的应用和回收过程,下列说法错误的是( )
A.集成电路用黄金镀膜可防止线路氧化
B.回收时往溶液中加入的金属可以选用铜
C.回收时溶解黄金的溶液不会是硫酸
D.回收时加入的金属与溶液发生了化合反应
5.下列说法不正确的是
A.pH越高,碱性越强
B.在食物链中,能量逐级递减
C.铜的导电性比铝强,铜导线的电阻比铝导线小
D.相同质量的实心铁块和铝块,铁块的体积小
6.土壤偏酸性,可用氢氧化钙溶液进行调节,要求此溶液具有适当的值,现有一氢氧化钙溶液偏高。下列方法中能确保达到目标的方法是( )
A.蒸发溶剂 B.加入碳酸钠
C.加入盐酸 D.用水稀释
7.下列实验能达到预期目的是( )
A.用稀硫酸与大理石反应制取二氧化碳气体
B.用铜,稀硫酸和氧气为原料制取硫酸铜
C.将酚酞试液滴入pH小于7的溶液中,使溶液显红色
D.二氧化碳气体中混有少量杂质氯化氢,将其通入氢氧化钠溶液中除去杂质
8.常温下,下列说法错误的是 ( )
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,酸性减弱
D.pH>10的土壤不适种植农作物,因为碱性太强
9.下列说法正确的是( )
①化学实验产生的废液应及时倒入下水道
②实验室的废酸或废碱可用中和法来处理
③如果酸流在实验桌上,立即用氢氧化钠溶液中和
A.① B.② C.③ D.①②
10.温州酸雨率居高不下。酸雨含有硫酸、硝酸等,下列建筑材料中,最不易受到酸雨侵蚀的是( )
A.大理石墙面 B.铜把手 C.铁艺门 D.铝合金窗
二、填空题
11.pH试纸测定的方法是:用洁净的_________蘸取被测试的溶液,滴在_________上,将试纸显示的颜色与____________对照,看与哪种颜色最接近,从而确定被测溶液的pH。根据pH便可判断溶液的酸碱性强弱。
12.生活中处处有化学,请用化学符号或化学式进行填空:
(1)供给人类呼吸的气体是______;
(2)最简单的有机物是______;
(3)形成酸雨的主要气体是______;
(4)中和土壤酸性的物质是______;
(5)地壳中含量最多的金属元素是______。
13.向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
12.9
12.7
12.5
12.3
11.9
7.0
2.1
1.9
(1)当加入稀盐酸的体积为________mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液显________色;当加入稀盐酸的体积为14 mL时,溶液显________色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有____________。
14.植物的生长需要营养元素,右图表示了土壤的pH和植物吸收这些元素的关系。
栅栏越宽,营养元素的吸收率越高。
(1)当pH=4时,在这种土壤中植物往往不能正常地生长,这是因为 。
(2)如果施用一种能使作物生长旺盛、茎杆粗壮、增强抗病虫害能力的肥料,当土壤的pH在 时,植物的吸收率较高。
15.在相同条件下,取质量相等的块状CaCO3和粉末状Na2CO3,分别与足量等质量分数的稀盐酸充分反应。根据实验测定:其中粉末状Na2CO3与稀盐酸反应产生CO2的质量随反应时间变化曲线如图所示。请在图中画出块状CaCO3与稀盐酸反应产生CO2的质量随反应时间变化大致曲线,并用科学原理加以解释。
________
三、探究题
16.小林在凉拌紫卷心菜时,加入一些食醋,发现紫卷心菜变红了,这激发了他的探究欲望,特邀你协助完成下列活动与探究。
(提出问题)紫卷心菜等植物的汁液能作酸碱指示剂吗?
(实验探究)取紫卷心菜、牵牛花的花瓣、胡萝卜,分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1∶1)浸泡,用纱布将浸泡出的汁液挤出,分别加入到蒸馏水、稀酸溶液和稀碱溶液中,有关颜色变化情况如下:
汁液
在不同液体中的颜色变化
蒸馏水
稀酸溶液
稀碱溶液
紫卷心菜
蓝紫色
红色
绿色
牵牛花
紫色
红色
蓝色
胡萝卜
橙色
橙色
橙色
(得出结论)________________的汁液能做酸碱指示剂,____________的汁液不能做酸碱指示剂。
(拓展应用)小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色。则该雨水呈_______性(选填“酸”、“碱”或“中”)。
(反思与评价)小林发现,上述汁液无法测出溶液的酸碱度,请你告诉他,在实验室测定溶液的酸碱度常用__________。
17.科学兴趣小组做了如下实验:将一镁条放入CuCl2溶液中,镁条表面覆盖了红色物质,但很快镁条表面又冒出很多气泡,他们觉得很奇怪。
(提出问题)这些气泡究竟是怎样产生的? 是什么气体呢?
(猜想)小科:是氧气;小丽:是氯化氢;小琪:是氨气(NH3);小梁:是氢气。小黄马上否定了小琪的猜想,他否定的依据是___________;
(实验探究)他们开始着手收集所产生的气体。
实验一:小科用带火星的木条检验该气体,木条不会复燃.说明生成的气体不是氧气;
实验二:为继续探究反应后生成的气体是否是氯化氢,小丽用湿润的蓝色石蕊试纸检验该气体,试纸不变红,说明生成的气体不是氯化氢;
实验三:为确定气体是否是氢气,小梁设计了如图的实验装置(每个装置的反应均完全)。
(实验结论)
(1)若该气体是氢气,则在乙装置中可以观察到的现象是___________。
(2)甲、丙装置中无水硫酸铜的作用是不同的,请指出它们的区别_____________。
(3)为确定该气体产生的本质原因,小梁用精密pH试纸测试实验所用的CuCl2溶液,pH约为5.5,最后确定CuCl2溶液呈酸性.查阅资料发现:CuCl2为强酸弱碱盐,其水溶液酸碱性与实验结果相符。
四、简答题
18.已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
第1次
第2次
第3次
第4次
加入氢氧化钠溶液的质量/g
25
25
25
25
生成沉淀的质量/g
2.9
x
8.7
8.7
(1)表中x = 。
(2)样品中氯化镁的质量分数是 。
(3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量分数的氢氧化钠溶液,还需加入水的质量是多少?
参考答案
1.C
【解析】
A、食盐溶于水过程中没有新物质生成,属于物理变化;火药爆炸过程中有新物质二氧化碳等生成,属于化学变化.
B、镁带燃烧,铁生锈过程中都有新物质生成,都属于化学变化.
C、食物腐败过程中有新物质生成,属于化学变化;电灯发光过程中没有新物质生成,属于物理变化.
D、汽油挥发过程中只是状态发生改变,没有新物质生成,属于物理变化;酒精燃烧过程中有新物质二氧化碳等生成,属于化学变化.
故选C.
【点评】本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.
2.A
【详解】
设与氢氧化钾反应的硫酸的质量为x,
x=1.75g,
剩余的硫酸质量为:10g×20%-1.75g=0.25g,即稀盐酸过量,溶液显酸性,能使石蕊试液变红色。
故选A。
3.D
【详解】
试题分析:A.盐酸与杂质碳酸钠反应生成氯化钠,引入新杂质,选项错误;B.硝酸钡与杂质硫酸钾反应生成硝酸钠新杂质,选项错误;C.通过灼热的氧化铜粉末,一氧化碳能与氧化铜反应生成二氧化碳,得不到一氧化碳,并且不能除去二氧化碳,选项错误;D.杂质氯化氢能与氢氧化钠反应生成水,先通过NaOH溶液能除去氯化氢,浓硫酸具有吸水性,再通过浓硫酸能除去水得到纯净的氢气,选项正确;故选D
考点: 除杂
4.D
【解析】
【详解】
A、金在金属活动性顺序表中排在最后面,活动性很差,在空气中不能被氧化,所以A不符合题意;
B、在金属活动性顺序表中铜排在金前面,所以,铜可以把金从它的盐溶液中置换出来,所以B不符合题意;
C、金在金属活动性顺序表中排在氢后面,金不会溶于稀硫酸,所以C不符合题意;
D、制取金属金的单质,说明回收时加入的金属与溶液发生了置换反应,所以D符合题意。
故选D。
5.C
【详解】
A.pH越大溶液的酸性越弱,碱性越强,故A正确不符合题意;
B. 生态系统中的能量传递的特点是单向流动、逐级递减,故B正确不符合题意;
C.电阻大小的决定因素有四个,这儿只告诉了两导体材料的关系,而导体的横截面积、长度和温度关系没告诉,故不能确定两者电阻大小。故C错误符合题意;
D. 已知实心的铝块和铁块质量相同,ρ铝<ρ铁,由公式V=知,铝块体积大。故D正确不符合题意。
6.D
【分析】
pH大于7,溶液显碱性,pH值越大,碱性越强。
【详解】
A、蒸发溶剂时,氢氧化钙溶液的浓度变大,使溶液的碱性更强,故A不正确;
B、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠显强碱性,故B不正确;
C、氢氧化钙和盐酸反应生成氯化钙和水,加入的盐酸能使溶液pH值降低,但是却降低了氢氧化钙含量,降低效果,增加成本,故C不正确;
D、氢氧化钙溶液加入水稀释时,溶液的碱性减弱,pH始终大于7,故D正确。故选D。
7.B
【解析】
【分析】
除杂要求:不引入新的杂质,加入的试剂不和原物质反应,金属活动性顺序表中,活动性排在氢前面的金属能和酸反应。
【详解】
A、实验室用稀盐酸与大理石反应制取CO2,用硫酸会因为生成硫酸钙阻碍反应的发生,故A不正确;
B、铜的活动性排在氢的后面不会与硫酸反应生成硫酸铜,但把铜加热会生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,故B正确;
C、能使酚酞变红色的溶液是碱性溶液,而pH小于7的溶液显酸性,故C不正确;
D、氢氧化钠溶液除去二氧化碳中混有的氯化氢气体,不能达到目的,因为这两种气体都能和氢氧化钠溶液反应,会把原物质也除去,故D不正确。故选B。
8.C
【详解】
【详解】A、pH小于7的溶液显酸性,所以pH=2的溶液显酸性,选项正确;
B、pH=7的溶液显中性,选项正确;
C、酸性越强,溶液的pH越小,溶液的pH由5变成2,则溶液的酸性增强,选项错误;
D、农作物在中性土壤中生长较好,pH>10的土壤不适种植农作物,因为碱性太强,选项正确,故选C。
9.B
【详解】
①化学实验产生的废液,可能会污染环境、腐蚀下水道,不能倒入下水道,故选项说法错误。
②实验室的废酸或废碱,可利用中和反应,用中和法来处理,故选项说法正确。
③如果酸流在实验桌上,不能立即用氢氧化钠溶液中和,因为氢氧化钠溶液具有腐蚀性,故选项说法错误。
故选B。
10.B
【分析】
酸雨是指pH小于5.6的雨雪或其他形式的降水,酸雨分为硝酸型酸雨和硫酸型酸雨。
【详解】
A、大理石的主要成分是碳酸钙,能和硫酸、硝酸反应,会受到腐蚀,故A不正确;
B、铜不和硫酸、硝酸反应,不易被腐蚀,故B正确;
C、铁和硫酸、硝酸反应,会受到腐蚀,故C不正确;
D、铝合金里面含有铝,会和硫酸、硝酸反应,会受到腐蚀,故D不正确。故选B。
11.玻璃棒 pH试纸 标准比色卡
【详解】
pH试纸测定的方法是:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH。根据pH便可判断溶液的酸碱性强弱。
12.(1)O2;(2)CH4;(3)SO2;(4)Ca(OH)2;(5)Al。
【详解】
(1)氧气可供给呼吸
(2)最简单的有机物为甲烷
(3)形成酸雨的主要气体为二氧化硫
(4)氢氧化钙常用来中和酸性土壤
(5)地壳中含量最多的金属元素为铝
13.(1)10 (2)红 无 (3)NaCl和HCl。
【解析】(1)pH=7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的氢氧化钠溶液的体积为10 mL。
(2)无色酚酞遇碱性溶液变红色,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3 mL时,烧杯中溶液的pH大于7,溶液显碱性,能使无色酚酞溶液变红;
(3)当pH=2.1时,稀盐酸过量,这时溶液中的溶质既有生成的氯化钠,又有未反应的盐酸。
14.(1)栅栏最窄,营养元素的吸收率最低 (2)6-8之间均可
【分析】
(1)根据土壤的pH和植物吸收营养元素的关系。栅栏越宽,营养元素的吸收率越高,进行解答。
(2)根据(氮浓绿,余两抗)能使作物根系发达、耐寒耐旱的肥料是K,P,依据题意图示的信息解答。
【详解】
(1)根据土壤的pH和植物吸收营养元素的关系。栅栏越宽,营养元素的吸收率越高,当pH=4时,土壤显 酸性,在这种土壤中植物往往不能正常生长,这是因为:因为土壤酸性较强时,氮、磷、钾元素的吸收率低。
(2)根据(氮浓绿,余两抗)能使作物根系发达、耐寒耐旱的肥料是K,P,当土壤的pH在6~8时,植物的吸收率较高。
【点睛】
土壤酸碱性影响农作物营养元素的吸收,在中性或接近中性时作物吸收营养元素的吸收率最高。
15.①其他条件均相同,因固体表面积越大反应速率越快,故块状CaCO3的表面积比粉末状Na2CO3的表面积小,反应速率比Na2CO3与稀盐酸的反应慢;②CaCO3+2HCl===CaCl2+H2O+CO2↑的反应中CaCO3与CO2的质量比为100∶44;Na2CO3+2HCl===2NaCl+H2O+CO2↑的反应中Na2CO3与CO2的质量比为106∶44,所以相同质量的CaCO3比Na2CO3与足量的稀盐酸完全反应产生的CO2多,折点高。
【详解】
①其他条件均相同,反应物接触面积更大,更利于反应的进行,反应速率更大。因固体表面积越大反应速率越快,故块状CaCO3的表面积比粉末状Na2CO3的表面积小,反应速率比Na2CO3与稀盐酸的反应慢,反应在图像上形成图像直线的斜率更大;②CaCO3+2HCl===CaCl2+H2O+CO2↑的反应中CaCO3与CO2的质量比为100∶44;Na2CO3+2HCl===2NaCl+H2O+CO2↑的反应中Na2CO3与CO2的质量比为106∶44,所以相同质量的CaCO3比Na2CO3与足量的稀盐酸完全反应产生的CO2多,表现在图像上即为转折点高。
【点睛】
其他条件均相同,反应物接触面积更大,更利于反应的进行,反应速率更大。
16.紫卷心菜 牵牛花 酸 pH试纸
【详解】
[得出结论]遇酸性溶液或碱性溶液能出现很明显的不同颜色的物质可做酸碱指示剂,根据以上实验可知,紫卷心菜的汁液能做酸碱指示剂,胡萝卜遇酸性溶液或碱性溶液颜色不变,故胡萝卜的汁液不能做酸碱指示剂。
[拓展应用] 小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色,则说明该雨水呈酸性。
[反思与评价],在实验室测定溶液的酸碱度常用pH试纸。
17.根据质量守恒定律或反应物中没有N元素 黑色粉末变红 甲是除去原气体中的水蒸气,丙是检验是否有水生成
【分析】
科学探究题,按照科学探究的步骤进行,发现并提出问题,提出猜想,设计实验方案进行验证,实施实验,观察记录现象,分析实验现象,得出结论,反思交流。依照步骤进行,解答此类题要弄清探究的步骤、原理、操作的要点和所涉及的基本化学知识,本题主要涉及的是氢气的检验方法,即干燥的氢气通过灼热的氧化铜固体,黑色粉末变成红色,并生成使无水硫酸铜变成蓝色的水。
【详解】
四位同学分别提出了自己的猜想,小科:是氧气;小丽:是氯化氢;小琪:是氨气(NH3);小梁:是氢气。小黄马上否定了小琪的猜想,因为根据质量守恒定律,反应物涉及的物质有镁条和CuCl2溶液,没有含有N元素的物质,不可能生成氨气(NH3);
实验三为了确定该气体是氢气,在检验氢气的实验中,按照如图的实验装置,甲装置的作用是吸收氢气中的水蒸气,乙和丙装置是利用氢气还原氧化铜、并验证产物中有水来说明气体是氢气,乙装置中发生的化学反应为,产生的水蒸气进入丙装置,白色无水硫酸铜粉末吸收水蒸气变成蓝色,证明有水生成,确定该气体是氢气。根据上述分析,我们可以知道:
(1)若该气体是氢气,则在乙装置中可以观察到的现象是黑色粉末变成红色;
(2)甲、丙装置中无水硫酸铜的作用是不同的,甲是除去原气体中的水蒸气,丙是检验是否有水生成。
18.(1)5.8 (2)95% (3)70g
【详解】
(1)第一次实验产生2.9g沉淀,第三次实验共产生8.7g沉淀,2.9g×3=8.7g,根据实验数据可知,25g氢氧化钠溶液与足量氯化镁反应生成2.9g沉淀,故第二次实验后产生沉淀的质量为2.9g×2=5.8g
(2)根据实验数据可知,该实验过程中共产生8.7g氢氧化镁沉淀,第三次实验是恰好反应,设样品中氯化镁的质量为x,参加反应的氢氧化钠的质量为y。
,解得x=14.25g,y=12g
样品中氯化镁的质量分数为:=95%
(3)该实验中氢氧化钠溶液的溶质质量分数为:=16%,溶液稀释前后溶质的质量相等,设需加入水的质量是z,则80g×30%=(80g+z)×16%,解得z=70g
答:(1)表中x =5.8。
(2)样品中氯化镁的质量分数是95%。
(3)还需加入水的质量是70g。
