构成物质的基本微粒(3)离子
图片预览




文档简介
(共24张PPT)
构成物质的基本微粒
离子
原子是由居于( )的带( )的( )和核外带( )的( )构成的。由于原子核和核外电子的( )相等,( )相反,所以原子( )。
原子的质量主要集中在( )上,
电子在原子核外的空间作( )
电子在核外的空间里做高速的运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
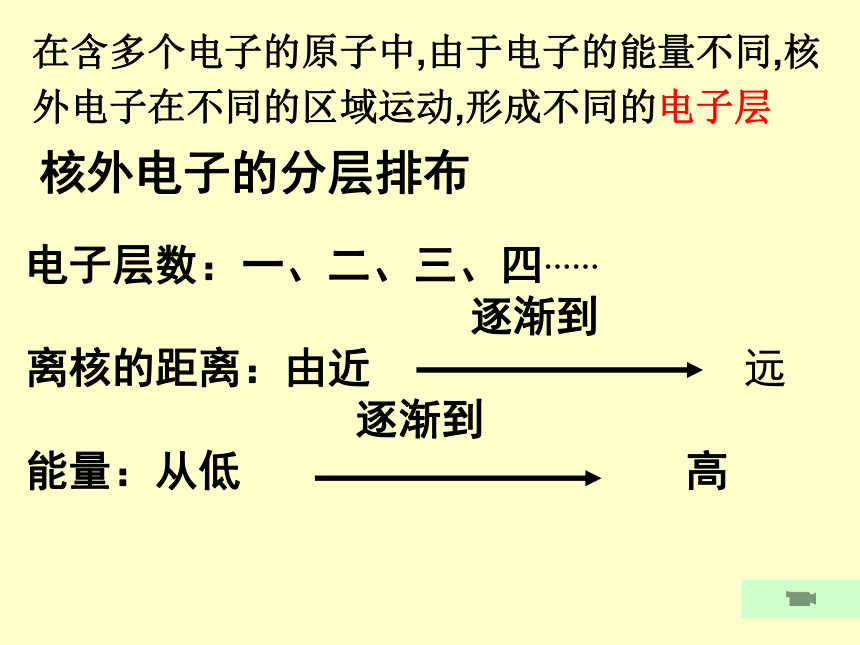
在含多个电子的原子中,由于电子的能量不同,核
外电子在不同的区域运动,形成不同的电子层
核外电子的分层排布
电子层数:一、二、三、四……
逐渐到
离核的距离:由近 远
逐渐到
能量:从低 高
一、核外电子分层排布的规律
①第一层最多排2个电子,第二层最多排8个电子
②最外层电子数不超过8个
③电子先排满第一层再排第二层,排满第二层再排第三层。
二、原子结构示意图的含义
原子核及核内质子数
电子层
该电子层上的电子数
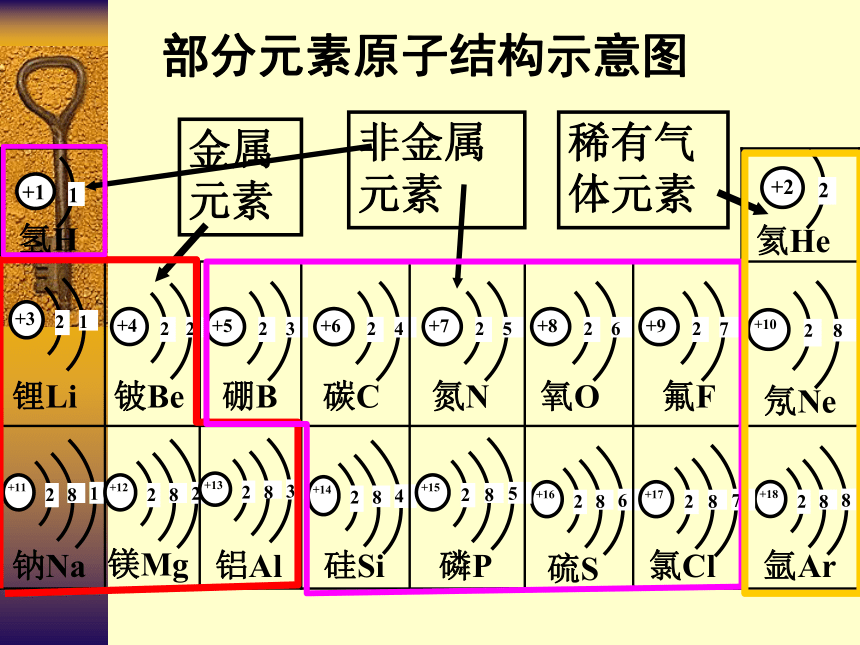
部分元素原子结构示意图
金属元素
稀有气体元素
非金属元素
+1
1
+2
2
+3
2
1
+4
2
2
+5
2
3
+6
2
4
+8
2
6
+7
2
5
+10
2
8
+9
2
7
+11
2
8
1
+14
2
8
4
+12
2
8
2
+13
2
8
3
+16
2
8
6
+15
2
8
5
+18
2
8
8
+17
2
8
7
氦He
氟F
氧O
氢H
氮N
硼B
锂Li
碳C
铍Be
镁Mg
硅Si
铝Al
钠Na
氖Ne
磷P
氯Cl
氩Ar
硫S
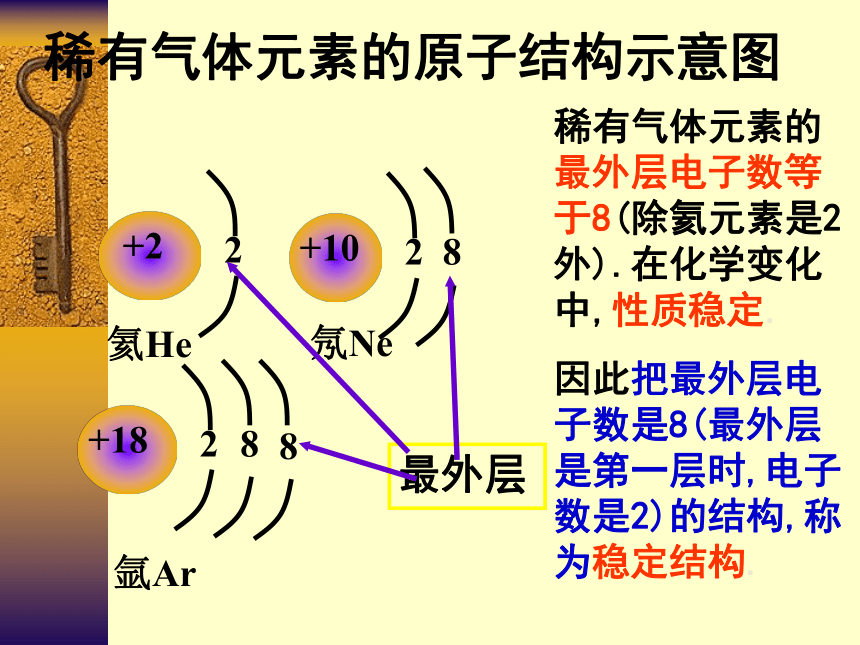
稀有气体元素的原子结构示意图
氦He
2
+2
氖Ne
2
+10
8
氩Ar
2
+18
8
8
最外层
稀有气体元素的最外层电子数等于8(除氦元素是2外).在化学变化中,性质稳定.
因此把最外层电子数是8(最外层是第一层时,电子数是2)的结构,称为稳定结构.
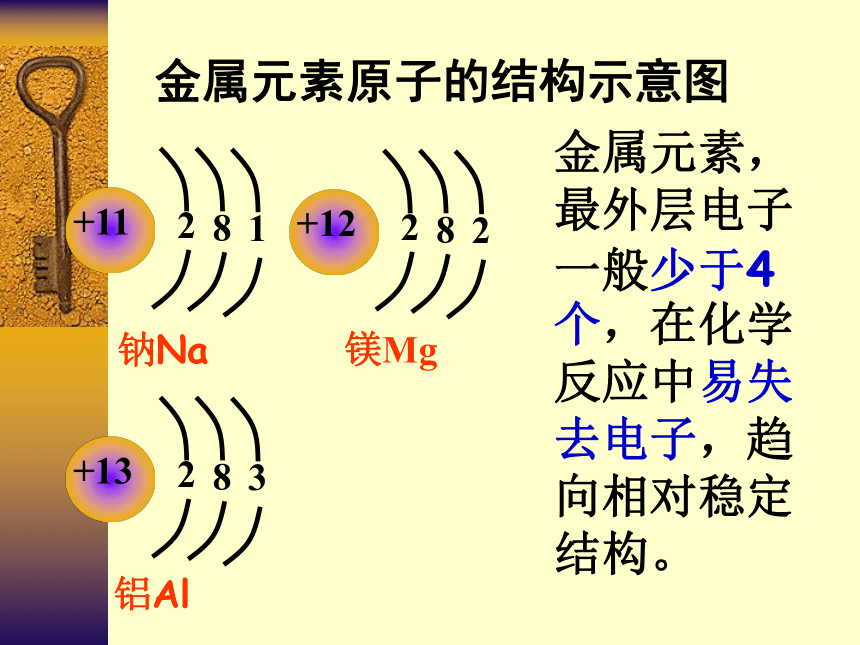
金属元素原子的结构示意图
镁Mg
铝Al
钠Na
1
2
+11
8
2
2
+12
8
3
2
+13
8
金属元素,最外层电子一般少于4个,在化学反应中易失去电子,趋向相对稳定结构。
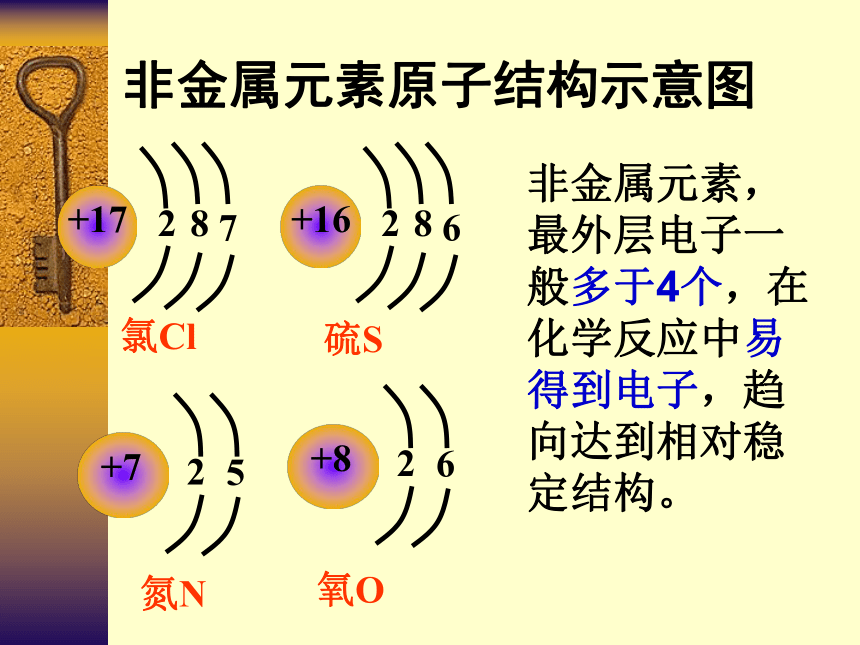
非金属元素原子结构示意图
氯Cl
硫S
氮N
氧O
2
+16
8
6
2
+17
8
7
+8
2
6
+7
2
5
非金属元素,最外层电子一般多于4个,在化学反应中易得到电子,趋向达到相对稳定结构。
+11
2
8
1
+11
2
8
质子数
核外电子数
=
质子数
核外电子数
>
+17
2
8
7
+17
2
8
8
Na
Na
+
Cl
Cl
-
质子数
核外电子数
=
质子数
核外电子数
<
元素的化学性质,和该元素原子的最外层电子数关系密切.因此,原子的最外层电子数决定了元素的性质,特别是元素的化学性质
在化学反应中原子经常会得到或失去电子而成为带电的微粒,带电的原子或原子团叫离子
原子失去电子带正电的微粒叫阳离子
原子得到电子带负电的微粒叫阴离子
Na+Cl-
原子失去电子变成带正电的微粒
原子得到电子变成带负电的微粒
氯化钠的形成过程
离子也是构成物质的一种微粒。
一种由离子构成的物质中,至少有2种离子(一种阳离子和一种阴离子)。
如钠离子带正电荷(阳离子)、氯离子带负电(阴离子),它们互相作用,构成了氯化钠
阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl
下列粒子的结构图中表示阴离子的是( ) ,表示阳离子的是( ),达到稳定结构的是( )
A
B D
A B C D
如氯离子 Cl- 钠离子 Na+ 镁离子 Mg2+
右上角数字和符号表示每个该离子所带的电荷数
如Ca2+中的2+表示每个钙离子带2个单位的正电荷
3Al3+中的3 , 3+的含义呢
在元素符号右上角先写数字后写正负号,如果是 1 则不写
离子的表示方法
2+
Mg
Al
3+
Cl
_
O
2-
离子所带电荷数由该元素原子的最外层电子数决定。
Al
铝元素或一个铝原子
3+
每个铝离子带三个单位正电荷
3
3个铝离子
铝离子或一个铝离子
记住下列原子团
SO4 (硫酸根) CO3(碳酸根) NO3 (硝酸根) OH (氢氧根) NH4(铵根)
注意 原子团不是物质,是构成物质的一部分。
原子团也可以得失电子形成离子
SO42- 硫酸根离子
CO32- 碳酸根离子
NO3- 硝酸根离子 OH- 氢氧根离子
NH4+ 铵根离子
书写下列离子符号
带一个单位正电荷的钠离子
带一个单位负电荷的氯离子
带两个单位正电荷的镁离子
带两个单位负电荷的硫酸根离子
3个钠离子
Cl-
Na+
Mg2+
SO42-
3Na+
1、构成物质的粒子有多种,如氧气是由 ___构成的,氯化钠是由___、_____构成的,锌是由______构成的。
2、用符号表示:
带两个单位正电荷的钙离子______
带两个单位负电荷的硫离子______
读出下列离子符号
Cl-, Na+, Mg2+, SO42-
钠离子
氯离子
锌原子
Ca2+
S2-
氧分子
构成物质的基本粒子
构成物质的基本粒子有分子、原子和离子
水(H2O)、二氧化碳(CO2)是由分子构成的
金刚石等是由原子构成的,金属铁中也含有铁原子
氯化钠(NaCl)等是由阴、阳离子构成的
1 构成物质的微粒有__、__、__。
2 说出构成下列物质的微粒的名称:
①金刚石 ②氯化钠 ③二氧化碳
3 氢气(H2)燃烧可以生成水(H2O),氢气是由__分子构成的,水是由__构成的。每个氢分子是由____构成的,每个水分子是由____构成的,水中___(有、没有)氢分子,水__(能、不能)燃烧。水分子和氢分子是不同的微粒,所以,水和氢气的化学性质__。
构成物质的基本微粒
离子
原子是由居于( )的带( )的( )和核外带( )的( )构成的。由于原子核和核外电子的( )相等,( )相反,所以原子( )。
原子的质量主要集中在( )上,
电子在原子核外的空间作( )
电子在核外的空间里做高速的运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
在含多个电子的原子中,由于电子的能量不同,核
外电子在不同的区域运动,形成不同的电子层
核外电子的分层排布
电子层数:一、二、三、四……
逐渐到
离核的距离:由近 远
逐渐到
能量:从低 高
一、核外电子分层排布的规律
①第一层最多排2个电子,第二层最多排8个电子
②最外层电子数不超过8个
③电子先排满第一层再排第二层,排满第二层再排第三层。
二、原子结构示意图的含义
原子核及核内质子数
电子层
该电子层上的电子数
部分元素原子结构示意图
金属元素
稀有气体元素
非金属元素
+1
1
+2
2
+3
2
1
+4
2
2
+5
2
3
+6
2
4
+8
2
6
+7
2
5
+10
2
8
+9
2
7
+11
2
8
1
+14
2
8
4
+12
2
8
2
+13
2
8
3
+16
2
8
6
+15
2
8
5
+18
2
8
8
+17
2
8
7
氦He
氟F
氧O
氢H
氮N
硼B
锂Li
碳C
铍Be
镁Mg
硅Si
铝Al
钠Na
氖Ne
磷P
氯Cl
氩Ar
硫S
稀有气体元素的原子结构示意图
氦He
2
+2
氖Ne
2
+10
8
氩Ar
2
+18
8
8
最外层
稀有气体元素的最外层电子数等于8(除氦元素是2外).在化学变化中,性质稳定.
因此把最外层电子数是8(最外层是第一层时,电子数是2)的结构,称为稳定结构.
金属元素原子的结构示意图
镁Mg
铝Al
钠Na
1
2
+11
8
2
2
+12
8
3
2
+13
8
金属元素,最外层电子一般少于4个,在化学反应中易失去电子,趋向相对稳定结构。
非金属元素原子结构示意图
氯Cl
硫S
氮N
氧O
2
+16
8
6
2
+17
8
7
+8
2
6
+7
2
5
非金属元素,最外层电子一般多于4个,在化学反应中易得到电子,趋向达到相对稳定结构。
+11
2
8
1
+11
2
8
质子数
核外电子数
=
质子数
核外电子数
>
+17
2
8
7
+17
2
8
8
Na
Na
+
Cl
Cl
-
质子数
核外电子数
=
质子数
核外电子数
<
元素的化学性质,和该元素原子的最外层电子数关系密切.因此,原子的最外层电子数决定了元素的性质,特别是元素的化学性质
在化学反应中原子经常会得到或失去电子而成为带电的微粒,带电的原子或原子团叫离子
原子失去电子带正电的微粒叫阳离子
原子得到电子带负电的微粒叫阴离子
Na+Cl-
原子失去电子变成带正电的微粒
原子得到电子变成带负电的微粒
氯化钠的形成过程
离子也是构成物质的一种微粒。
一种由离子构成的物质中,至少有2种离子(一种阳离子和一种阴离子)。
如钠离子带正电荷(阳离子)、氯离子带负电(阴离子),它们互相作用,构成了氯化钠
阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl
下列粒子的结构图中表示阴离子的是( ) ,表示阳离子的是( ),达到稳定结构的是( )
A
B D
A B C D
如氯离子 Cl- 钠离子 Na+ 镁离子 Mg2+
右上角数字和符号表示每个该离子所带的电荷数
如Ca2+中的2+表示每个钙离子带2个单位的正电荷
3Al3+中的3 , 3+的含义呢
在元素符号右上角先写数字后写正负号,如果是 1 则不写
离子的表示方法
2+
Mg
Al
3+
Cl
_
O
2-
离子所带电荷数由该元素原子的最外层电子数决定。
Al
铝元素或一个铝原子
3+
每个铝离子带三个单位正电荷
3
3个铝离子
铝离子或一个铝离子
记住下列原子团
SO4 (硫酸根) CO3(碳酸根) NO3 (硝酸根) OH (氢氧根) NH4(铵根)
注意 原子团不是物质,是构成物质的一部分。
原子团也可以得失电子形成离子
SO42- 硫酸根离子
CO32- 碳酸根离子
NO3- 硝酸根离子 OH- 氢氧根离子
NH4+ 铵根离子
书写下列离子符号
带一个单位正电荷的钠离子
带一个单位负电荷的氯离子
带两个单位正电荷的镁离子
带两个单位负电荷的硫酸根离子
3个钠离子
Cl-
Na+
Mg2+
SO42-
3Na+
1、构成物质的粒子有多种,如氧气是由 ___构成的,氯化钠是由___、_____构成的,锌是由______构成的。
2、用符号表示:
带两个单位正电荷的钙离子______
带两个单位负电荷的硫离子______
读出下列离子符号
Cl-, Na+, Mg2+, SO42-
钠离子
氯离子
锌原子
Ca2+
S2-
氧分子
构成物质的基本粒子
构成物质的基本粒子有分子、原子和离子
水(H2O)、二氧化碳(CO2)是由分子构成的
金刚石等是由原子构成的,金属铁中也含有铁原子
氯化钠(NaCl)等是由阴、阳离子构成的
1 构成物质的微粒有__、__、__。
2 说出构成下列物质的微粒的名称:
①金刚石 ②氯化钠 ③二氧化碳
3 氢气(H2)燃烧可以生成水(H2O),氢气是由__分子构成的,水是由__构成的。每个氢分子是由____构成的,每个水分子是由____构成的,水中___(有、没有)氢分子,水__(能、不能)燃烧。水分子和氢分子是不同的微粒,所以,水和氢气的化学性质__。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
