华师大版科学九年级上册 1.1 化学方程式 同步检测(含解析)
文档属性
| 名称 | 华师大版科学九年级上册 1.1 化学方程式 同步检测(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 171.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-11-30 15:42:21 | ||
图片预览




文档简介
1.1化学方程式-华东师大版九年级科学上册同步检测
一、选择题
1.以甲醇为原料的一款新型手机电池,其反应原理为2CH3OH+3X+4NaOH===2Na2CO3+6H2O,其中X的化学式为
A.CO B.CO2
C.O2 D.H2
2.充分加热a克氯酸钾与b克二氧化锰的混合物,留下残余固体c克,则生成氧气的质量为
A.(a-b)克
B.(a-b-c)克
C.(a+b-c)克
D.(a-b+c)克
3.科学中常常出现“1+1≠2”的有趣现象,但也有例外。下列符合“1+1=2”的事实的是
A.1升水与1升酒精混合后的体积等于2升
B.1克木炭在1克氧气中充分燃烧后生成2克二氧化碳
C.1克硫粉在1克氧气中充分燃烧后生成2克二氧化硫
D.1克氯酸钾与1克二氧化锰混合,充分加热后所得固体质量为2克
4.在反应中,反应物C、CO2与生成的CO的质量比为
A.3∶11∶14
B.1∶1∶1
C.1∶1∶2
D.3∶11∶7
5.下列化学方程式书写正确的是
A.2Mg+O2↑2MgO
B.H2O2+MnO2===H2O+MnO2+O2
C.4Fe+3O22Fe2O3
D.4P+5O22P2O5
6.在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质
甲
乙
丙
丁
反应前质量(克)
18
1
2
32
反应后质量(克)
x(未知)
26
2
12
下列说法中,不正确的是
A.反应后物质甲的质量为13克
B.乙是反应物
C.反应中乙、丁的质量比为5∶4
D.物质丙可能是该反应的催化剂
7.汽车安装使用催化净化装置是减少汽车尾气对空气污染的有效方法之一。其主要发生催化剂的化学反应方程式为:2NO+2CO2CO2+N2下列对该化学反应的说法不正确的是( )
A.反应物都属于氧化物
B.该反应使有害气体转化为无害物质
C.反应前后元素的种类、原子和分子个数都不变
D.化学反应方程式中所表示的反应物和生成物中只有一种物质是单质
8.不能从以下两个化学方程式中获取的信息是( )
反应①:2H2O22H2O+O2↑,反应②:2KMnO4K2MnO4+MnO2+O2↑
A.反应①和反应②是在不同条件下进行的
B.反应①和反应②都有气体生成
C.反应①和反应②的反应物中都含氧元素
D.反应①和反应②都放出热
9.催化转化器可将汽车尾气中的有毒气体转化为无毒气体,发生反应的微观示意图为:下列从图示所获得的信息中,正确的是( )
A.反应过程中原子的种类发生改变
B.反应过程中各元素化合价不变
C.反应过程中没有单质生成
D.图中有三种不同的氧化物
10.配平化学方程式时,判断所配化学计量数是否正确的依据是( )
A.反应前后所配化学计量数之和是否相等
B.反应前后元素种类是否相等
C.反应前后各元素的原子总数是否相等
D.反应前后各物质质量是否相等
11.下列化学方程式书写正确的是( )
A.B.
C.D.
12.某纯净物在氧气中燃烧生成二氧化硫和水.自此判断,该物质的组成中一定含有的()
A.氯化物 B.硫化物
C.氢化物 D.硫、氢和氧
13.某物质发生化学反应的微观示意图为: (“ ”表示碳原子,“ ”表示氧原子,“?”表示氢原子),生成物甲的化学式为 (? )
A.H2?????????????????????????????????????? B.H2O?????????????????????????????????????? C.CO?????????????????????????????????????? D.CO2
14.华为公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的l0倍,可连续使用1个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O。其中X的化学式为( )
A.CO? B.H2 C.O2? D.CO2
15.某地城际铁路的建成将进一步推动该市经济的发展,在修建铁路的土石方爆破中要用到黑火药,黑火药爆炸时发生反应的化学方程式是,根据以上信息,下列说法错误的是( )
A.X的化学式是N2
B.该反应属于化合反应
C.KNO3中氮元素的化合价为+5价
D.黑火药是混合物
16.为测定某含有氧化铁、四氧化三铁和氧化亚铁的混合物的组成,现取2.9g该混合物与足量CO充分反应,测得生成铁的质量为2.1g,则混合物中氧化亚铁的质量可能为( )
A.0.7g B.1.1g C.1.5g D.1.9g
17.工业上可用氧化钛和金属镁反应制取钛金属,化学方程式如下:该化学方程式属于基本反应类型中的( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
18.根据不同化学反应的特点进行归纳、分类是我们学习、记忆化学反应的重要方法。分析下面化学反应,其中属于置换反应类型的是 ( )
① 2H2O22H2O+O2↑ ② CuO+H2Cu+H2O
③ Fe3O4+4CO3Fe+4CO2 ④ 2KI+Cl2====2KCl+I2
⑤ Na2CO3+CO2+H2O====2NaHCO3⑥ BaCl2+H2SO4===BaSO4↓+2HCl
A.①③⑤ B.②③④ C.②④ D.⑤⑥
二、填空题
19.如图为某化学反应的微观示意图图中“●”表示硫原子,“○”表示氧原子。甲物质的名称是___________________;该反应的化学方程式是_____________________。
20.质量守恒定律是化学反应中的重要规律,请运用此规律解答下列问题:
(1)某纯净物X在空气中完全燃烧,反应的化学方程式为X+3O22CO2+2H2O,X的化学式为C2H4;若生成二氧化碳的质量为8.8克,则X中碳元素质量为______克。
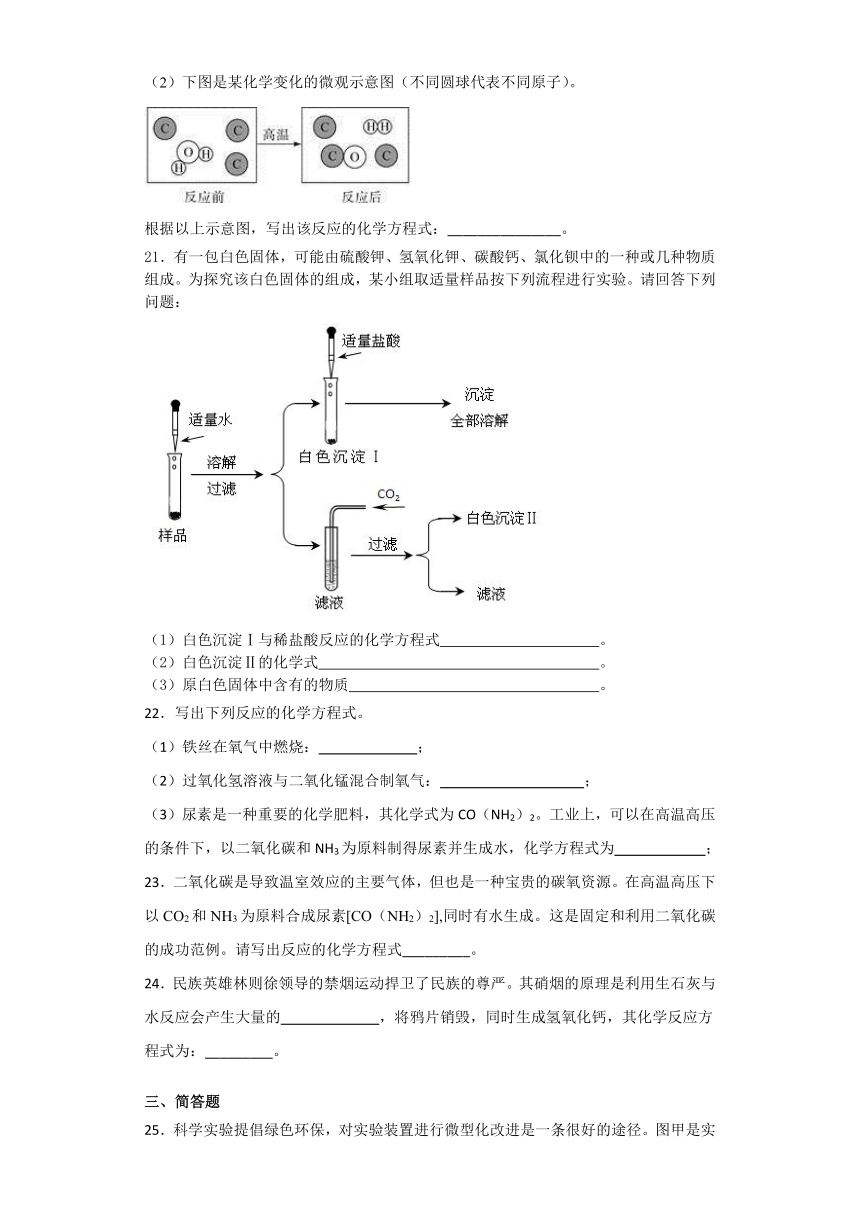
(2)下图是某化学变化的微观示意图(不同圆球代表不同原子)。
根据以上示意图,写出该反应的化学方程式:_______________。
21.有一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙、氯化钡中的一种或几种物质组成。为探究该白色固体的组成,某小组取适量样品按下列流程进行实验。请回答下列问题:
(1)白色沉淀Ⅰ与稀盐酸反应的化学方程式 。
(2)白色沉淀Ⅱ的化学式 。
(3)原白色固体中含有的物质 。
22.写出下列反应的化学方程式。
(1)铁丝在氧气中燃烧: ;
(2)过氧化氢溶液与二氧化锰混合制氧气: ;
(3)尿素是一种重要的化学肥料,其化学式为CO(NH2)2。工业上,可以在高温高压的条件下,以二氧化碳和NH3为原料制得尿素并生成水,化学方程式为 ;
23.二氧化碳是导致温室效应的主要气体,但也是一种宝贵的碳氧资源。在高温高压下以CO2和NH3为原料合成尿素[CO(NH2)2],同时有水生成。这是固定和利用二氧化碳的成功范例。请写出反应的化学方程式_________。
24.民族英雄林则徐领导的禁烟运动捍卫了民族的尊严。其硝烟的原理是利用生石灰与水反应会产生大量的 ,将鸦片销毁,同时生成氢氧化钙,其化学反应方程式为:_________。
三、简答题
25.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的_______仪器相同(填字母编号)。
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是________。
(3)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?
26.如图是探究质量守恒定律的实验装置图,回答下列问题:
(1)该实验 (填“能”或“不能”)探究质量守恒定律,原因是 。
(2)要用如图继续探究质量守恒定律,若药品不变,改变装置的方法是 。若装置不变,改变药品,可选用的一组药品是 (举一例)。
四、探究题
27.氢化镁(化学式为MgH2)是一种常用的焰火剂,遇水易发生反应。某兴趣小组拟用如装置制备氢化镁。
请回答下列问题:
(1)请选择必要的装置,按气体流向的连接顺序为___(填仪器接口处的字母编号)。
(2)用连接好的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞,___(请按正确的顺序排列下列步骤).
a.加热反应一段时间????????????????????????b.关闭分液漏斗活塞
c.收集气体并检验纯度???????????????????????d.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入热水中,观察到有气泡冒出,该反应的化学方程式为___。
(4)无水氯化钙的作用是___,请简述如何检验E装置的气密性:___。
(5)氢化钠(NaH)也是一种金属氢化物,常用作缩合剂、烷化剂。请你设计一个实验,用化学方法区分氢化钠与氢化镁,写出简要的实验步骤及观察到的现象:___。
参考答案
1.C
【分析】
根据质量守恒定律化学反应前后原子种类不变,原子数目没有增减,从而确定化学式。
【详解】
根据质量守恒定律化学反应前后原子种类不变,原子数目没有增减,在化学方程式反应前后,碳原子、氢原子、钠原子个数都已相等,而反应后氧原子个数为12个,反应前氧原子个数为6个,故3x个分子中氧原子为6个,故一个X分子中含有2个氧原子,故为氧气
故选C。
【点睛】
掌握化学反应前后原子种类和数目不变是正确解答本题的关键。
2.C
【解析】
【分析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,根据质量守恒定律,参加反应的反应物的总质量等于生成的生成物的总质量。
【详解】
根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气逸散,所以反应后质量的减少量就是生成的氧气的质量;由于残余固体的质量为c?g中包含着二氧化锰,所以在计算质量的减少量时,必须是氯酸钾的质量加上二氧化锰的质量再减去残余固体质量,所以生成氧气的质量为(a+b-c)克,故选C。
3.C
【详解】
A、由于分子之间存在间隙,1L水与1L酒精混合后所得混合液体的体积小于2L,故A不正确;
B、碳相对原子质量12,氧气为32,所以1.2克碳消耗3.2克氧气,故B不正确;
C、硫在氧气中燃烧生成二氧化硫,根据反应的化学方程式中两物质的质量关系32:32可知,1g硫粉在lg氧气中燃烧恰好完全反应,根据质量守恒定律,反应后生成2g二氧化硫,故C正确;
D、氯酸钾和二氧化锰加热生成氯化钾和氧气,由化学反应方程式可知,245份的氯酸钾生成149份的氯化钾,1克氯酸钾与1克二氧化锰混合,充分加热后所得固体质量为0.6克,故D不正确。故选C。
4.A
【分析】
反应物与生成物相对原子(分子)质量乘以前面的计量数之比。
【详解】
化学方程式为,反应物C、CO2与生成的CO的质量比为。
5.D
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【详解】
A.气体符号只能标注在生成物一侧,正确的化学方程式为,故错误;
B.在此反应中,二氧化锰是催化剂,属于反应条件,正确的化学方程式为,故错误;
C.铁丝在氧气中燃烧的产物是四氧化三铁,正确的化学方程式为,故错误;
D.磷与氧气在点燃的条件下反应生成五氧化二磷,该化学方程式书写完全正确。
故选D。
6.B
【详解】
由表格信息可知反应后乙质量增加了25克,是生成物;丁质量减少了20克,是反应物;丙质量不变,可能是催化剂或者是杂质,反应物还少5克,所以甲是反应物,所以反应后物质甲的质量为13g,反应物是甲和丁,生成物是乙。反应中乙、丁的质量比25:20=5:4
故选B。
7.C
【分析】
A、根据氧化物的定义分析;
B、该反应使有害气体转化为无害物质;
C、反应前后分子个数改变;
D、反应物和生成物中只有氮气是单质.
【详解】
A、NO和CO都是由氧元素和和另一元素组成的氧化物,故正确;
B、该反应使有害气体转化为无害物质,正确;
C、反应前后分子个数改变,故错误;
D、反应物和生成物中只有氮气是单质,故正确;
故选C。
【点睛】
掌握氧化物的概念、质量守恒定律、化学方程式的意义是正确解答本题的关键。
8.D
【详解】
A、由化学方程式可知,反应①条件是催化剂,反应②条件是加热,则反应①和反应②是在不同条件下进行的,故A正确;
B、由化学方程式可知,反应①和反应②都有氧气生成,故B正确;
C、由化学方程式可知,反应①和反应②的反应物中都含氧元素,故C正确;
D、根据化学方程式不能判断是否放热,故D不正确。故选D。
9.D
【详解】
A. 化学反应过程中原子的种类不变,此选项错误;
B. 化合物中各元素化合价的代数和为零,反应后有单质生成,单质中元素的化合价为零,反应后碳元素、氮元素的化合价发生了改变,此选项错误;
C. 反应后有氮气生成,氮气属于单质,此选项错误;
D. 图中有一氧化碳、一氧化氮、二氧化碳三种不同的氧化物,此选项正确。
故选D。
10.C
【解析】
【分析】
由质量守恒定律可知,在化学反应的前后各元素的原子个数是相等的。
【详解】
化学反应的实质是原子重新结合生成新的分子,由质量守恒定律可知,在化学反应的前后各元素的原子个数是相等的,则化学反应前后各元素的原子总数相等,即已配平,反之,若化学反应前后各元素的原子总数不相等,则未配平,化学方程式配平与化学计量数之和、物质的状态、元素种类无关,故选C。
11.B
【详解】
A、方程式两边原子个数不守恒,未配平,不符合题意;
B、方程式满足质量守恒定律且条件、气体符号书写无误,符合题意;
C、反应条件为点燃,不符合题意;
D、方程式未配平,应为,不符合题意。故选B。
12.B
【解析】
试题分析:生成物二氧化硫、水中含有S,H,O三种元素,则反应物中也一定含有这三种元素.物质在空气中燃烧是和空气中的氧气反应,氧气由氧元素组成,则S,H一定是从该物质中来,而该物质中是否含有氧元素无法确定,而含有硫和氢元素的物质一定是硫化物;
故选B
考点:质量守恒定律及其应用.
点评:本题主要考查学生运用质量守恒定律进行推断的能力,掌握质量守恒定律的实质是解题的关键.
13.D
【解析】
CH4+2O2CO2+2H2O
14.C
【解析】
据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有6个氧原子、2个碳原子、 12个氢原子、4个钠原子,反应后有2个碳原子、 12个氢原子、12个氧原子、4个钠原子,所以一个X的分子中有2个氧原子;X的化学式为O2 ,选C
15.B
【分析】
根据质量守恒定律与化学方程式,推测X的化学式,根据反应的特点判断反应不是化合反应,根据化合价代数和为零确定N元素的化合价,黑火药由三种物质组成,属于混合物。
【详解】
A、根据质量守恒定律可知,在反应方程式中,X的化学式为,A选项正确,不符合题意;
B、该反应由三种反应物生成两种生成物,不符合化合反应“多变一”的特征,不属于化合反应,B选项不正确,符合题意;
C、中K元素化合价为+1价,O元素化合价为-2价,根据化合价代数和为零,可计算出N元素的化合价为+5价,C选项正确,不符合题意;
D、由题意黑火药由、和三种物质组成,属于混合物,D选项正确,不符合题意。故选B。
16.A
【解析】
试题分析:根据题意,FeO、Fe3O4、Fe2O3的混合物与足量的CO充分反应,生成铁和二氧化碳,由质量守恒定律可知,混合物中铁元素的质量和反应生成的铁的质量相等,故混合物中铁元素、氧元素的质量比="2.1g:(2.9g-2.1g)=21:8" 。由化学式可知,FeO中铁元素和氧元素的质量比=56:12=7:2=21:6,Fe2O3中铁元素和氧元素的质量比=21:9,Fe3O4中铁元素和氧元素的质量比=21:8,因此混合物中 Fe3O4的质量可以为任意值,设混合物中 Fe2O3的质量为x,FeO的质量为y,则
(x ×+y×):(x×+)=21:8
解得 x:y=9:20 即混合物中氧化亚铁的质量不可能大于0.9g,所以,混合物中氧化亚铁的质量可能为0.7g,答案为A。考点:化学方程式的计算
17.D
【详解】
TiCl4+2MgTi+2MgCl2,是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
故选D。
18.C
【详解】
①中反应物是一种,生成物是两种,属于分解反应;
②中反应物和生成物都是一种单质和一种化合物,属于置换反应;
③属于氧化还原反应;
④中反应物和生成物都是一种单质和一种化合物,属于置换反应;
⑤中反应物是三种,生成物是一种,属于化合反应;
⑥中反应物和生成物都是两种化合物,属于复分解反应。
故选C。
19.二氧化硫 2SO2+O2 2SO3
【详解】
(1)由图可知,一个甲分子中含有一个硫原子和两个氧原子,所以甲分子构成的物质是二氧化硫,故填二氧化硫;
(2)由图可知,反应中两个二氧化硫分子与一个氧分子在一定条件下反应生成了两个三氧化硫分子,即该反应为二氧化硫与氧气在一定条件下反应生成三氧化硫,故反应的化学方程式写为:2SO2+O2?2SO3。
20.2.4 H2O+C CO+H2
【详解】
(1)某纯净物X在空气中完全燃烧,学方程反应的化式为X+3O22CO2+2H2O,据质量守恒定律可知,反应前后元素的种类、质量不变,若生成二氧化碳的质量为8.8克,二氧化碳中碳元素的质量与X中碳元素的质量相等,则X中碳元素质量为8.8g=2.4g;
(2)下图是某化学变化的微观示意图(不同圆球代表不同原子)。
据图中信息可知,反应为碳和水在高温下生成一氧化碳和氢气,据质量守恒定律可知,反应前后原子的种类、个数不变,可知该反应的化学方程式:H2O+C CO+H2。
21.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)BaCO3 (3)CaCO3、BaCl2和KOH
【解析】取白色固体溶于水后得到白色沉淀,且沉淀全部溶于盐酸,可得出固体中一定存在碳酸钙,且硫酸钙和氯化钡中最多只能含有其中一种,(要是这两种物质同时存在会生成硫酸钡白色沉淀不溶于盐酸)然后往第一步的滤液中通入CO2气体产生白色沉淀,可得出固体中一定含有氯化钡(与CO2气体反应生成碳酸钡白色沉淀),因此固体中不含硫酸钙。故此固体一定含有CaCO3和BaCl2。
22.(1)3Fe+2O2 Fe3O4
(2)2H2O22H2O+O2↑
(3)CO2+2NH3CO(NH2)2+H2O
【详解】
(1)铁丝在氧气中燃烧生成四氧化三铁,反应的方程式为3Fe+2O2Fe3O4;
(2)过氧化氢溶液在二氧化锰做催化剂的条件下生成氧气和水,反应的方程式为:2H2O2 2H2O+O2↑;
(3)尿素是一种重要的化学肥料,其化学式为CO(NH2)2。工业上,可以在高温高压的条件下,以二氧化碳和NH3为原料制得尿素并生成水,化学方程式为CO2+2NH3 CO(NH2)2+H2O.
23.
【分析】
根据题中的叙述找出反应物、生成物以及反应条件,然后根据方程式的书写原则书写化学方程式。
【详解】
二氧化碳和氨气在高温高压的条件下生成尿素和水,反应的化学方程式为故答案为。
【点睛】
掌握根据给出的反应物和生成物以及反应条件书写化学方程式的方法是正确解答本题的关键。
24.热量 CaO + H2O === Ca(OH)2
【详解】
生石灰与水反应生成氢氧化钙,该过程会放热,从而将鸦片焚毁,故填热量;
生石灰就是氧化钙,氧化钙与水反应生成氢氧化钙,故反应的化学方程式写为:CaO + H2O = Ca(OH)2。
25.(1)A;(2)药品用量少,产生的废弃物也少,操作方便;(3)0.044克
【解析】
(1)A (2分) (2)药品用量少,产生的废弃物也少,操作方便(2分)
(3)解:设实验过程中产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑ (1分)
73 44
0.73克×10% x (1分)
73:44= 0.73克×10%:x (1分)
解得x=0.044克 (1分)
答:实验过程中产生CO2的质量为0.044克。
26.(1)不能;二氧化碳气体逸散于空气中
(2)反应在密闭容器中进行;硫酸铜溶液与氢氧化钠溶液
【详解】
(1)烧杯中的现象是固体逐渐减少,产生气体,生成的二氧化碳气体逸散于空气中,因此反应后观察到天平不平衡,该实验不能探究质量守恒定律;
(2)在反应物不变的前提下,要保持天平平衡,应将反应在密闭容器中进行;若装置不变,改变药品,可选用的一组药品是硫酸铜溶液与氢氧化钠溶液;
故答案为(1)不能;二氧化碳气体逸散于空气中;(2)反应在密闭容器中进行;硫酸铜溶液与氢氧化钠溶液。
27.i e f d c j k a (jk可颠倒) cadb MgH2+2H2O=Mg(OH)2↓+2H2↑ 防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效 检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。 将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH
【分析】
(1)制备氢化镁的原料是镁粉和氢气,用盐酸和锌制取氢气,氢气中混有HCl和水蒸气,先通过氢氧化钠溶液除去HCl,再通过浓硫酸除去水蒸气,即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁,为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸;
(3)有气泡冒出为氢气,氢化镁和水反应,反应物为氢化镁和水,生成物为氢气和氢氧化镁,据此书写方程式;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,能防止空气中的水蒸气进入玻璃管中,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法等;
(5)氢化钠与氢化镁都能与水反应生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁。
【详解】
(1)制备MgH2固体需要制备氢气和镁发生反应,MgH2在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用E装置制备氢气(i ),氯化氢易挥发,制得的氢气中含有氯化氢和水蒸气,先通过氢氧化钠溶液除去HCl(e f),再通过浓硫酸除去水蒸气(d c,注意洗气长管进短管出),即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁(j k,jk可颠倒),为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管,( a,粗管进连气体流入,细管出防止空气中的水蒸气进入),所以装置连接顺序为:i e f d c j k a (jk可颠倒),
故答案为:i?e?f?d?c?j?k?a?(jk可颠倒);
(2)有气体参加加热或燃烧的反应需要首先验纯(C),加热反应一段时间 (a),实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,停止加热,充分冷却(d),关闭分液漏斗活塞(b),故正确的操作顺序为cadb,
故答案为:cadb;
(3)有气泡冒出为氢气,根据原子守恒,氢化镁和水反应,方程式为:MgH2+2H2O=Mg(OH)2↓+2H2↑,
故答案为:MgH2+2H2O=Mg(OH)2↓+2H2↑;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,所以无水氯化钙的作用是防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断,方法:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
故答案为:防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效;方法:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(5)氢化钠与氢化镁都能与水反应,反应分别为:NaH+H2O=NaOH+H2↑,MgH2+2H2O=Mg(OH)2↓+2H2↑,都生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁,将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH,
故答案为:将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH。
【点睛】
本题考查了氢化镁的制备实验,实验装置的连接顺序和分析判断是解答的难点,掌握物质的性质以及制备的原理是解答关键。
一、选择题
1.以甲醇为原料的一款新型手机电池,其反应原理为2CH3OH+3X+4NaOH===2Na2CO3+6H2O,其中X的化学式为
A.CO B.CO2
C.O2 D.H2
2.充分加热a克氯酸钾与b克二氧化锰的混合物,留下残余固体c克,则生成氧气的质量为
A.(a-b)克
B.(a-b-c)克
C.(a+b-c)克
D.(a-b+c)克
3.科学中常常出现“1+1≠2”的有趣现象,但也有例外。下列符合“1+1=2”的事实的是
A.1升水与1升酒精混合后的体积等于2升
B.1克木炭在1克氧气中充分燃烧后生成2克二氧化碳
C.1克硫粉在1克氧气中充分燃烧后生成2克二氧化硫
D.1克氯酸钾与1克二氧化锰混合,充分加热后所得固体质量为2克
4.在反应中,反应物C、CO2与生成的CO的质量比为
A.3∶11∶14
B.1∶1∶1
C.1∶1∶2
D.3∶11∶7
5.下列化学方程式书写正确的是
A.2Mg+O2↑2MgO
B.H2O2+MnO2===H2O+MnO2+O2
C.4Fe+3O22Fe2O3
D.4P+5O22P2O5
6.在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质
甲
乙
丙
丁
反应前质量(克)
18
1
2
32
反应后质量(克)
x(未知)
26
2
12
下列说法中,不正确的是
A.反应后物质甲的质量为13克
B.乙是反应物
C.反应中乙、丁的质量比为5∶4
D.物质丙可能是该反应的催化剂
7.汽车安装使用催化净化装置是减少汽车尾气对空气污染的有效方法之一。其主要发生催化剂的化学反应方程式为:2NO+2CO2CO2+N2下列对该化学反应的说法不正确的是( )
A.反应物都属于氧化物
B.该反应使有害气体转化为无害物质
C.反应前后元素的种类、原子和分子个数都不变
D.化学反应方程式中所表示的反应物和生成物中只有一种物质是单质
8.不能从以下两个化学方程式中获取的信息是( )
反应①:2H2O22H2O+O2↑,反应②:2KMnO4K2MnO4+MnO2+O2↑
A.反应①和反应②是在不同条件下进行的
B.反应①和反应②都有气体生成
C.反应①和反应②的反应物中都含氧元素
D.反应①和反应②都放出热
9.催化转化器可将汽车尾气中的有毒气体转化为无毒气体,发生反应的微观示意图为:下列从图示所获得的信息中,正确的是( )
A.反应过程中原子的种类发生改变
B.反应过程中各元素化合价不变
C.反应过程中没有单质生成
D.图中有三种不同的氧化物
10.配平化学方程式时,判断所配化学计量数是否正确的依据是( )
A.反应前后所配化学计量数之和是否相等
B.反应前后元素种类是否相等
C.反应前后各元素的原子总数是否相等
D.反应前后各物质质量是否相等
11.下列化学方程式书写正确的是( )
A.B.
C.D.
12.某纯净物在氧气中燃烧生成二氧化硫和水.自此判断,该物质的组成中一定含有的()
A.氯化物 B.硫化物
C.氢化物 D.硫、氢和氧
13.某物质发生化学反应的微观示意图为: (“ ”表示碳原子,“ ”表示氧原子,“?”表示氢原子),生成物甲的化学式为 (? )
A.H2?????????????????????????????????????? B.H2O?????????????????????????????????????? C.CO?????????????????????????????????????? D.CO2
14.华为公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的l0倍,可连续使用1个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O。其中X的化学式为( )
A.CO? B.H2 C.O2? D.CO2
15.某地城际铁路的建成将进一步推动该市经济的发展,在修建铁路的土石方爆破中要用到黑火药,黑火药爆炸时发生反应的化学方程式是,根据以上信息,下列说法错误的是( )
A.X的化学式是N2
B.该反应属于化合反应
C.KNO3中氮元素的化合价为+5价
D.黑火药是混合物
16.为测定某含有氧化铁、四氧化三铁和氧化亚铁的混合物的组成,现取2.9g该混合物与足量CO充分反应,测得生成铁的质量为2.1g,则混合物中氧化亚铁的质量可能为( )
A.0.7g B.1.1g C.1.5g D.1.9g
17.工业上可用氧化钛和金属镁反应制取钛金属,化学方程式如下:该化学方程式属于基本反应类型中的( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
18.根据不同化学反应的特点进行归纳、分类是我们学习、记忆化学反应的重要方法。分析下面化学反应,其中属于置换反应类型的是 ( )
① 2H2O22H2O+O2↑ ② CuO+H2Cu+H2O
③ Fe3O4+4CO3Fe+4CO2 ④ 2KI+Cl2====2KCl+I2
⑤ Na2CO3+CO2+H2O====2NaHCO3⑥ BaCl2+H2SO4===BaSO4↓+2HCl
A.①③⑤ B.②③④ C.②④ D.⑤⑥
二、填空题
19.如图为某化学反应的微观示意图图中“●”表示硫原子,“○”表示氧原子。甲物质的名称是___________________;该反应的化学方程式是_____________________。
20.质量守恒定律是化学反应中的重要规律,请运用此规律解答下列问题:
(1)某纯净物X在空气中完全燃烧,反应的化学方程式为X+3O22CO2+2H2O,X的化学式为C2H4;若生成二氧化碳的质量为8.8克,则X中碳元素质量为______克。
(2)下图是某化学变化的微观示意图(不同圆球代表不同原子)。
根据以上示意图,写出该反应的化学方程式:_______________。
21.有一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙、氯化钡中的一种或几种物质组成。为探究该白色固体的组成,某小组取适量样品按下列流程进行实验。请回答下列问题:
(1)白色沉淀Ⅰ与稀盐酸反应的化学方程式 。
(2)白色沉淀Ⅱ的化学式 。
(3)原白色固体中含有的物质 。
22.写出下列反应的化学方程式。
(1)铁丝在氧气中燃烧: ;
(2)过氧化氢溶液与二氧化锰混合制氧气: ;
(3)尿素是一种重要的化学肥料,其化学式为CO(NH2)2。工业上,可以在高温高压的条件下,以二氧化碳和NH3为原料制得尿素并生成水,化学方程式为 ;
23.二氧化碳是导致温室效应的主要气体,但也是一种宝贵的碳氧资源。在高温高压下以CO2和NH3为原料合成尿素[CO(NH2)2],同时有水生成。这是固定和利用二氧化碳的成功范例。请写出反应的化学方程式_________。
24.民族英雄林则徐领导的禁烟运动捍卫了民族的尊严。其硝烟的原理是利用生石灰与水反应会产生大量的 ,将鸦片销毁,同时生成氢氧化钙,其化学反应方程式为:_________。
三、简答题
25.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的_______仪器相同(填字母编号)。
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是________。
(3)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?
26.如图是探究质量守恒定律的实验装置图,回答下列问题:
(1)该实验 (填“能”或“不能”)探究质量守恒定律,原因是 。
(2)要用如图继续探究质量守恒定律,若药品不变,改变装置的方法是 。若装置不变,改变药品,可选用的一组药品是 (举一例)。
四、探究题
27.氢化镁(化学式为MgH2)是一种常用的焰火剂,遇水易发生反应。某兴趣小组拟用如装置制备氢化镁。
请回答下列问题:
(1)请选择必要的装置,按气体流向的连接顺序为___(填仪器接口处的字母编号)。
(2)用连接好的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞,___(请按正确的顺序排列下列步骤).
a.加热反应一段时间????????????????????????b.关闭分液漏斗活塞
c.收集气体并检验纯度???????????????????????d.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入热水中,观察到有气泡冒出,该反应的化学方程式为___。
(4)无水氯化钙的作用是___,请简述如何检验E装置的气密性:___。
(5)氢化钠(NaH)也是一种金属氢化物,常用作缩合剂、烷化剂。请你设计一个实验,用化学方法区分氢化钠与氢化镁,写出简要的实验步骤及观察到的现象:___。
参考答案
1.C
【分析】
根据质量守恒定律化学反应前后原子种类不变,原子数目没有增减,从而确定化学式。
【详解】
根据质量守恒定律化学反应前后原子种类不变,原子数目没有增减,在化学方程式反应前后,碳原子、氢原子、钠原子个数都已相等,而反应后氧原子个数为12个,反应前氧原子个数为6个,故3x个分子中氧原子为6个,故一个X分子中含有2个氧原子,故为氧气
故选C。
【点睛】
掌握化学反应前后原子种类和数目不变是正确解答本题的关键。
2.C
【解析】
【分析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,根据质量守恒定律,参加反应的反应物的总质量等于生成的生成物的总质量。
【详解】
根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气逸散,所以反应后质量的减少量就是生成的氧气的质量;由于残余固体的质量为c?g中包含着二氧化锰,所以在计算质量的减少量时,必须是氯酸钾的质量加上二氧化锰的质量再减去残余固体质量,所以生成氧气的质量为(a+b-c)克,故选C。
3.C
【详解】
A、由于分子之间存在间隙,1L水与1L酒精混合后所得混合液体的体积小于2L,故A不正确;
B、碳相对原子质量12,氧气为32,所以1.2克碳消耗3.2克氧气,故B不正确;
C、硫在氧气中燃烧生成二氧化硫,根据反应的化学方程式中两物质的质量关系32:32可知,1g硫粉在lg氧气中燃烧恰好完全反应,根据质量守恒定律,反应后生成2g二氧化硫,故C正确;
D、氯酸钾和二氧化锰加热生成氯化钾和氧气,由化学反应方程式可知,245份的氯酸钾生成149份的氯化钾,1克氯酸钾与1克二氧化锰混合,充分加热后所得固体质量为0.6克,故D不正确。故选C。
4.A
【分析】
反应物与生成物相对原子(分子)质量乘以前面的计量数之比。
【详解】
化学方程式为,反应物C、CO2与生成的CO的质量比为。
5.D
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【详解】
A.气体符号只能标注在生成物一侧,正确的化学方程式为,故错误;
B.在此反应中,二氧化锰是催化剂,属于反应条件,正确的化学方程式为,故错误;
C.铁丝在氧气中燃烧的产物是四氧化三铁,正确的化学方程式为,故错误;
D.磷与氧气在点燃的条件下反应生成五氧化二磷,该化学方程式书写完全正确。
故选D。
6.B
【详解】
由表格信息可知反应后乙质量增加了25克,是生成物;丁质量减少了20克,是反应物;丙质量不变,可能是催化剂或者是杂质,反应物还少5克,所以甲是反应物,所以反应后物质甲的质量为13g,反应物是甲和丁,生成物是乙。反应中乙、丁的质量比25:20=5:4
故选B。
7.C
【分析】
A、根据氧化物的定义分析;
B、该反应使有害气体转化为无害物质;
C、反应前后分子个数改变;
D、反应物和生成物中只有氮气是单质.
【详解】
A、NO和CO都是由氧元素和和另一元素组成的氧化物,故正确;
B、该反应使有害气体转化为无害物质,正确;
C、反应前后分子个数改变,故错误;
D、反应物和生成物中只有氮气是单质,故正确;
故选C。
【点睛】
掌握氧化物的概念、质量守恒定律、化学方程式的意义是正确解答本题的关键。
8.D
【详解】
A、由化学方程式可知,反应①条件是催化剂,反应②条件是加热,则反应①和反应②是在不同条件下进行的,故A正确;
B、由化学方程式可知,反应①和反应②都有氧气生成,故B正确;
C、由化学方程式可知,反应①和反应②的反应物中都含氧元素,故C正确;
D、根据化学方程式不能判断是否放热,故D不正确。故选D。
9.D
【详解】
A. 化学反应过程中原子的种类不变,此选项错误;
B. 化合物中各元素化合价的代数和为零,反应后有单质生成,单质中元素的化合价为零,反应后碳元素、氮元素的化合价发生了改变,此选项错误;
C. 反应后有氮气生成,氮气属于单质,此选项错误;
D. 图中有一氧化碳、一氧化氮、二氧化碳三种不同的氧化物,此选项正确。
故选D。
10.C
【解析】
【分析】
由质量守恒定律可知,在化学反应的前后各元素的原子个数是相等的。
【详解】
化学反应的实质是原子重新结合生成新的分子,由质量守恒定律可知,在化学反应的前后各元素的原子个数是相等的,则化学反应前后各元素的原子总数相等,即已配平,反之,若化学反应前后各元素的原子总数不相等,则未配平,化学方程式配平与化学计量数之和、物质的状态、元素种类无关,故选C。
11.B
【详解】
A、方程式两边原子个数不守恒,未配平,不符合题意;
B、方程式满足质量守恒定律且条件、气体符号书写无误,符合题意;
C、反应条件为点燃,不符合题意;
D、方程式未配平,应为,不符合题意。故选B。
12.B
【解析】
试题分析:生成物二氧化硫、水中含有S,H,O三种元素,则反应物中也一定含有这三种元素.物质在空气中燃烧是和空气中的氧气反应,氧气由氧元素组成,则S,H一定是从该物质中来,而该物质中是否含有氧元素无法确定,而含有硫和氢元素的物质一定是硫化物;
故选B
考点:质量守恒定律及其应用.
点评:本题主要考查学生运用质量守恒定律进行推断的能力,掌握质量守恒定律的实质是解题的关键.
13.D
【解析】
CH4+2O2CO2+2H2O
14.C
【解析】
据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有6个氧原子、2个碳原子、 12个氢原子、4个钠原子,反应后有2个碳原子、 12个氢原子、12个氧原子、4个钠原子,所以一个X的分子中有2个氧原子;X的化学式为O2 ,选C
15.B
【分析】
根据质量守恒定律与化学方程式,推测X的化学式,根据反应的特点判断反应不是化合反应,根据化合价代数和为零确定N元素的化合价,黑火药由三种物质组成,属于混合物。
【详解】
A、根据质量守恒定律可知,在反应方程式中,X的化学式为,A选项正确,不符合题意;
B、该反应由三种反应物生成两种生成物,不符合化合反应“多变一”的特征,不属于化合反应,B选项不正确,符合题意;
C、中K元素化合价为+1价,O元素化合价为-2价,根据化合价代数和为零,可计算出N元素的化合价为+5价,C选项正确,不符合题意;
D、由题意黑火药由、和三种物质组成,属于混合物,D选项正确,不符合题意。故选B。
16.A
【解析】
试题分析:根据题意,FeO、Fe3O4、Fe2O3的混合物与足量的CO充分反应,生成铁和二氧化碳,由质量守恒定律可知,混合物中铁元素的质量和反应生成的铁的质量相等,故混合物中铁元素、氧元素的质量比="2.1g:(2.9g-2.1g)=21:8" 。由化学式可知,FeO中铁元素和氧元素的质量比=56:12=7:2=21:6,Fe2O3中铁元素和氧元素的质量比=21:9,Fe3O4中铁元素和氧元素的质量比=21:8,因此混合物中 Fe3O4的质量可以为任意值,设混合物中 Fe2O3的质量为x,FeO的质量为y,则
(x ×+y×):(x×+)=21:8
解得 x:y=9:20 即混合物中氧化亚铁的质量不可能大于0.9g,所以,混合物中氧化亚铁的质量可能为0.7g,答案为A。考点:化学方程式的计算
17.D
【详解】
TiCl4+2MgTi+2MgCl2,是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
故选D。
18.C
【详解】
①中反应物是一种,生成物是两种,属于分解反应;
②中反应物和生成物都是一种单质和一种化合物,属于置换反应;
③属于氧化还原反应;
④中反应物和生成物都是一种单质和一种化合物,属于置换反应;
⑤中反应物是三种,生成物是一种,属于化合反应;
⑥中反应物和生成物都是两种化合物,属于复分解反应。
故选C。
19.二氧化硫 2SO2+O2 2SO3
【详解】
(1)由图可知,一个甲分子中含有一个硫原子和两个氧原子,所以甲分子构成的物质是二氧化硫,故填二氧化硫;
(2)由图可知,反应中两个二氧化硫分子与一个氧分子在一定条件下反应生成了两个三氧化硫分子,即该反应为二氧化硫与氧气在一定条件下反应生成三氧化硫,故反应的化学方程式写为:2SO2+O2?2SO3。
20.2.4 H2O+C CO+H2
【详解】
(1)某纯净物X在空气中完全燃烧,学方程反应的化式为X+3O22CO2+2H2O,据质量守恒定律可知,反应前后元素的种类、质量不变,若生成二氧化碳的质量为8.8克,二氧化碳中碳元素的质量与X中碳元素的质量相等,则X中碳元素质量为8.8g=2.4g;
(2)下图是某化学变化的微观示意图(不同圆球代表不同原子)。
据图中信息可知,反应为碳和水在高温下生成一氧化碳和氢气,据质量守恒定律可知,反应前后原子的种类、个数不变,可知该反应的化学方程式:H2O+C CO+H2。
21.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)BaCO3 (3)CaCO3、BaCl2和KOH
【解析】取白色固体溶于水后得到白色沉淀,且沉淀全部溶于盐酸,可得出固体中一定存在碳酸钙,且硫酸钙和氯化钡中最多只能含有其中一种,(要是这两种物质同时存在会生成硫酸钡白色沉淀不溶于盐酸)然后往第一步的滤液中通入CO2气体产生白色沉淀,可得出固体中一定含有氯化钡(与CO2气体反应生成碳酸钡白色沉淀),因此固体中不含硫酸钙。故此固体一定含有CaCO3和BaCl2。
22.(1)3Fe+2O2 Fe3O4
(2)2H2O22H2O+O2↑
(3)CO2+2NH3CO(NH2)2+H2O
【详解】
(1)铁丝在氧气中燃烧生成四氧化三铁,反应的方程式为3Fe+2O2Fe3O4;
(2)过氧化氢溶液在二氧化锰做催化剂的条件下生成氧气和水,反应的方程式为:2H2O2 2H2O+O2↑;
(3)尿素是一种重要的化学肥料,其化学式为CO(NH2)2。工业上,可以在高温高压的条件下,以二氧化碳和NH3为原料制得尿素并生成水,化学方程式为CO2+2NH3 CO(NH2)2+H2O.
23.
【分析】
根据题中的叙述找出反应物、生成物以及反应条件,然后根据方程式的书写原则书写化学方程式。
【详解】
二氧化碳和氨气在高温高压的条件下生成尿素和水,反应的化学方程式为故答案为。
【点睛】
掌握根据给出的反应物和生成物以及反应条件书写化学方程式的方法是正确解答本题的关键。
24.热量 CaO + H2O === Ca(OH)2
【详解】
生石灰与水反应生成氢氧化钙,该过程会放热,从而将鸦片焚毁,故填热量;
生石灰就是氧化钙,氧化钙与水反应生成氢氧化钙,故反应的化学方程式写为:CaO + H2O = Ca(OH)2。
25.(1)A;(2)药品用量少,产生的废弃物也少,操作方便;(3)0.044克
【解析】
(1)A (2分) (2)药品用量少,产生的废弃物也少,操作方便(2分)
(3)解:设实验过程中产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑ (1分)
73 44
0.73克×10% x (1分)
73:44= 0.73克×10%:x (1分)
解得x=0.044克 (1分)
答:实验过程中产生CO2的质量为0.044克。
26.(1)不能;二氧化碳气体逸散于空气中
(2)反应在密闭容器中进行;硫酸铜溶液与氢氧化钠溶液
【详解】
(1)烧杯中的现象是固体逐渐减少,产生气体,生成的二氧化碳气体逸散于空气中,因此反应后观察到天平不平衡,该实验不能探究质量守恒定律;
(2)在反应物不变的前提下,要保持天平平衡,应将反应在密闭容器中进行;若装置不变,改变药品,可选用的一组药品是硫酸铜溶液与氢氧化钠溶液;
故答案为(1)不能;二氧化碳气体逸散于空气中;(2)反应在密闭容器中进行;硫酸铜溶液与氢氧化钠溶液。
27.i e f d c j k a (jk可颠倒) cadb MgH2+2H2O=Mg(OH)2↓+2H2↑ 防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效 检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。 将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH
【分析】
(1)制备氢化镁的原料是镁粉和氢气,用盐酸和锌制取氢气,氢气中混有HCl和水蒸气,先通过氢氧化钠溶液除去HCl,再通过浓硫酸除去水蒸气,即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁,为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸;
(3)有气泡冒出为氢气,氢化镁和水反应,反应物为氢化镁和水,生成物为氢气和氢氧化镁,据此书写方程式;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,能防止空气中的水蒸气进入玻璃管中,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法等;
(5)氢化钠与氢化镁都能与水反应生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁。
【详解】
(1)制备MgH2固体需要制备氢气和镁发生反应,MgH2在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用E装置制备氢气(i ),氯化氢易挥发,制得的氢气中含有氯化氢和水蒸气,先通过氢氧化钠溶液除去HCl(e f),再通过浓硫酸除去水蒸气(d c,注意洗气长管进短管出),即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁(j k,jk可颠倒),为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管,( a,粗管进连气体流入,细管出防止空气中的水蒸气进入),所以装置连接顺序为:i e f d c j k a (jk可颠倒),
故答案为:i?e?f?d?c?j?k?a?(jk可颠倒);
(2)有气体参加加热或燃烧的反应需要首先验纯(C),加热反应一段时间 (a),实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,停止加热,充分冷却(d),关闭分液漏斗活塞(b),故正确的操作顺序为cadb,
故答案为:cadb;
(3)有气泡冒出为氢气,根据原子守恒,氢化镁和水反应,方程式为:MgH2+2H2O=Mg(OH)2↓+2H2↑,
故答案为:MgH2+2H2O=Mg(OH)2↓+2H2↑;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,所以无水氯化钙的作用是防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断,方法:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
故答案为:防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效;方法:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(5)氢化钠与氢化镁都能与水反应,反应分别为:NaH+H2O=NaOH+H2↑,MgH2+2H2O=Mg(OH)2↓+2H2↑,都生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁,将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH,
故答案为:将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH。
【点睛】
本题考查了氢化镁的制备实验,实验装置的连接顺序和分析判断是解答的难点,掌握物质的性质以及制备的原理是解答关键。
