10-11高中化学课时讲练通课件:1.2.1 研究物质性质的方法和程序(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:1.2.1 研究物质性质的方法和程序(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共56张PPT)
【典例1】一小块钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是
①变成白色粉末 ②表面变暗
③变成白色固体 ④变成液体
A.①②③④ B. ②③④①
C.②③①④ D.③②④①
【思路点拨】钠→氧化钠→氢氧化钠→碳酸钠→Na2CO3·10H2O→Na2CO3
【自主解答】选B。
银白色的金属钠在空气中变暗是因为生成Na2O;Na2O吸水生成NaOH固体,NaOH固体吸水潮解形成NaOH溶液,由于NaOH与CO2生成的Na2CO3 ·10H2O易风化,最后生成白色的Na2CO3粉末。
【典例2】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,_________。
过氧化钠跟水反应的化学方程式为______________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法及现象是_________。
用以验证第二条结论的实验方法及现象是_________。
【思路点拨】
(1)从燃烧发生的条件分析;
(2)回忆初中所学的O2的检验方法;
(3)从锥形瓶中气体体积是否膨胀分析。
【自主解答】 (1)脱脂棉燃烧的条件:
①与氧气接触;②温度达到着火点,由此可知Na2O2与
水反应时要放出热量。
(2)由所示装置知,Na2O2与水反应生成的O2由导管P管
口逸出,验证是否有O2产生时,只需将带火星的木条
放在导管P的管口即可;Na2O2与水反应放出的热量使
锥形瓶内气体温度升高,导致气体膨胀,气体由导管
Q的管口逸出,验证该反应是否放热时,只需将导管
Q浸入水中,观察导管Q的管口处是否有气泡冒出即可。
答案:(1)反应放热 2Na2O2+2H2O====4NaOH+O2↑
(2)将带火星的木条放在导管P的管口,木条复燃
将导管Q浸入水中,导管Q的管口处有气泡冒出
知识点一:钠的性质
1.下列有关钠的叙述中,正确的是( )
A.钠可以保存在煤油或者四氯化碳(一种密度比水大的液体,与钠不反应)中
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界中
C.实验后剩余的少量钠粒不可放回原试剂瓶
D.钠着火时可用干冰灭火
【解析】选B。四氯化碳密度比钠大,钠放入其中,浮在表面,不能隔绝空气,故不能保存在四氯化碳中。
2.将一小块钠投入盛有5 mL饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有气体生成
C.试管底部有银白色物质生成
D.溶液变浑浊
【解析】选C。将钠块投入饱和澄清石灰水中,钠与水剧烈反应,首先应观察到钠与水反应的一系列实验现象,而且由于水消耗,水溶液温度升高,Ca(OH)2的溶解度随温度升高而降低,有部分Ca(OH)2固体析出,可观察到溶液变浑浊。
3.已知用金属钠生成氧化钠,可有多种方法:
①4Na+O2====2Na2O
②4Na+CO2====2Na2O+C
③2NaNO2+6Na====4Na2O+N2↑
上述三种方法中最好的是______,原因是______。
解题提示:制备物质时要求反应容易发生,产物单一,没有副反应发生。
【解析】方法①用钠与O2直接反应,生成的Na2O将有
少量发生如下反应:2Na2O+O2====2Na2O2,即产物是Na2O
和Na2O2的混合物。方法②中固体产物中既有C,又有由反应Na2O+CO2====Na2CO3生成的Na2CO3。方法③产物较纯,且不易变质(有氮气作保护气)。
答案:③ 产物中只有Na2O固体生成,且生成的氮气可
以将环境中的氧气排除,确保Na2O不再被氧化
知识点二:过氧化钠的性质
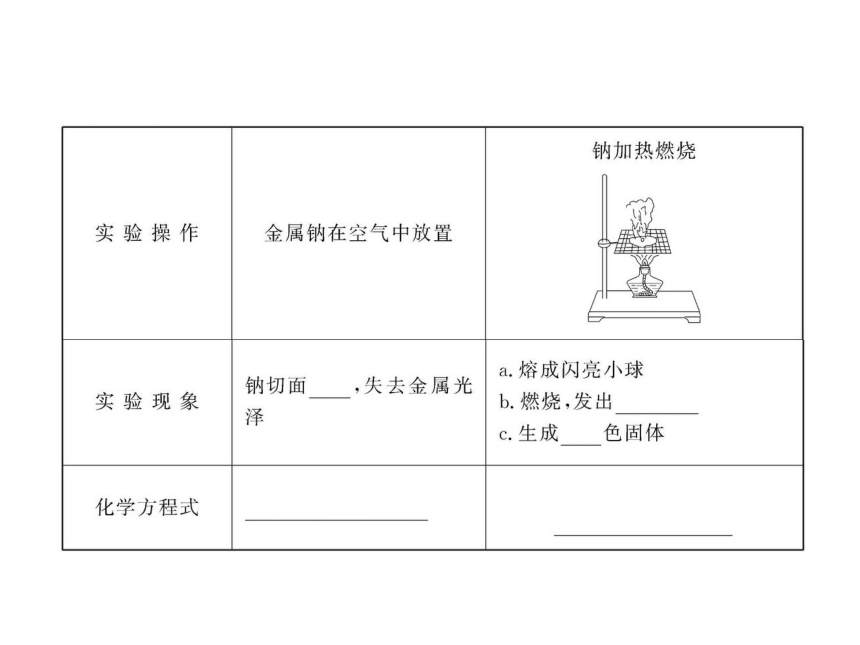
4.将一小块钠放在燃烧匙中加热燃烧,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,火星四射
③燃烧后得白色固体 ④燃烧火焰为黄色
⑤燃烧后得淡黄色固体
A.①② B.①②④ C.①④ D.①④⑤
【解析】选D。钠熔点较低,加热时先熔化;发出黄色火焰,生成淡黄色的过氧化钠。
5.(双选)如图装置,试管b中盛有水,气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内红水退色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位d>c
【解析】选C、D。此题解答时容易因定向思维而错选
A、B,是因为没有注意到浅红色的水是在U形管中而非
试管中。由于发生反应2Na2O2+2H2O====4NaOH+O2↑,
产生的O2使气球膨胀;同时该反应放出大量热量,使
广口瓶中空气受热膨胀而出现U形管中水位d>c。
一、选择题(本题包括5小题,每小题4分,共20分)
1. 将2.3 g钠放入97.7 g水中,生成的溶液中溶质的质量分数为( )
A.等于2.3% B.等于4%
C.大于2.3% D.大于4%
【解析】选D 。由方程式2Na+2H2O====2NaOH+H2↑可得2.3 g 钠可生成NaOH的质量为4.0 g,生成氢气的质量为0.1 g。而溶液总质量= 钠的质量+ 水的质量-氢气的质量<100 g。
2.(双选)将一小块钠投入下列溶液中,既能产生气体又能出现沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化镁溶液
【解析】选C、D。钠与各物质发生的反应分别为
A.2Na+H2SO4====Na2SO4+H2↑
B.2Na+2H2O====2NaOH+H2↑
C.2Na+2H2O+CuSO4====Na2SO4+Cu(OH)2↓+H2↑
D.2Na+2H2O+MgCl2====2NaCl+Mg(OH)2↓+H2↑
3.金属钠着火时可以灭火的物质是( )
A.水 B.干沙
C.煤油 D.二氧化碳
【解析】选B。钠与其燃烧产物过氧化钠均能与水和二氧化碳反应,使燃烧更剧烈。 选项C容易错选,与钠的保存混淆。用煤油灭火,无疑是火上浇油。
4.(2010·深圳高一检测)在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
A.溶液中有晶体析出,Na+数目不变
B.溶液中有气体逸出,Na+数目增加
C.溶质的质量分数增大
D.溶液中Na+数目减少,溶质质量分数未变
【解析】选D。由于Na2O2与水反应:2Na2O2+2H2O====
4NaOH+O2↑,饱和溶液中水减少。但溶解度不变,故会有溶质析出,溶质减少,溶液仍是该温度下的饱和溶液,溶质质量分数不会变化。
5.下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有紫色石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应(密闭)时因温度高会发生燃烧
A.①② B.①③ C.②③ D.①②③
【解析】选D。本题考查的知识点是钠与水反应的过程、本质及产物。钠与水反应产生的氢氧化钠溶液显碱性,能使酚酞试液变红,石蕊试液变蓝。钠与水反应的本质是钠与H+的反应,所以钠先与盐酸中的H+反应。钠在水蒸气中反应产生的是氢气,尽管温度高且反应放热,因无氧气而不能燃烧。
二、非选择题(本题包括1小题,共10分)
6.有一块表面被氧化成氧化钠的金属钠,质量为
0.584 g,放入9.436 g水中,当反应结束时,生成氢气0.02 g。
(1)此金属钠中有多少克钠在与水反应前被氧化
(2)所得氢氧化钠溶液的质量分数是多少?
【解析】由2Na+2H2O====2NaOH + H2↑
46 80 2
m(Na) m(NaOH )1 0.02 g
得m(Na)=0.46 g m(NaOH )1=0.8 g
所以混合物中Na2O的质量为m(Na2O)=0.584 g-0.46 g
=0.124 g
由2Na ~ Na2O ~ 2NaOH
46 62 80
被氧化的m(Na) 0.124 g m(NaOH)2
被氧化成Na2O的金属钠的质量为0.092 g,这部分Na2O溶于水后生成的氢氧化钠的质量m(NaOH )2=0.16 g
所得氢氧化钠溶液中m(NaOH )=0.8 g+0.16 g=0.96 g
溶液的总质量=0.584 g+9.436 g-0.02 g=10 g
氢氧化钠溶液的质量分数=0.96 g/10 g×100%=9.6%
答案:(1)0.092 g (2)9.6%
1.(5分)下列溶液中溶质的质量分数最大的是( )
A.4.6 g Na投入到45.4 g水中
B.6.2 g Na2O投入到43.8 g水中
C.7.8 g Na2O2投入到43.8 g水中
D.8.0 g NaOH投入到42 g水中
【解析】选A。四种溶液溶质均为氢氧化钠,且质量均为8.0 g。关键在于计算溶液的质量。需要注意的是B、C两项,由方程式①Na2O+H2O2====NaOH,②2Na2O2
+2H2O====4NaOH+O2↑将②方程式变形为Na2O+O+H2O
====2NaOH+O可以认为Na2O2比Na2O中多出的氧原子在与水反应时又释放出来了。所以B、C两项中溶液质量与D相同,都为50 g,而A中有气体生成,溶液总质量小于50 g,故质量分数最大。
【解析】
2.(15分)某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝。
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象为____________。
(2)U形管中溶液的颜色_____,说明有_____生成。
(3)铜丝的变化现象为______,说明有_____生成;若去掉后面的装置,简述检验气体的方法________。
(4)若a g钠与b mL水完全反应,则该溶液的溶质的质量分数是____________。
(5)若在U形管中加入的不是水,而是CuSO4溶液,反应后U形管中有什么现象?为什么?
【解析】本题涉及钠的多种性质,如颜色、状态及熔点
低和密度小的特点。钠位于水和煤油界面上,与水发生
反应:2Na+2H2O====2NaOH+H2↑,生成的H2与CuO发生反
应:H2+CuO====Cu+H2O。钠与水反应得NaOH溶液:
2Na+2H2O====2NaOH+H2↑
2×23 2×40 2
a g
则w(NaOH)= =
△
答案:(1)在水和煤油的界面上逐渐变小并作上下跳动
(2)由无色变为红色 NaOH
(3)由黑色变为红色 H2 在玻璃管口处点燃气体,观察气体燃烧时的火焰颜色,是否为蓝色
(4)
(5)有蓝色沉淀生成,并有气泡产生,因为Na与H2O反应生成H2和NaOH,NaOH与CuSO4反应生成蓝色的Cu(OH)2沉淀。
【典例1】一小块钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是
①变成白色粉末 ②表面变暗
③变成白色固体 ④变成液体
A.①②③④ B. ②③④①
C.②③①④ D.③②④①
【思路点拨】钠→氧化钠→氢氧化钠→碳酸钠→Na2CO3·10H2O→Na2CO3
【自主解答】选B。
银白色的金属钠在空气中变暗是因为生成Na2O;Na2O吸水生成NaOH固体,NaOH固体吸水潮解形成NaOH溶液,由于NaOH与CO2生成的Na2CO3 ·10H2O易风化,最后生成白色的Na2CO3粉末。
【典例2】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,_________。
过氧化钠跟水反应的化学方程式为______________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法及现象是_________。
用以验证第二条结论的实验方法及现象是_________。
【思路点拨】
(1)从燃烧发生的条件分析;
(2)回忆初中所学的O2的检验方法;
(3)从锥形瓶中气体体积是否膨胀分析。
【自主解答】 (1)脱脂棉燃烧的条件:
①与氧气接触;②温度达到着火点,由此可知Na2O2与
水反应时要放出热量。
(2)由所示装置知,Na2O2与水反应生成的O2由导管P管
口逸出,验证是否有O2产生时,只需将带火星的木条
放在导管P的管口即可;Na2O2与水反应放出的热量使
锥形瓶内气体温度升高,导致气体膨胀,气体由导管
Q的管口逸出,验证该反应是否放热时,只需将导管
Q浸入水中,观察导管Q的管口处是否有气泡冒出即可。
答案:(1)反应放热 2Na2O2+2H2O====4NaOH+O2↑
(2)将带火星的木条放在导管P的管口,木条复燃
将导管Q浸入水中,导管Q的管口处有气泡冒出
知识点一:钠的性质
1.下列有关钠的叙述中,正确的是( )
A.钠可以保存在煤油或者四氯化碳(一种密度比水大的液体,与钠不反应)中
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界中
C.实验后剩余的少量钠粒不可放回原试剂瓶
D.钠着火时可用干冰灭火
【解析】选B。四氯化碳密度比钠大,钠放入其中,浮在表面,不能隔绝空气,故不能保存在四氯化碳中。
2.将一小块钠投入盛有5 mL饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有气体生成
C.试管底部有银白色物质生成
D.溶液变浑浊
【解析】选C。将钠块投入饱和澄清石灰水中,钠与水剧烈反应,首先应观察到钠与水反应的一系列实验现象,而且由于水消耗,水溶液温度升高,Ca(OH)2的溶解度随温度升高而降低,有部分Ca(OH)2固体析出,可观察到溶液变浑浊。
3.已知用金属钠生成氧化钠,可有多种方法:
①4Na+O2====2Na2O
②4Na+CO2====2Na2O+C
③2NaNO2+6Na====4Na2O+N2↑
上述三种方法中最好的是______,原因是______。
解题提示:制备物质时要求反应容易发生,产物单一,没有副反应发生。
【解析】方法①用钠与O2直接反应,生成的Na2O将有
少量发生如下反应:2Na2O+O2====2Na2O2,即产物是Na2O
和Na2O2的混合物。方法②中固体产物中既有C,又有由反应Na2O+CO2====Na2CO3生成的Na2CO3。方法③产物较纯,且不易变质(有氮气作保护气)。
答案:③ 产物中只有Na2O固体生成,且生成的氮气可
以将环境中的氧气排除,确保Na2O不再被氧化
知识点二:过氧化钠的性质
4.将一小块钠放在燃烧匙中加热燃烧,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,火星四射
③燃烧后得白色固体 ④燃烧火焰为黄色
⑤燃烧后得淡黄色固体
A.①② B.①②④ C.①④ D.①④⑤
【解析】选D。钠熔点较低,加热时先熔化;发出黄色火焰,生成淡黄色的过氧化钠。
5.(双选)如图装置,试管b中盛有水,气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内红水退色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位d>c
【解析】选C、D。此题解答时容易因定向思维而错选
A、B,是因为没有注意到浅红色的水是在U形管中而非
试管中。由于发生反应2Na2O2+2H2O====4NaOH+O2↑,
产生的O2使气球膨胀;同时该反应放出大量热量,使
广口瓶中空气受热膨胀而出现U形管中水位d>c。
一、选择题(本题包括5小题,每小题4分,共20分)
1. 将2.3 g钠放入97.7 g水中,生成的溶液中溶质的质量分数为( )
A.等于2.3% B.等于4%
C.大于2.3% D.大于4%
【解析】选D 。由方程式2Na+2H2O====2NaOH+H2↑可得2.3 g 钠可生成NaOH的质量为4.0 g,生成氢气的质量为0.1 g。而溶液总质量= 钠的质量+ 水的质量-氢气的质量<100 g。
2.(双选)将一小块钠投入下列溶液中,既能产生气体又能出现沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化镁溶液
【解析】选C、D。钠与各物质发生的反应分别为
A.2Na+H2SO4====Na2SO4+H2↑
B.2Na+2H2O====2NaOH+H2↑
C.2Na+2H2O+CuSO4====Na2SO4+Cu(OH)2↓+H2↑
D.2Na+2H2O+MgCl2====2NaCl+Mg(OH)2↓+H2↑
3.金属钠着火时可以灭火的物质是( )
A.水 B.干沙
C.煤油 D.二氧化碳
【解析】选B。钠与其燃烧产物过氧化钠均能与水和二氧化碳反应,使燃烧更剧烈。 选项C容易错选,与钠的保存混淆。用煤油灭火,无疑是火上浇油。
4.(2010·深圳高一检测)在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
A.溶液中有晶体析出,Na+数目不变
B.溶液中有气体逸出,Na+数目增加
C.溶质的质量分数增大
D.溶液中Na+数目减少,溶质质量分数未变
【解析】选D。由于Na2O2与水反应:2Na2O2+2H2O====
4NaOH+O2↑,饱和溶液中水减少。但溶解度不变,故会有溶质析出,溶质减少,溶液仍是该温度下的饱和溶液,溶质质量分数不会变化。
5.下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有紫色石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应(密闭)时因温度高会发生燃烧
A.①② B.①③ C.②③ D.①②③
【解析】选D。本题考查的知识点是钠与水反应的过程、本质及产物。钠与水反应产生的氢氧化钠溶液显碱性,能使酚酞试液变红,石蕊试液变蓝。钠与水反应的本质是钠与H+的反应,所以钠先与盐酸中的H+反应。钠在水蒸气中反应产生的是氢气,尽管温度高且反应放热,因无氧气而不能燃烧。
二、非选择题(本题包括1小题,共10分)
6.有一块表面被氧化成氧化钠的金属钠,质量为
0.584 g,放入9.436 g水中,当反应结束时,生成氢气0.02 g。
(1)此金属钠中有多少克钠在与水反应前被氧化
(2)所得氢氧化钠溶液的质量分数是多少?
【解析】由2Na+2H2O====2NaOH + H2↑
46 80 2
m(Na) m(NaOH )1 0.02 g
得m(Na)=0.46 g m(NaOH )1=0.8 g
所以混合物中Na2O的质量为m(Na2O)=0.584 g-0.46 g
=0.124 g
由2Na ~ Na2O ~ 2NaOH
46 62 80
被氧化的m(Na) 0.124 g m(NaOH)2
被氧化成Na2O的金属钠的质量为0.092 g,这部分Na2O溶于水后生成的氢氧化钠的质量m(NaOH )2=0.16 g
所得氢氧化钠溶液中m(NaOH )=0.8 g+0.16 g=0.96 g
溶液的总质量=0.584 g+9.436 g-0.02 g=10 g
氢氧化钠溶液的质量分数=0.96 g/10 g×100%=9.6%
答案:(1)0.092 g (2)9.6%
1.(5分)下列溶液中溶质的质量分数最大的是( )
A.4.6 g Na投入到45.4 g水中
B.6.2 g Na2O投入到43.8 g水中
C.7.8 g Na2O2投入到43.8 g水中
D.8.0 g NaOH投入到42 g水中
【解析】选A。四种溶液溶质均为氢氧化钠,且质量均为8.0 g。关键在于计算溶液的质量。需要注意的是B、C两项,由方程式①Na2O+H2O2====NaOH,②2Na2O2
+2H2O====4NaOH+O2↑将②方程式变形为Na2O+O+H2O
====2NaOH+O可以认为Na2O2比Na2O中多出的氧原子在与水反应时又释放出来了。所以B、C两项中溶液质量与D相同,都为50 g,而A中有气体生成,溶液总质量小于50 g,故质量分数最大。
【解析】
2.(15分)某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝。
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象为____________。
(2)U形管中溶液的颜色_____,说明有_____生成。
(3)铜丝的变化现象为______,说明有_____生成;若去掉后面的装置,简述检验气体的方法________。
(4)若a g钠与b mL水完全反应,则该溶液的溶质的质量分数是____________。
(5)若在U形管中加入的不是水,而是CuSO4溶液,反应后U形管中有什么现象?为什么?
【解析】本题涉及钠的多种性质,如颜色、状态及熔点
低和密度小的特点。钠位于水和煤油界面上,与水发生
反应:2Na+2H2O====2NaOH+H2↑,生成的H2与CuO发生反
应:H2+CuO====Cu+H2O。钠与水反应得NaOH溶液:
2Na+2H2O====2NaOH+H2↑
2×23 2×40 2
a g
则w(NaOH)= =
△
答案:(1)在水和煤油的界面上逐渐变小并作上下跳动
(2)由无色变为红色 NaOH
(3)由黑色变为红色 H2 在玻璃管口处点燃气体,观察气体燃烧时的火焰颜色,是否为蓝色
(4)
(5)有蓝色沉淀生成,并有气泡产生,因为Na与H2O反应生成H2和NaOH,NaOH与CuSO4反应生成蓝色的Cu(OH)2沉淀。
