人教版高中化学必修一第四章《非金属及其化合物》复习 表格教案
文档属性
| 名称 | 人教版高中化学必修一第四章《非金属及其化合物》复习 表格教案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-02 14:46:11 | ||
图片预览

文档简介
课题:第四章 本章专题总结 授课班级
课 时
教
学
目
的 知识
与
技能 1、掌握Si、Cl2及其化合物的重要用途及性质
2、了解教材编排的顺序,由用途到性质到制法。
3、进一步了解S、N的化合物的重要用途,掌握其重要化学性质。
4、了解环境保护的重要意义
过程
与
方法 1、自主学习,自主归纳Si、氯气单质及其化合物的用途,引导学生自主归纳、整理SO2、NO2、H2SO4、HNO3、NH3的用途及性质。
2、通过典型例题的分析、学习,使学生体会“例题”的重要性,掌握分析问题、解决问题的方法
3、探究与活动,通过复习,了解探究过程的意义和方法,培养从形象思维到抽象思维的能力。
情感
态度
价值观 1、通过复习,进一步培养学生爱国主义情感。
2、树立正确的人生观、价值观;热爱科学、热爱社会、关注生活
3、通过复习,培养学生辩证唯物主义观点,养成理论联系实际的好习惯,使学生崇尚科学,关注社会,进一步增强环保意识。
重 点 1、归纳能力、比较能力的培养;
2、NH3性质实验室制法;H2SO4、HNO3的性质和用途
难 点 1、培养举一反三的能力,培养发散思维、创新思维的能力;
2、H2SO4、HNO3的化学性质,NH4+的检验;
3、使学生树立环保意识,形成辩证唯物主义世界观
知 识
结
构
与
板
书
设
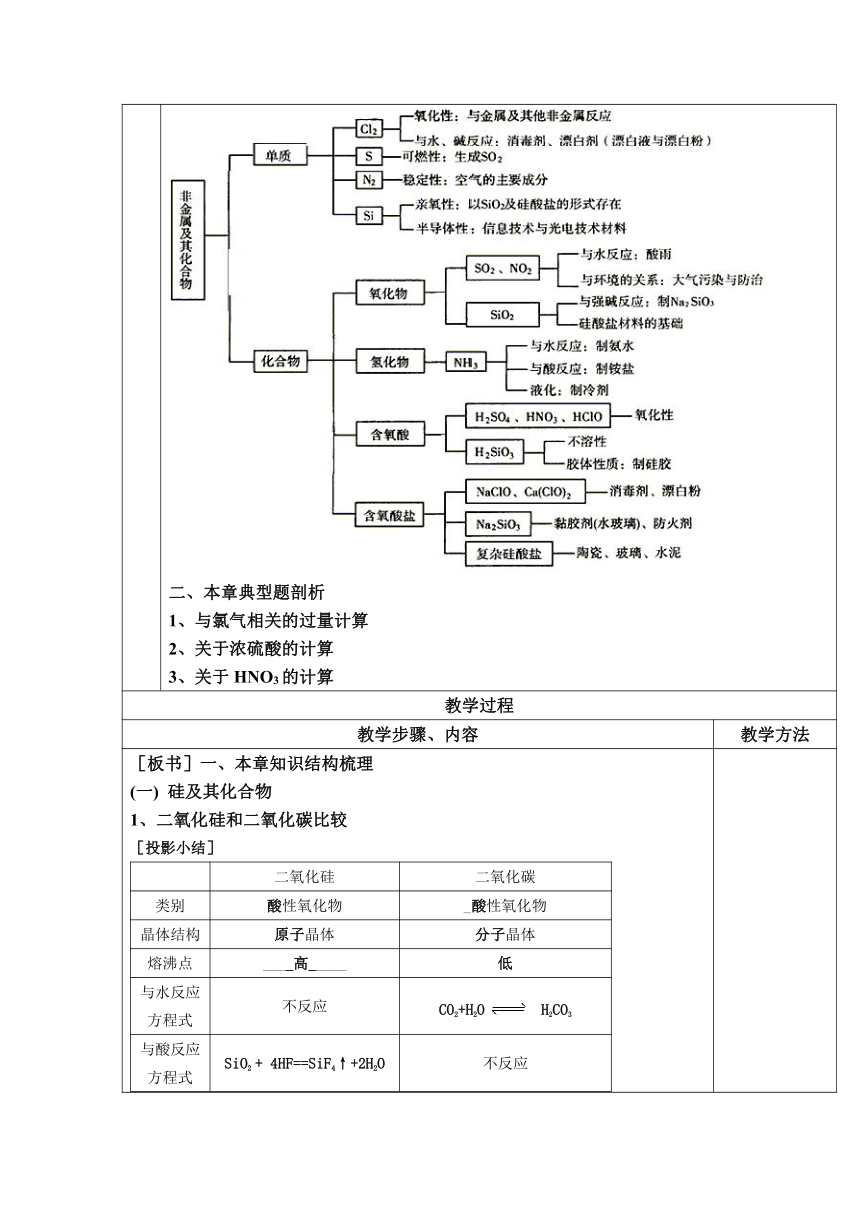
计 一、本章知识结构梳理
一、本章知识结构梳理
(一) 硅及其化合物
1、二氧化硅和二氧化碳比较
2、硅以及硅的化合物的用途
(二) 氯
3、液氯、新制的氯水和久置的氯水比较
4、氯气的性质
(三) 硫、氮
5、二氧化硫的性质
6、浓硫酸和浓硝酸的性质
7、氨气、氨水与铵盐的性质
二、本章典型题剖析
1、与氯气相关的过量计算
2、关于浓硫酸的计算
3、关于HNO3的计算
教学过程
教学步骤、内容 教学方法
[板书]一、本章知识结构梳理 (一) 硅及其化合物
1、二氧化硅和二氧化碳比较
[投影小结]
二氧化硅
二氧化碳
类别
酸性氧化物
_酸性氧化物
晶体结构
原子晶体
分子晶体
熔沸点
____高_____
低
与水反应方程式
不反应
CO2+H2O H2CO3
与酸反应方程式
SiO2 + 4HF==SiF4↑+2H2O
不反应
与烧碱反应方程式
SiO2+2NaOH == Na2SiO3+H2O
少:2NaOH+CO2==Na2CO3+H2O
过:NaOH+CO2==NaHCO3
与CaO反应方程式
SiO2+CaOCaSiO3
CaO+CO2==CaCO3
存在状态
水晶、玛瑙、石英、硅石、沙子
人和动物排放
[板书]2、硅以及硅的化合物的用途
[投影小结]
物质
用途
硅单质
半导体材料、光电池(计算器、人造卫星、登月车、探测器)
SiO2
饰物、仪器、光导纤维、玻璃
硅酸钠
矿物胶
SiC
砂纸、砂轮的磨料
[板书](二) 氯
3、液氯、新制的氯水和久置的氯水比较
[投影小结]
液氯
新制氯水
久置氯水
分类
纯净物
混合物
混合物
颜色
黄绿色
黄绿色
无色
成分
Cl2
Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH―
H+、Cl―、H2O、
极少量的OH―
稀盐酸
性质
氧化性
氧化性、酸性、漂白性
酸性
[板书]4、氯气的性质
[投影小结]
与金属钠反应方程式
2Na+Cl2 2NaCl
与金属铁反应方程式
2Fe+3Cl2 2FeCl3
与金属铜反应方程式
Cu+Cl2 CuCl2
与氢气反应方程式
H2+Cl2 2HCl;H2+Cl2 2HCl
与水反应方程式
H2O +Cl2 ==HCl+HClO
制漂白液反应方程式
Cl2+2NaOH==NaCl+NaClO+H2O
制漂白粉反应方程式
2Cl2 +2Ca(OH)2==CaCl2 +Ca(ClO)2 +2H2O
实验室制法
MnO2+4HCl(浓)MnCl2 +Cl2 ↑+2H2O
氯离子的检验试剂以及反应方程式
AgNO3溶液
Ag++Cl―==AgCl
[板书](三) 硫、氮
5、二氧化硫的性质
[投影小结]
物理性质
颜色状态
密度
毒性
黄绿色
比空气___大___
有毒
化学性质
酸性
与水反应方程式
SO2+H2O H2SO3
与烧碱反应方程式
SO2+2NaOH==Na2SO3 +H2O
Na2SO3+SO2+H2O==2NaHSO3
SO2+NaOH==NaHSO3
漂白性
漂白原理:由于它能跟某些有色物质生成:无色物质
曾学过的具有漂白性的物质
吸附漂白:活性炭
氧化漂白:HClO、O3、Na2O2
还原性
与氧气反应方程式
2SO2 + O2 === 2SO3
与氯水反应方程式
SO2 + Cl2 +2H2O == H2SO4+2HCl
氧化性
与硫化氢反应方程式
SO2+2H2S == 3S↓+2H2O
[板书]6、浓硫酸和浓硝酸的性质
[投影小结]
浓硫酸
浓硝酸
相同点
与Cu反应
Cu+2H2SO4(浓)CuSO4+ SO2 ↑+2H2O
Cu+4HNO3 (浓)==Cu(NO3)2 +2NO2 ↑+2H2O
3Cu+8HNO3(稀) == 3Cu(NO3)2 +2NO↑+4H2O
与木炭反应
C + 2H2SO4(浓) CO2↑+2SO2↑+2H2O
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与铁铝反应
发生钝化现象,所以可以用铁制或铝制容器来存放冷的浓硫酸和浓硝酸
异同点
① 吸水 性——干燥剂
②脱水性——蔗糖变黑
王水:浓硝酸和浓盐酸(__1__:3___)
[板书]7、氨气、氨水与铵盐的性质
[投影小结]
氨气的物理性质
颜色状态
密度
水溶性
无色有刺激性气味的气体
比空气__小___
易溶(1:_700_)可以形成喷泉,水溶液呈_碱_性。
氨气的化学性质
与水反应方程式
NH3+H2O NH3·H2O NH4++OH―
与盐酸反应方程式
NH3 + HCl == NH4Cl
实验室制法
Ca(OH)2+2NH4ClCaCl2 +2NH3 ↑+2H2O
氨水成分
NNH3 、NH3·H2O 、H2O 、NH4+、OH―、极少量的H+
铵盐
物理性质:铵盐都是_无色_色晶体,____能_____溶于水
化学性质
氯化铵分解反应方程式
NH4ClNH3 + HCl
碳酸氢铵分解反应方程式
NH4HCO3 NH3 ↑+ H2O +CO2 ↑
课 时
教
学
目
的 知识
与
技能 1、掌握Si、Cl2及其化合物的重要用途及性质
2、了解教材编排的顺序,由用途到性质到制法。
3、进一步了解S、N的化合物的重要用途,掌握其重要化学性质。
4、了解环境保护的重要意义
过程
与
方法 1、自主学习,自主归纳Si、氯气单质及其化合物的用途,引导学生自主归纳、整理SO2、NO2、H2SO4、HNO3、NH3的用途及性质。
2、通过典型例题的分析、学习,使学生体会“例题”的重要性,掌握分析问题、解决问题的方法
3、探究与活动,通过复习,了解探究过程的意义和方法,培养从形象思维到抽象思维的能力。
情感
态度
价值观 1、通过复习,进一步培养学生爱国主义情感。
2、树立正确的人生观、价值观;热爱科学、热爱社会、关注生活
3、通过复习,培养学生辩证唯物主义观点,养成理论联系实际的好习惯,使学生崇尚科学,关注社会,进一步增强环保意识。
重 点 1、归纳能力、比较能力的培养;
2、NH3性质实验室制法;H2SO4、HNO3的性质和用途
难 点 1、培养举一反三的能力,培养发散思维、创新思维的能力;
2、H2SO4、HNO3的化学性质,NH4+的检验;
3、使学生树立环保意识,形成辩证唯物主义世界观
知 识
结
构
与
板
书
设
计 一、本章知识结构梳理
一、本章知识结构梳理
(一) 硅及其化合物
1、二氧化硅和二氧化碳比较
2、硅以及硅的化合物的用途
(二) 氯
3、液氯、新制的氯水和久置的氯水比较
4、氯气的性质
(三) 硫、氮
5、二氧化硫的性质
6、浓硫酸和浓硝酸的性质
7、氨气、氨水与铵盐的性质
二、本章典型题剖析
1、与氯气相关的过量计算
2、关于浓硫酸的计算
3、关于HNO3的计算
教学过程
教学步骤、内容 教学方法
[板书]一、本章知识结构梳理 (一) 硅及其化合物
1、二氧化硅和二氧化碳比较
[投影小结]
二氧化硅
二氧化碳
类别
酸性氧化物
_酸性氧化物
晶体结构
原子晶体
分子晶体
熔沸点
____高_____
低
与水反应方程式
不反应
CO2+H2O H2CO3
与酸反应方程式
SiO2 + 4HF==SiF4↑+2H2O
不反应
与烧碱反应方程式
SiO2+2NaOH == Na2SiO3+H2O
少:2NaOH+CO2==Na2CO3+H2O
过:NaOH+CO2==NaHCO3
与CaO反应方程式
SiO2+CaOCaSiO3
CaO+CO2==CaCO3
存在状态
水晶、玛瑙、石英、硅石、沙子
人和动物排放
[板书]2、硅以及硅的化合物的用途
[投影小结]
物质
用途
硅单质
半导体材料、光电池(计算器、人造卫星、登月车、探测器)
SiO2
饰物、仪器、光导纤维、玻璃
硅酸钠
矿物胶
SiC
砂纸、砂轮的磨料
[板书](二) 氯
3、液氯、新制的氯水和久置的氯水比较
[投影小结]
液氯
新制氯水
久置氯水
分类
纯净物
混合物
混合物
颜色
黄绿色
黄绿色
无色
成分
Cl2
Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH―
H+、Cl―、H2O、
极少量的OH―
稀盐酸
性质
氧化性
氧化性、酸性、漂白性
酸性
[板书]4、氯气的性质
[投影小结]
与金属钠反应方程式
2Na+Cl2 2NaCl
与金属铁反应方程式
2Fe+3Cl2 2FeCl3
与金属铜反应方程式
Cu+Cl2 CuCl2
与氢气反应方程式
H2+Cl2 2HCl;H2+Cl2 2HCl
与水反应方程式
H2O +Cl2 ==HCl+HClO
制漂白液反应方程式
Cl2+2NaOH==NaCl+NaClO+H2O
制漂白粉反应方程式
2Cl2 +2Ca(OH)2==CaCl2 +Ca(ClO)2 +2H2O
实验室制法
MnO2+4HCl(浓)MnCl2 +Cl2 ↑+2H2O
氯离子的检验试剂以及反应方程式
AgNO3溶液
Ag++Cl―==AgCl
[板书](三) 硫、氮
5、二氧化硫的性质
[投影小结]
物理性质
颜色状态
密度
毒性
黄绿色
比空气___大___
有毒
化学性质
酸性
与水反应方程式
SO2+H2O H2SO3
与烧碱反应方程式
SO2+2NaOH==Na2SO3 +H2O
Na2SO3+SO2+H2O==2NaHSO3
SO2+NaOH==NaHSO3
漂白性
漂白原理:由于它能跟某些有色物质生成:无色物质
曾学过的具有漂白性的物质
吸附漂白:活性炭
氧化漂白:HClO、O3、Na2O2
还原性
与氧气反应方程式
2SO2 + O2 === 2SO3
与氯水反应方程式
SO2 + Cl2 +2H2O == H2SO4+2HCl
氧化性
与硫化氢反应方程式
SO2+2H2S == 3S↓+2H2O
[板书]6、浓硫酸和浓硝酸的性质
[投影小结]
浓硫酸
浓硝酸
相同点
与Cu反应
Cu+2H2SO4(浓)CuSO4+ SO2 ↑+2H2O
Cu+4HNO3 (浓)==Cu(NO3)2 +2NO2 ↑+2H2O
3Cu+8HNO3(稀) == 3Cu(NO3)2 +2NO↑+4H2O
与木炭反应
C + 2H2SO4(浓) CO2↑+2SO2↑+2H2O
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与铁铝反应
发生钝化现象,所以可以用铁制或铝制容器来存放冷的浓硫酸和浓硝酸
异同点
① 吸水 性——干燥剂
②脱水性——蔗糖变黑
王水:浓硝酸和浓盐酸(__1__:3___)
[板书]7、氨气、氨水与铵盐的性质
[投影小结]
氨气的物理性质
颜色状态
密度
水溶性
无色有刺激性气味的气体
比空气__小___
易溶(1:_700_)可以形成喷泉,水溶液呈_碱_性。
氨气的化学性质
与水反应方程式
NH3+H2O NH3·H2O NH4++OH―
与盐酸反应方程式
NH3 + HCl == NH4Cl
实验室制法
Ca(OH)2+2NH4ClCaCl2 +2NH3 ↑+2H2O
氨水成分
NNH3 、NH3·H2O 、H2O 、NH4+、OH―、极少量的H+
铵盐
物理性质:铵盐都是_无色_色晶体,____能_____溶于水
化学性质
氯化铵分解反应方程式
NH4ClNH3 + HCl
碳酸氢铵分解反应方程式
NH4HCO3 NH3 ↑+ H2O +CO2 ↑
