人教版高中化学必修一4.2富集在海水中的元素——氯 教案
文档属性
| 名称 | 人教版高中化学必修一4.2富集在海水中的元素——氯 教案 |

|
|
| 格式 | doc | ||
| 文件大小 | 75.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-02 14:55:28 | ||
图片预览



文档简介
富集在海水中的元素氯——氯水组成及性质的探究
一.【教学目标】
1. 知识与技能目标
(1) 掌握氯水的组成及形成原理;
(2) 掌握氯水的化学性质,并掌握歧化反应的定义本质;
(3) 了解氯水在生活中的运用。
2. 过程与方法目标
(1) 通过对氯水组成和性质的探究,学习由现象探求本质的科学思维和实验方法;
(2) 通过对氯水性质的学习,使学生了解典型非金属的一般性质,初步掌握元素化合物的学习方法。
3. 情感、态度与价值观目标
(1) 通过实验研究氯水组成及其性质,激发学生的学习兴趣,培养学生热爱化学和热爱生活的良好品质;
(2) 在理解学习氯水组成及其性质的过程中,体验借助原有的化学知识和原理掌握新知识的成就感;
(3) 辩证认识化学在人类社会发展中的作用,初步形成科学、社会、环境之间和谐、可持续发展的科学发展观。
二.【教材分析】
1. 教学内容分析
“富集在海水中的氯元素”隶属人教版必修一第三章“非金属及其化合物”第二节内容。在此之前,学生在初中阶段已经学习了一些元素化合物知识,对氯元素的简单化合物有一定的了解;在高中化学必修一第二章第二节学习了离子反应(特别是复分解型)发生的条件以及离子方程式的书写,对常见溶液的酸碱有感性的认识;在第二章第三节学习了氧化还原反应,了解了氧化还原反应的实质及其方程式的书写;在本节第一课时,已经学习了氯气的化学性质以及其氧化性。在此基础上再来探究氯水的组成及性质,这样的安排既能促进学生的认知发展,又能使学生对离子反应和氧化还原反应的具体应用加深认识。同时,氯水性质的相关知识又和后续含氯消毒液紧密相连的。从知识结构上讲,氯水的形成原理有引出了高中化学又一类重要的氧化还原反应——歧化反应,通过学习氯水的组成和性质,有利于学生构建更完整的氧化还原思维结构。
2. 学情分析
学生已掌握了石蕊试纸的使用以及氯离子的检验方法,也掌握了氧化还原反应的实质及其方程式的书写,在此基础上引发学生自行思考设计检验“氯水中是否发生化学反应”以及“氯水漂白性原因”的实验,并在回顾氧化还原方程式书写的基础上,引导学生写出氯水形成原理方程式,可以让学生从中体会到用实验探究事物本质的科学方法,并体验到借助已有化学知识和原理掌握新知识的成就感。
3. 重难点分析
[教学重点]
(1)氯水的形成原理
(2)次氯酸的性质
[教学难点]
(1)氯水组成的探究
三.【设计思路】
如何将三维教学目标落实到教学中,是设计教学流程的指导思想。本节教学流程重要通过以下三个环节反应这一思想。
环节一:通过提问的方式引发学生思考为什么要在自来水中加入少量氯气,并引导学生实验探究氯气与水是否发生化学反应。
环节二:进一步询问学生氯气与水反应的可能产物,并根据氯水具有漂白性的现象,进一不引导学生设计实验探究氯水中具有漂白性的物质。
环节三:借助实验结果,引出次氯酸,此时通过提问的方式引导学生回顾氧化还原反应方程式的书写,得出氯水形成的原理方程式。根据次氯酸的性质引导学生分析新制与久制氯水的成分变化。
环节四:让学生分析总结氯水的性质,即可以检验学生的学习成果又可以让学生展示自己的学习成果。通过让学生课后预习溴和碘的相关知识,进一步学习体会元素化学的学习方法并培养学生举一反三的能力。
四.【教学过程】
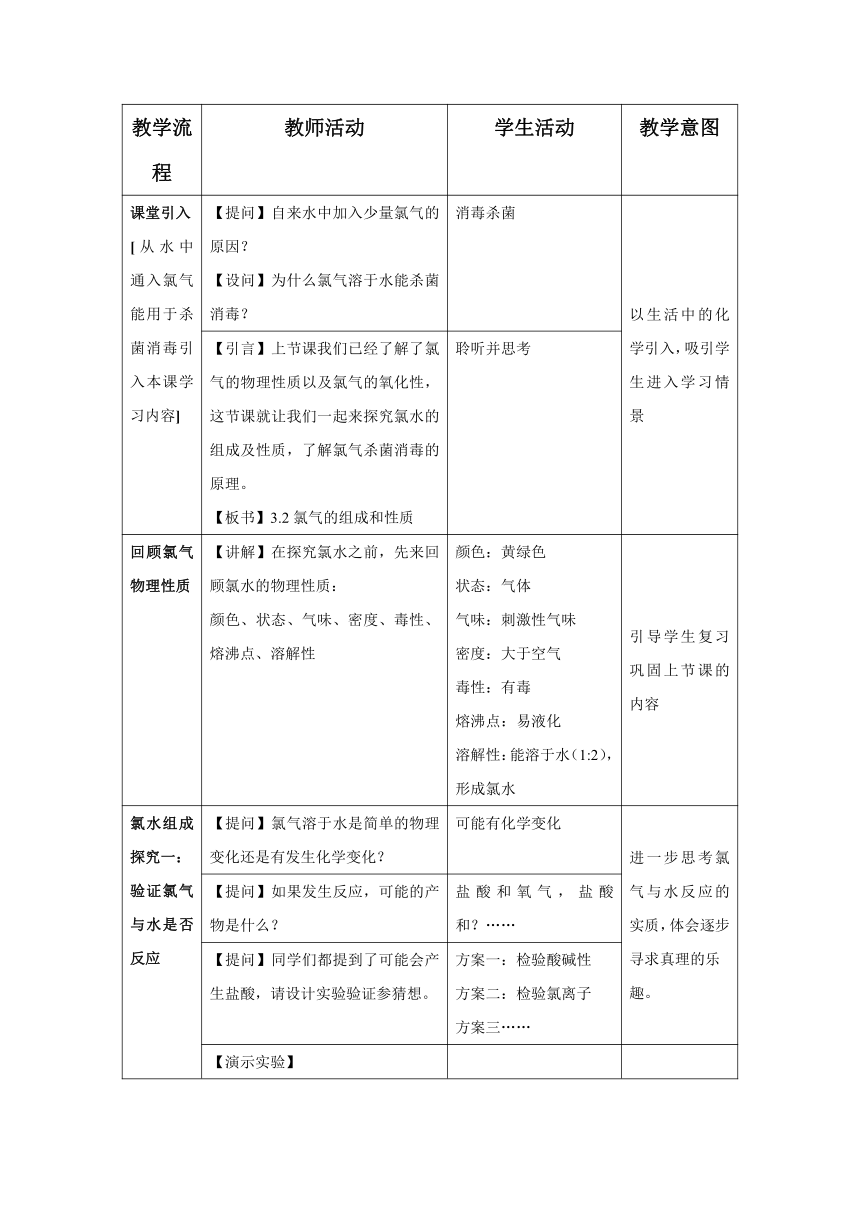
教学流程 教师活动 学生活动 教学意图
课堂引入 [从水中通入氯气能用于杀菌消毒引入本课学习内容] 【提问】自来水中加入少量氯气的原因?
【设问】为什么氯气溶于水能杀菌消毒? 消毒杀菌 以生活中的化学引入,吸引学生进入学习情景
【引言】上节课我们已经了解了氯气的物理性质以及氯气的氧化性,这节课就让我们一起来探究氯水的组成及性质,了解氯气杀菌消毒的原理。
【板书】3.2氯气的组成和性质 聆听并思考
回顾氯气物理性质 【讲解】在探究氯水之前,先来回顾氯水的物理性质:
颜色、状态、气味、密度、毒性、熔沸点、溶解性 颜色:黄绿色
状态:气体
气味:刺激性气味
密度:大于空气
毒性:有毒
熔沸点:易液化
溶解性:能溶于水(1:2),形成氯水 引导学生复习巩固上节课的内容
氯水组成探究一: 验证氯气与水是否反应
【提问】氯气溶于水是简单的物理变化还是有发生化学变化? 可能有化学变化 进一步思考氯气与水反应的实质,体会逐步寻求真理的乐
趣。
【提问】如果发生反应,可能的产物是什么? 盐酸和氧气,盐酸和?……
【提问】同学们都提到了可能会产生盐酸,请设计实验验证参猜想。
方案一:检验酸碱性
方案二:检验氯离子
方案三……
【演示实验】
检验酸碱性:
用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,石蕊试纸变红
检验氯离子:
用胶头滴管吸取少量硝酸银溶液置于试管中,在用胶头滴管吸取少量氯水滴到硝酸银溶液中,有白色沉淀生成。
【提问】根据现象得出的实验结论是什么?
观察并思考
氯气能与水反应,产物有氯离子、氢离子……
氯水组成探究二: 检验氯水中具有漂白性的微粒
【提问+展示】我们再回过头来看看刚才测氯水的石蕊试纸,有什么变化?
【提问】说明氯水有什么性质? 试纸变白了
氯水具有漂白性 引发学生思考,
激发学生探索
化学反应过程
的热情
【提问】氯水中具有漂白性的物质是什么? 可能是氯水中溶解的氯气 ;也可能是氯气与水反应生成的新的物质
【提问】请设计实验,验证氯水中具有漂白性的物质 将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,观察现象。
【视频演示】将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,干燥红花无明显现象;湿润红花褪色。
【提问】根据实验现象,我们可以得出什么结论? 观看教师演示实验。
得出结论: 有漂白性的物质不是氯气,而是氯气与水反应生成的新物质,填写实验报告。 培养学生的观察能力,学习实验的正确操作方法。
归纳氯水的组成和性质 【讲解】根据现有的知识,我们很难再去探究新的物质到底是什么。进一步的实验表明,这个物质是次氯酸。请各位同学在学案上写出氯气与水的方程式。
培养学生根据已有知识推到总结得出结论的能力。
【设问】现在,我们来总结一下氯水的成分了。
【板书】 氯水的成分:分子:Cl2、H2O、 HClO;离子:H+、Cl-、ClO-、 OH- 思考回答氯水的成分。
【讲解】氯气和水反应生成次氯酸和盐酸,这是我们新接触的一个反应,然我们来看看次氯酸的性质。
(1)弱酸性
(2)不稳定性
(3)强氧化性 学习次氯酸的性质
思考其性质与氯水性质之间的联系
【提问】根据次氯酸的不稳定性,同学们想一下,久制氯水的会发生什么变化?(成分、PH) 久制氯水氯水的成分:
分子:Cl2、H2O
离子:H+、Cl-、OH-
PH增大
【讲解】根据次氯酸的性质,我们回过头来看看课前老师提出的问题,自来水中通入氯气能用来杀菌消毒正是因为它和水反应生成了次氯酸。
实际上,在我们日常的饮用水中一升水中大约通入的是0.002g的氯气,因此我们可以想象,它产生的次氯酸和需要的氯气量都很少。
但近几年来的科学研究也表明,氯气可能会和水中的某些有机物发生反应,在人体中产生一些有害的物质,所以现在科学家正在研究要用新型的消毒剂,比如臭氧、二氧化氯等一些物质来代替氯气给自来水消毒。 了解次氯酸和氯水的性质,知道了氯水中杀菌消毒和具有漂白性的物质是次氯酸。
了解自来水通氯气的原因,知道了通微量氯气对人体没有太大伤害。
理解体会科学是把双刃剑,对化学研究好奇向往。
培养学生正确
的化学观,激发学生对于化学研究的兴趣。
总结本课内容 【总结】氯气与水发生反应产生次氯酸而使氯水具有杀菌消毒和漂白作用。
请同学们课后思考同为卤素的溴和碘又有那些性质,也们也会和水反应吗?如果会,产物有是什么? 回顾氯气与水的反应,以及氯水的性质。
课后预习有关溴和碘的相关知识。
使学生进一步体会元素化学的学习方法并培养学生类比的能力。
附件一:
氯水的组成探究 ——实验报告(学生用)
编号 实验名称 实验操作 实验现象 实验分析
1 验证氯气与水是否反应:
2 验证氯气与水是否反应:
3
氯气与水反应方程式
氯水的组成
氯水的性质:
附件二:
氯水的组成探究 ——实验报告(教师用)
编号 实验名称 实验操作 实验现象 实验分析
1 验证氯气与水是否反应:测定溶液酸碱性 用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,观察现象。 蓝色石蕊试纸变红 溶液显酸性
2 验证氯气与水是否反应:检验氯离子
用胶头滴管吸取少量硝酸银溶液置于试管中,在用胶头滴管吸取少量氯水滴到硝酸银溶液中,观察现象。 出现白色沉淀
溶液中存在氯离子
3 检验氯水中具有漂白性的微粒
将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,观察现象。 干燥红花无明显现象;湿润红花褪色 有漂白性的物质不是氯气,而是氯气与水反应生成的新物质。
氯气与水反应方程式
氯水的组成 新制:水分子、氯气分子、氢离子、氢氧根离子、氯离子、次氯酸分子、次氯酸根离子
久制:水分子、氯气分子、氧气分子、氢离子、氢氧根离子、氯离子
氯水的性质: (1)弱酸性:比碳酸的酸性弱
(2)不稳定性:
(3)强氧化性(杀菌、消毒)
一.【教学目标】
1. 知识与技能目标
(1) 掌握氯水的组成及形成原理;
(2) 掌握氯水的化学性质,并掌握歧化反应的定义本质;
(3) 了解氯水在生活中的运用。
2. 过程与方法目标
(1) 通过对氯水组成和性质的探究,学习由现象探求本质的科学思维和实验方法;
(2) 通过对氯水性质的学习,使学生了解典型非金属的一般性质,初步掌握元素化合物的学习方法。
3. 情感、态度与价值观目标
(1) 通过实验研究氯水组成及其性质,激发学生的学习兴趣,培养学生热爱化学和热爱生活的良好品质;
(2) 在理解学习氯水组成及其性质的过程中,体验借助原有的化学知识和原理掌握新知识的成就感;
(3) 辩证认识化学在人类社会发展中的作用,初步形成科学、社会、环境之间和谐、可持续发展的科学发展观。
二.【教材分析】
1. 教学内容分析
“富集在海水中的氯元素”隶属人教版必修一第三章“非金属及其化合物”第二节内容。在此之前,学生在初中阶段已经学习了一些元素化合物知识,对氯元素的简单化合物有一定的了解;在高中化学必修一第二章第二节学习了离子反应(特别是复分解型)发生的条件以及离子方程式的书写,对常见溶液的酸碱有感性的认识;在第二章第三节学习了氧化还原反应,了解了氧化还原反应的实质及其方程式的书写;在本节第一课时,已经学习了氯气的化学性质以及其氧化性。在此基础上再来探究氯水的组成及性质,这样的安排既能促进学生的认知发展,又能使学生对离子反应和氧化还原反应的具体应用加深认识。同时,氯水性质的相关知识又和后续含氯消毒液紧密相连的。从知识结构上讲,氯水的形成原理有引出了高中化学又一类重要的氧化还原反应——歧化反应,通过学习氯水的组成和性质,有利于学生构建更完整的氧化还原思维结构。
2. 学情分析
学生已掌握了石蕊试纸的使用以及氯离子的检验方法,也掌握了氧化还原反应的实质及其方程式的书写,在此基础上引发学生自行思考设计检验“氯水中是否发生化学反应”以及“氯水漂白性原因”的实验,并在回顾氧化还原方程式书写的基础上,引导学生写出氯水形成原理方程式,可以让学生从中体会到用实验探究事物本质的科学方法,并体验到借助已有化学知识和原理掌握新知识的成就感。
3. 重难点分析
[教学重点]
(1)氯水的形成原理
(2)次氯酸的性质
[教学难点]
(1)氯水组成的探究
三.【设计思路】
如何将三维教学目标落实到教学中,是设计教学流程的指导思想。本节教学流程重要通过以下三个环节反应这一思想。
环节一:通过提问的方式引发学生思考为什么要在自来水中加入少量氯气,并引导学生实验探究氯气与水是否发生化学反应。
环节二:进一步询问学生氯气与水反应的可能产物,并根据氯水具有漂白性的现象,进一不引导学生设计实验探究氯水中具有漂白性的物质。
环节三:借助实验结果,引出次氯酸,此时通过提问的方式引导学生回顾氧化还原反应方程式的书写,得出氯水形成的原理方程式。根据次氯酸的性质引导学生分析新制与久制氯水的成分变化。
环节四:让学生分析总结氯水的性质,即可以检验学生的学习成果又可以让学生展示自己的学习成果。通过让学生课后预习溴和碘的相关知识,进一步学习体会元素化学的学习方法并培养学生举一反三的能力。
四.【教学过程】
教学流程 教师活动 学生活动 教学意图
课堂引入 [从水中通入氯气能用于杀菌消毒引入本课学习内容] 【提问】自来水中加入少量氯气的原因?
【设问】为什么氯气溶于水能杀菌消毒? 消毒杀菌 以生活中的化学引入,吸引学生进入学习情景
【引言】上节课我们已经了解了氯气的物理性质以及氯气的氧化性,这节课就让我们一起来探究氯水的组成及性质,了解氯气杀菌消毒的原理。
【板书】3.2氯气的组成和性质 聆听并思考
回顾氯气物理性质 【讲解】在探究氯水之前,先来回顾氯水的物理性质:
颜色、状态、气味、密度、毒性、熔沸点、溶解性 颜色:黄绿色
状态:气体
气味:刺激性气味
密度:大于空气
毒性:有毒
熔沸点:易液化
溶解性:能溶于水(1:2),形成氯水 引导学生复习巩固上节课的内容
氯水组成探究一: 验证氯气与水是否反应
【提问】氯气溶于水是简单的物理变化还是有发生化学变化? 可能有化学变化 进一步思考氯气与水反应的实质,体会逐步寻求真理的乐
趣。
【提问】如果发生反应,可能的产物是什么? 盐酸和氧气,盐酸和?……
【提问】同学们都提到了可能会产生盐酸,请设计实验验证参猜想。
方案一:检验酸碱性
方案二:检验氯离子
方案三……
【演示实验】
检验酸碱性:
用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,石蕊试纸变红
检验氯离子:
用胶头滴管吸取少量硝酸银溶液置于试管中,在用胶头滴管吸取少量氯水滴到硝酸银溶液中,有白色沉淀生成。
【提问】根据现象得出的实验结论是什么?
观察并思考
氯气能与水反应,产物有氯离子、氢离子……
氯水组成探究二: 检验氯水中具有漂白性的微粒
【提问+展示】我们再回过头来看看刚才测氯水的石蕊试纸,有什么变化?
【提问】说明氯水有什么性质? 试纸变白了
氯水具有漂白性 引发学生思考,
激发学生探索
化学反应过程
的热情
【提问】氯水中具有漂白性的物质是什么? 可能是氯水中溶解的氯气 ;也可能是氯气与水反应生成的新的物质
【提问】请设计实验,验证氯水中具有漂白性的物质 将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,观察现象。
【视频演示】将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,干燥红花无明显现象;湿润红花褪色。
【提问】根据实验现象,我们可以得出什么结论? 观看教师演示实验。
得出结论: 有漂白性的物质不是氯气,而是氯气与水反应生成的新物质,填写实验报告。 培养学生的观察能力,学习实验的正确操作方法。
归纳氯水的组成和性质 【讲解】根据现有的知识,我们很难再去探究新的物质到底是什么。进一步的实验表明,这个物质是次氯酸。请各位同学在学案上写出氯气与水的方程式。
培养学生根据已有知识推到总结得出结论的能力。
【设问】现在,我们来总结一下氯水的成分了。
【板书】 氯水的成分:分子:Cl2、H2O、 HClO;离子:H+、Cl-、ClO-、 OH- 思考回答氯水的成分。
【讲解】氯气和水反应生成次氯酸和盐酸,这是我们新接触的一个反应,然我们来看看次氯酸的性质。
(1)弱酸性
(2)不稳定性
(3)强氧化性 学习次氯酸的性质
思考其性质与氯水性质之间的联系
【提问】根据次氯酸的不稳定性,同学们想一下,久制氯水的会发生什么变化?(成分、PH) 久制氯水氯水的成分:
分子:Cl2、H2O
离子:H+、Cl-、OH-
PH增大
【讲解】根据次氯酸的性质,我们回过头来看看课前老师提出的问题,自来水中通入氯气能用来杀菌消毒正是因为它和水反应生成了次氯酸。
实际上,在我们日常的饮用水中一升水中大约通入的是0.002g的氯气,因此我们可以想象,它产生的次氯酸和需要的氯气量都很少。
但近几年来的科学研究也表明,氯气可能会和水中的某些有机物发生反应,在人体中产生一些有害的物质,所以现在科学家正在研究要用新型的消毒剂,比如臭氧、二氧化氯等一些物质来代替氯气给自来水消毒。 了解次氯酸和氯水的性质,知道了氯水中杀菌消毒和具有漂白性的物质是次氯酸。
了解自来水通氯气的原因,知道了通微量氯气对人体没有太大伤害。
理解体会科学是把双刃剑,对化学研究好奇向往。
培养学生正确
的化学观,激发学生对于化学研究的兴趣。
总结本课内容 【总结】氯气与水发生反应产生次氯酸而使氯水具有杀菌消毒和漂白作用。
请同学们课后思考同为卤素的溴和碘又有那些性质,也们也会和水反应吗?如果会,产物有是什么? 回顾氯气与水的反应,以及氯水的性质。
课后预习有关溴和碘的相关知识。
使学生进一步体会元素化学的学习方法并培养学生类比的能力。
附件一:
氯水的组成探究 ——实验报告(学生用)
编号 实验名称 实验操作 实验现象 实验分析
1 验证氯气与水是否反应:
2 验证氯气与水是否反应:
3
氯气与水反应方程式
氯水的组成
氯水的性质:
附件二:
氯水的组成探究 ——实验报告(教师用)
编号 实验名称 实验操作 实验现象 实验分析
1 验证氯气与水是否反应:测定溶液酸碱性 用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,观察现象。 蓝色石蕊试纸变红 溶液显酸性
2 验证氯气与水是否反应:检验氯离子
用胶头滴管吸取少量硝酸银溶液置于试管中,在用胶头滴管吸取少量氯水滴到硝酸银溶液中,观察现象。 出现白色沉淀
溶液中存在氯离子
3 检验氯水中具有漂白性的微粒
将干燥的红花和湿润的红花分别放入装有氯气的集气瓶中,观察现象。 干燥红花无明显现象;湿润红花褪色 有漂白性的物质不是氯气,而是氯气与水反应生成的新物质。
氯气与水反应方程式
氯水的组成 新制:水分子、氯气分子、氢离子、氢氧根离子、氯离子、次氯酸分子、次氯酸根离子
久制:水分子、氯气分子、氧气分子、氢离子、氢氧根离子、氯离子
氯水的性质: (1)弱酸性:比碳酸的酸性弱
(2)不稳定性:
(3)强氧化性(杀菌、消毒)
