10-11高中化学课时讲练通课件:1.3.3 化学中常用的物理量——物质的量(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:1.3.3 化学中常用的物理量——物质的量(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共61张PPT)
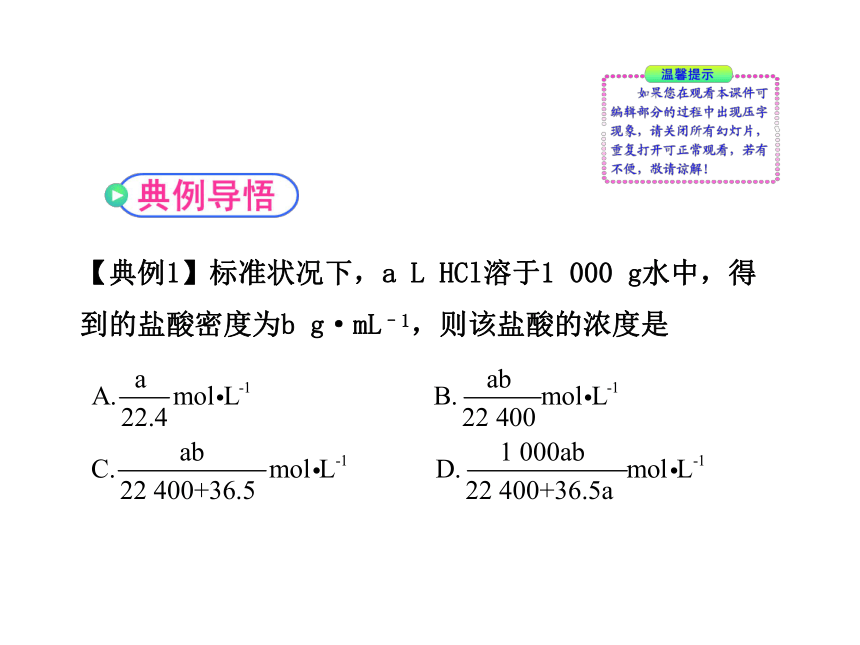
【典例1】标准状况下,a L HCl溶于1 000 g水中,得到的盐酸密度为b g·mL–1,则该盐酸的浓度是
【思路点拨】解答本题的关键是溶液体积的确定,
它不是气体体积加上水的体积。
【自主解答】选D。
在标准状况下,a LHCl气体的物质的量为
,其质量为 ;
所以盐酸的质量为 ,其体积为
,故该盐酸的浓度为
【典例2】甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为___________。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液都转移到容量瓶中,然后小心地向容量瓶中
加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是_________。
②洗涤操作中,将洗涤烧杯后的洗涤液也注入容量瓶,其目的是______________。
③定容的正确操作是__________________________。
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处___________。
【思路点拨】由浓溶液配制稀溶液时,可由稀释前后所含溶质的物质的量不变求所需浓溶液的体积;解答基本操作时一定要语言准确。
【自主解答】(1)假设取用的浓硫酸的体积为V,根据稀释前后溶质的物质的量不变有:V×18 mol/L = 100 mL× 3.6 mol/L V=20.0 mL。
(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中;②使溶质完全转移到容量瓶中;
③ 加水至离刻度线1 cm~2 cm时,改用胶头滴管滴加水至凹液面与刻度线相切;
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中。
答案:(1)20.0 mL(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中 ②使溶质完全转移到容量瓶中 ③加水至离刻度线1 cm~2 cm时,改用胶头滴管滴加水至凹液面与容量瓶的刻度线相切
(3)不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中
知识点一:物质的量浓度的简单计算
1.将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是( )
A.1 mol/L B.0.1 mol/L
C.0.01 mol/L D.10 mol/L
【解析】选B 。n(NaOH)=4 g/40 g·mol-1= 0.1 mol,c(NaOH)= 0.1 mol / 1 L =0.1 mol/L,从中取出10 mL后浓度不变。
2.0.5 L 1 mol/L的FeCl3与0.2 L 1 mol/L的KCl溶液中,Cl-物质的量浓度之比为( )
A.5∶2 B.1∶1
C.3∶1 D.1∶3
解题提示:溶液中溶质完全以离子形式存在时,其离子的浓度=溶质的浓度×角标。
【解析】选 C。1 mol/L的FeCl3中Cl-的物质的量浓
度是3 mol/L,1 mol/L的KCl中Cl-的物质的量浓度是
1 mol/L,所以选C。
3.10 g 98%的浓硫酸,密度1.84 g·mL-1,与10 mL
18.4 mol·L-1的硫酸的浓度相比较,结论是( )
A.相同 B.前者浓
C.后者浓 D.无法比较
【解析】选A。由c(B)= 代入可得密度为
1.84 g·mL-1,98%的浓硫酸的物质的量浓度为
18.4 mol·L-1。
知识点二:一定物质的量浓度溶液的配制
4.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中,正确的是( )
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放人容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
【解析】选D。对于易潮解、有腐蚀性的药品不能直接称量,应放于玻璃器皿中快速称量;称量好的药品也不能直接放于容量瓶中溶解;溶解后的溶液应冷却至室温后方能转移;容量瓶未经干燥不会引起误差。
5.配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是( )
A.称量时,托盘天平左盘高,右盘低
B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥
D.定容时液面超过了刻度线
【解析】选B。左盘高,右盘低,说明左盘药品质量偏小;定容时俯视刻度线,会使溶液体积偏小,浓度偏高;容量瓶未干燥,无影响;定容时超过刻度线,浓度偏低。
6.用20 g烧碱配制成500 mL溶液,其物质的量浓度为 __________mol/L;若从中取出1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为________mol/L,其中含Na+的物质的量为______mol。
【解析】n(NaOH)=20 g/ 40g·mol-1= 0.5 mol,
c(NaOH)= 0.5 mol/0.5L=1 mol/L;从中取出1 mL,其物质的量浓度不变;若稀释到100 mL,
由c(稀)V(稀)=c(浓)V(浓)得,c(稀)=
0.01 mol/L,其中含Na+的物质的量为0.001 mol。
答案:1 0.01 0.001
一、选择题(本题包括5小题,每小题4分,共20分)
1. 下列有关0.1 mol·L-1NaOH溶液的叙述正确的是
( )
A.1 L该溶液中含有NaOH 40 g
B.100 mL该溶液中含有OH- 0.01 mol
C.从1 L该溶液中取出100 mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1 L水中溶解4 g NaOH即可配制得0.1 mol·L-1 NaOH 溶液
【解析】选B。1 L该溶液中含有NaOH 4 g;从1 L该溶液中取出100 mL,所取出的NaOH溶液的浓度不变;在
1 L水中溶解4 g NaOH后,溶液体积不是1 L,浓度不是0.1 mol·L-1。
2.下列关于物质的量浓度表述中正确的是( )
A.0.3 mol·L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是
1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同
D.10 ℃时0.35 mol·L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
【解析】选D。A项:未指明溶液的体积,所以溶液中Na+和SO42-总物质的量不一定为0.9 mol,故A项错误;B项:虽然强调了氨水的体积为1 L,但22.4 L的氨气未指明是标准状况下的体积,则氨气的物质的量不一定为1 mol,所制成的1 L溶液的物质的量浓度也不一定为1 mol·L-1,故B项错误;C项:若混合液中含有
a mol K2SO4,则必含有a mol SO42- 、2a mol K+,
当Na+和SO42-的物质的量相等时,混合液中只能含
a mol NaCl,此时混合液中K+为2a mol,Cl-为a mol,故C项错误;D项:对于10 ℃时0.35 mol·L-1的KCl饱和溶液,蒸发了水必析出KCl晶体,当温度恢复到
10 ℃时,仍为饱和溶液,其浓度保持不变,故D项正确。
3.实验室需用480 mL 0.1 mol·L-1的硫酸铜溶液,以下操作正确的是( )
A.称取7.68 g无水硫酸铜加入烧杯中,加入480 mL水搅拌溶解
B.称取12.5 g胆矾加入烧杯中溶解,冷却后移液至
500 mL容量瓶(包括洗涤液),加水至刻度线
C.称取7.68 g无水硫酸铜加入到量筒中,加水溶解,继续加水至480 mL
D.称取8.0 g硫酸铜加入500 mL容量瓶中,加水至刻度线
【解析】选B。因无480 mL容量瓶,所以要配制500 mL溶液,正确的方法是称取12.5 g胆矾或8 g无水CuSO4配制成500 mL溶液。配制时必须按操作步骤进行,不能在量筒中溶解、配制,也不能直接在容量瓶中溶解。
4.(2010·海南高考)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
【解析】选D。由题意知V/2 L溶液中加入a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,说明该溶液中Mg2+的物质的量为a/2 mol,故原溶液中Mg2+的物质的量为a mol,即MgSO4的物质的量为a mol;加入b mol BaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡,则原溶液中SO42-的物质的量为2b mol。由上分析可知混合溶液中K2SO4的物质的量为(2b-a) mol,所以K+的物质的量为2(2b-a) mol,其浓度为
。
5.密度为d g·cm-3的溶液V mL含相对分子质量为M的溶质 m g,其物质的量浓度为c mol·L-1,质量分数为w%,下列表达式中不正确的是( )
【解析】选D。由 ,
故A项正确;由m(质)=m(液)×w%=d g·cm-3×
V mL×w%=d·V· ,故B项正确;由
知, ,故C项正确;由 知,
,故D项错误。
二、非选择题(本题包括1小题,共10分)
6.标准状况下,336 L 的NH3溶于1 L 水中,所得溶液
的质量分数为_______,若该溶液的密度为a g/cm3,则物质的量浓度为____________。将上述氨水全部转化为NH4Cl,所需4 mol/L 的酸的体积为______________。(已知NH3+HCl====NH4Cl)
【解析】氨水的质量分数:
氨水的物质的量浓度:
根据反应:NH3+HCl====NH4Cl
可知需要盐酸的体积
。
答案:20.32% 11.95a mol/L 3.75 L
1.(4分)已知AnBm的离子积=c(Am+)n·c(Bn-)m,此处c(Arn+)和c(Bn-)分别表示A、B离子的物质的量浓度。某温度下Ca(OH)2的溶解度为0.74 g,饱和溶液的密度为1 g/cm3,其离子积为 ( )
A.0.02 B.0.04 C.0.004 D.0.001
【解析】选C。设该温度下饱和溶液中溶剂水的质量为100 g,那么含溶质Ca(OH)2的质量为0.74 g。
n[Ca(OH)2]=0.74 g/74 g·mol-1=0.01 mol;
V=100.74 g/1 g·cm-3≈100 mL=0.1 L
c(Ca2+)=0.01 mol / 0.1 L=0.1 mol·L-1;c(OH-)=0.2 mol·L-1;其离子积=c(Ca2+)·c(OH-)2=0.1×(0.2)2=0.004
2.(16分)用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1稀H2SO4 100 mL。
(1)实验中应选用的仪器是______(填字母)。
(A)100 mL量筒 (B)托盘天平
(C)玻璃棒 (D)50 mL容量瓶
(E)10 mL量筒 (F)50 mL烧杯
(G)100 mL容量瓶 (H)胶头滴管
(2)实验操作:
①用100 mL量筒量取98%的浓H2SO4 ————mL;
②选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的H2SO4沿玻璃棒转移到此容量瓶中;
③用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
④在小烧杯内稀释浓H2SO4,稀释时要用玻璃棒不断搅拌;
⑤向容量瓶中直接加蒸馏水至离刻度线1 cm~2 cm处;
⑥盖上容量瓶塞子、摇匀;
⑦用胶头滴管小心加蒸馏水至刻度线;
⑧将配制好的溶液转入洗涤但尚未干燥的试剂瓶中贮存备用。
(3)实验分析
①正确的操作步骤是_____________(填序号)。
②此实验中玻璃棒的作用是_____________。
③实验操作有两处错误,这两处错误是:
Ⅰ.____________________。
Ⅱ._____________________。
④分析下列操作所配溶液浓度是“偏高”、“偏低”还是“无影响”:
Ⅰ.转移硫酸后,小烧杯未洗涤______________。
Ⅱ.配制溶液前容量瓶内留有少量蒸馏水:________。
【解析】所需浓H2SO4的体积为:
所以选用仪器(E)。由配制一定物质的量浓度溶液的实验步骤知,还需要的仪器有(F)(C)(G)(H)
正确的操作步骤是:①④②③⑤⑦⑥⑧。
根据实验步骤的要求和注意事项知,在稀释浓H2SO4和移液时,玻璃棒的作用分别是搅拌和引流;由于所需浓H2SO4的体积为5.4 mL,所以应用10 mL量筒,若选用100 mL量筒,由于量程太大,会造成较大的误差,
故①操作存在错误;由于试剂瓶洗涤后未干燥,瓶壁附着的蒸馏水会使所配溶液变稀,故⑧操作存在错误。
由于小烧杯未洗涤,溶质未全部转移到容量瓶中,导致浓度偏低。由于容量瓶中留有少量蒸馏水对溶质的物质的量、溶液的体积均不会产生影响,所以浓度不会有改变。
答案:(1)(C)(E)(F)(G)(H)
(2)5.4 (3)①④②③⑤⑦⑥⑧ 搅拌和引流
量取浓H2SO4的量筒量程太大,会造成较大误差 试剂瓶未干燥,会使所配溶液变稀 偏低 无影响
【典例1】标准状况下,a L HCl溶于1 000 g水中,得到的盐酸密度为b g·mL–1,则该盐酸的浓度是
【思路点拨】解答本题的关键是溶液体积的确定,
它不是气体体积加上水的体积。
【自主解答】选D。
在标准状况下,a LHCl气体的物质的量为
,其质量为 ;
所以盐酸的质量为 ,其体积为
,故该盐酸的浓度为
【典例2】甲乙两位同学分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为___________。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液都转移到容量瓶中,然后小心地向容量瓶中
加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是_________。
②洗涤操作中,将洗涤烧杯后的洗涤液也注入容量瓶,其目的是______________。
③定容的正确操作是__________________________。
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处___________。
【思路点拨】由浓溶液配制稀溶液时,可由稀释前后所含溶质的物质的量不变求所需浓溶液的体积;解答基本操作时一定要语言准确。
【自主解答】(1)假设取用的浓硫酸的体积为V,根据稀释前后溶质的物质的量不变有:V×18 mol/L = 100 mL× 3.6 mol/L V=20.0 mL。
(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中;②使溶质完全转移到容量瓶中;
③ 加水至离刻度线1 cm~2 cm时,改用胶头滴管滴加水至凹液面与刻度线相切;
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中。
答案:(1)20.0 mL(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流入容量瓶中 ②使溶质完全转移到容量瓶中 ③加水至离刻度线1 cm~2 cm时,改用胶头滴管滴加水至凹液面与容量瓶的刻度线相切
(3)不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中
知识点一:物质的量浓度的简单计算
1.将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是( )
A.1 mol/L B.0.1 mol/L
C.0.01 mol/L D.10 mol/L
【解析】选B 。n(NaOH)=4 g/40 g·mol-1= 0.1 mol,c(NaOH)= 0.1 mol / 1 L =0.1 mol/L,从中取出10 mL后浓度不变。
2.0.5 L 1 mol/L的FeCl3与0.2 L 1 mol/L的KCl溶液中,Cl-物质的量浓度之比为( )
A.5∶2 B.1∶1
C.3∶1 D.1∶3
解题提示:溶液中溶质完全以离子形式存在时,其离子的浓度=溶质的浓度×角标。
【解析】选 C。1 mol/L的FeCl3中Cl-的物质的量浓
度是3 mol/L,1 mol/L的KCl中Cl-的物质的量浓度是
1 mol/L,所以选C。
3.10 g 98%的浓硫酸,密度1.84 g·mL-1,与10 mL
18.4 mol·L-1的硫酸的浓度相比较,结论是( )
A.相同 B.前者浓
C.后者浓 D.无法比较
【解析】选A。由c(B)= 代入可得密度为
1.84 g·mL-1,98%的浓硫酸的物质的量浓度为
18.4 mol·L-1。
知识点二:一定物质的量浓度溶液的配制
4.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中,正确的是( )
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放人容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
【解析】选D。对于易潮解、有腐蚀性的药品不能直接称量,应放于玻璃器皿中快速称量;称量好的药品也不能直接放于容量瓶中溶解;溶解后的溶液应冷却至室温后方能转移;容量瓶未经干燥不会引起误差。
5.配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是( )
A.称量时,托盘天平左盘高,右盘低
B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥
D.定容时液面超过了刻度线
【解析】选B。左盘高,右盘低,说明左盘药品质量偏小;定容时俯视刻度线,会使溶液体积偏小,浓度偏高;容量瓶未干燥,无影响;定容时超过刻度线,浓度偏低。
6.用20 g烧碱配制成500 mL溶液,其物质的量浓度为 __________mol/L;若从中取出1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为________mol/L,其中含Na+的物质的量为______mol。
【解析】n(NaOH)=20 g/ 40g·mol-1= 0.5 mol,
c(NaOH)= 0.5 mol/0.5L=1 mol/L;从中取出1 mL,其物质的量浓度不变;若稀释到100 mL,
由c(稀)V(稀)=c(浓)V(浓)得,c(稀)=
0.01 mol/L,其中含Na+的物质的量为0.001 mol。
答案:1 0.01 0.001
一、选择题(本题包括5小题,每小题4分,共20分)
1. 下列有关0.1 mol·L-1NaOH溶液的叙述正确的是
( )
A.1 L该溶液中含有NaOH 40 g
B.100 mL该溶液中含有OH- 0.01 mol
C.从1 L该溶液中取出100 mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1 L水中溶解4 g NaOH即可配制得0.1 mol·L-1 NaOH 溶液
【解析】选B。1 L该溶液中含有NaOH 4 g;从1 L该溶液中取出100 mL,所取出的NaOH溶液的浓度不变;在
1 L水中溶解4 g NaOH后,溶液体积不是1 L,浓度不是0.1 mol·L-1。
2.下列关于物质的量浓度表述中正确的是( )
A.0.3 mol·L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是
1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同
D.10 ℃时0.35 mol·L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
【解析】选D。A项:未指明溶液的体积,所以溶液中Na+和SO42-总物质的量不一定为0.9 mol,故A项错误;B项:虽然强调了氨水的体积为1 L,但22.4 L的氨气未指明是标准状况下的体积,则氨气的物质的量不一定为1 mol,所制成的1 L溶液的物质的量浓度也不一定为1 mol·L-1,故B项错误;C项:若混合液中含有
a mol K2SO4,则必含有a mol SO42- 、2a mol K+,
当Na+和SO42-的物质的量相等时,混合液中只能含
a mol NaCl,此时混合液中K+为2a mol,Cl-为a mol,故C项错误;D项:对于10 ℃时0.35 mol·L-1的KCl饱和溶液,蒸发了水必析出KCl晶体,当温度恢复到
10 ℃时,仍为饱和溶液,其浓度保持不变,故D项正确。
3.实验室需用480 mL 0.1 mol·L-1的硫酸铜溶液,以下操作正确的是( )
A.称取7.68 g无水硫酸铜加入烧杯中,加入480 mL水搅拌溶解
B.称取12.5 g胆矾加入烧杯中溶解,冷却后移液至
500 mL容量瓶(包括洗涤液),加水至刻度线
C.称取7.68 g无水硫酸铜加入到量筒中,加水溶解,继续加水至480 mL
D.称取8.0 g硫酸铜加入500 mL容量瓶中,加水至刻度线
【解析】选B。因无480 mL容量瓶,所以要配制500 mL溶液,正确的方法是称取12.5 g胆矾或8 g无水CuSO4配制成500 mL溶液。配制时必须按操作步骤进行,不能在量筒中溶解、配制,也不能直接在容量瓶中溶解。
4.(2010·海南高考)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
【解析】选D。由题意知V/2 L溶液中加入a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,说明该溶液中Mg2+的物质的量为a/2 mol,故原溶液中Mg2+的物质的量为a mol,即MgSO4的物质的量为a mol;加入b mol BaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡,则原溶液中SO42-的物质的量为2b mol。由上分析可知混合溶液中K2SO4的物质的量为(2b-a) mol,所以K+的物质的量为2(2b-a) mol,其浓度为
。
5.密度为d g·cm-3的溶液V mL含相对分子质量为M的溶质 m g,其物质的量浓度为c mol·L-1,质量分数为w%,下列表达式中不正确的是( )
【解析】选D。由 ,
故A项正确;由m(质)=m(液)×w%=d g·cm-3×
V mL×w%=d·V· ,故B项正确;由
知, ,故C项正确;由 知,
,故D项错误。
二、非选择题(本题包括1小题,共10分)
6.标准状况下,336 L 的NH3溶于1 L 水中,所得溶液
的质量分数为_______,若该溶液的密度为a g/cm3,则物质的量浓度为____________。将上述氨水全部转化为NH4Cl,所需4 mol/L 的酸的体积为______________。(已知NH3+HCl====NH4Cl)
【解析】氨水的质量分数:
氨水的物质的量浓度:
根据反应:NH3+HCl====NH4Cl
可知需要盐酸的体积
。
答案:20.32% 11.95a mol/L 3.75 L
1.(4分)已知AnBm的离子积=c(Am+)n·c(Bn-)m,此处c(Arn+)和c(Bn-)分别表示A、B离子的物质的量浓度。某温度下Ca(OH)2的溶解度为0.74 g,饱和溶液的密度为1 g/cm3,其离子积为 ( )
A.0.02 B.0.04 C.0.004 D.0.001
【解析】选C。设该温度下饱和溶液中溶剂水的质量为100 g,那么含溶质Ca(OH)2的质量为0.74 g。
n[Ca(OH)2]=0.74 g/74 g·mol-1=0.01 mol;
V=100.74 g/1 g·cm-3≈100 mL=0.1 L
c(Ca2+)=0.01 mol / 0.1 L=0.1 mol·L-1;c(OH-)=0.2 mol·L-1;其离子积=c(Ca2+)·c(OH-)2=0.1×(0.2)2=0.004
2.(16分)用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1稀H2SO4 100 mL。
(1)实验中应选用的仪器是______(填字母)。
(A)100 mL量筒 (B)托盘天平
(C)玻璃棒 (D)50 mL容量瓶
(E)10 mL量筒 (F)50 mL烧杯
(G)100 mL容量瓶 (H)胶头滴管
(2)实验操作:
①用100 mL量筒量取98%的浓H2SO4 ————mL;
②选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的H2SO4沿玻璃棒转移到此容量瓶中;
③用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
④在小烧杯内稀释浓H2SO4,稀释时要用玻璃棒不断搅拌;
⑤向容量瓶中直接加蒸馏水至离刻度线1 cm~2 cm处;
⑥盖上容量瓶塞子、摇匀;
⑦用胶头滴管小心加蒸馏水至刻度线;
⑧将配制好的溶液转入洗涤但尚未干燥的试剂瓶中贮存备用。
(3)实验分析
①正确的操作步骤是_____________(填序号)。
②此实验中玻璃棒的作用是_____________。
③实验操作有两处错误,这两处错误是:
Ⅰ.____________________。
Ⅱ._____________________。
④分析下列操作所配溶液浓度是“偏高”、“偏低”还是“无影响”:
Ⅰ.转移硫酸后,小烧杯未洗涤______________。
Ⅱ.配制溶液前容量瓶内留有少量蒸馏水:________。
【解析】所需浓H2SO4的体积为:
所以选用仪器(E)。由配制一定物质的量浓度溶液的实验步骤知,还需要的仪器有(F)(C)(G)(H)
正确的操作步骤是:①④②③⑤⑦⑥⑧。
根据实验步骤的要求和注意事项知,在稀释浓H2SO4和移液时,玻璃棒的作用分别是搅拌和引流;由于所需浓H2SO4的体积为5.4 mL,所以应用10 mL量筒,若选用100 mL量筒,由于量程太大,会造成较大的误差,
故①操作存在错误;由于试剂瓶洗涤后未干燥,瓶壁附着的蒸馏水会使所配溶液变稀,故⑧操作存在错误。
由于小烧杯未洗涤,溶质未全部转移到容量瓶中,导致浓度偏低。由于容量瓶中留有少量蒸馏水对溶质的物质的量、溶液的体积均不会产生影响,所以浓度不会有改变。
答案:(1)(C)(E)(F)(G)(H)
(2)5.4 (3)①④②③⑤⑦⑥⑧ 搅拌和引流
量取浓H2SO4的量筒量程太大,会造成较大误差 试剂瓶未干燥,会使所配溶液变稀 偏低 无影响
