10-11高中化学课时讲练通课件:2.1.2 元素与物质的分类(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:2.1.2 元素与物质的分类(鲁科版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览










文档简介
(共53张PPT)
【典例1】下列关于胶体的说法中,正确的是
A.胶体与溶液有明显不同的外观特征,胶体呈胶状
B.胶体不稳定,静置后容易产生沉淀
C.利用丁达尔现象可鉴别胶体和溶液
D.要形成胶体,分散质必须符合一定的结构,如氯化钠就不能形成胶体和浊液
【思路点拨】胶体与溶液、浊液的本质区别在于分散质微粒直径的大小不同。
【自主解答】选C。胶体最本质的特征是分散质微粒直径在1~100 nm之间。不同的胶体具有不同的外观特征,有的胶体外观与溶液并无明显不同,因此A错误。胶体也是一种较稳定的分散系,B错误。区分胶体和溶液可利用丁达尔现象,C正确。胶体不是物质结构的反映,而是物质的一种存在形式。如氯化钠分散在水中形成溶液,而分散在乙醇(酒精)中则可形成胶体,若将饱和NaCl溶液降温或蒸发,则可形成浊液;氢氧化铁在水中既能分散形成胶体,也能形成沉淀。故D错误。
【典例2】某溶液逐滴加入Fe(OH)3胶体(胶粒带正电荷)中,开始时产生沉淀,继续滴加沉淀溶解,则该溶液是
A.2mol/L NaOH溶液 B.2mol/L HCl溶液
C.2mol/L NaCl溶液 D.硅酸胶体(胶粒带负电荷)
【思路点拨】开始发生沉淀是Fe(OH)3胶体发生聚沉,之后沉淀溶解是发生了酸与碱的反应!
【自主解答】选B。Fe(OH)3胶体的胶粒带正电荷,NaOH溶液、HCl溶液、NaCl溶液和硅酸胶体(胶粒带负电荷)都能中和Fe(OH)3胶体的胶粒所带的电荷,使
Fe(OH)3胶体发生聚沉,生成Fe(OH)3沉淀。但在本题中,能溶解Fe(OH)3沉淀的只有HCl溶液。
不要只考虑到HCl是电解质能使Fe(OH)3胶体聚沉而忽略了它能与Fe(OH)3发生酸碱中和反应而使沉淀溶解。
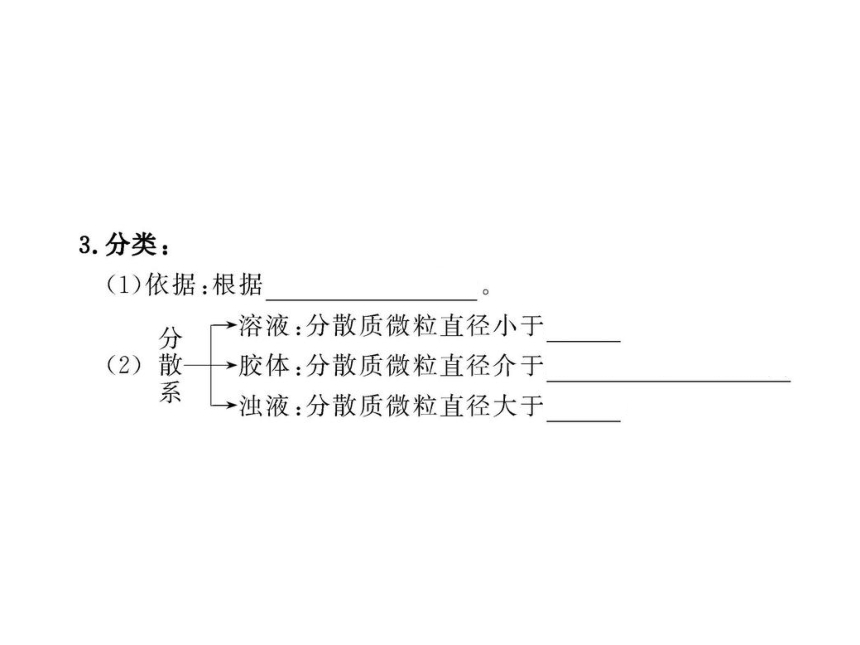
知识点一:分散系
1.将KI-淀粉混合液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中一段时间后,某学生取烧杯中液体滴加几滴试剂便立即报告老师说:这个半透膜袋已经破损了,老师肯定了他的说法。这位学生所滴的试剂及观察到的现象是(已知2KI+Cl2====2KCl+I2)( )
A.滴两滴碘水显蓝色
B.滴淀粉试液显蓝色
C.滴AgNO3溶液,溶液出现黄色沉淀
D.滴氯水-淀粉试液显蓝色
解题提示:检验淀粉时可用碘水,因淀粉遇碘变蓝色。
【解析】选A。KI溶液可以透过半透膜,而淀粉溶液实际是胶体,不能透过半透膜。如果半透膜破损,淀粉胶体能进入蒸馏水,由淀粉遇I2变蓝的特征反应可验证淀粉的存在。
2.胶体具有区别于其他分散系的本质特征是( )
A.能透过半透膜
B.能透过滤纸
C.光束通过时能产生光亮的“通路”
D.分散质微粒的粒度在10-9m~10-7m之间
【解析】选D。分散质粒子的直径是分散系的分类依据。
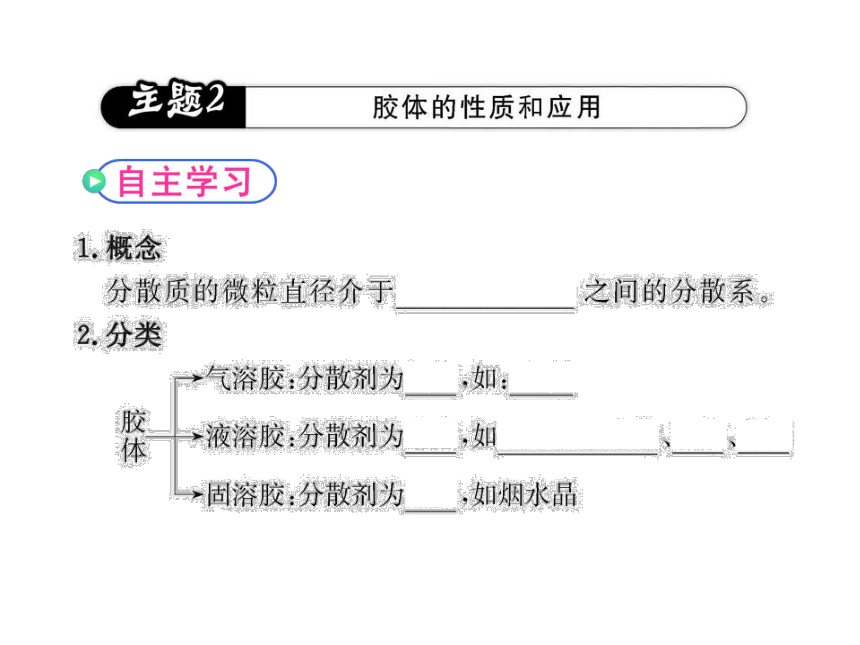
知识点二:胶体的性质及应用
3.(2010·天津五校联考)下列叙述正确的是( )
A.胶体能透过滤纸,也能透过半透膜
B.分散系中分散质粒子直径由小到大的正确顺序是:
溶液<胶体<浊液
C.氯化铁溶液加入到冷水中可以制得氢氧化铁胶体
D.胶体的分散质可以通过过滤从分散剂中分离出来
【解析】选B。A项,胶体能透过滤纸,但不能透过半透膜;B项,三种分散系中分散质粒子直径分别为:溶液<1 nm,胶体1~100 nm,浊液:>100 nm;故B项正确;C中制备Fe(OH)3胶体必须把FeCl3溶液加入到沸水中;D中胶体与溶液的分离可用渗析(透过半透膜)法。
4.已知土壤胶粒带负电荷,因此在水稻田里施用含氮量相同的下列化肥,肥效最差的是( )
A.硫铵 B.氯化铵 C.碳铵 D.硝铵
【解析】选D。土壤胶粒带负电荷 ,能够吸引阳离子。而在(NH4)2SO4、NH4Cl、(NH4)2CO3中氮元素只存在于NH4+中,能被土壤胶粒吸附;而在NH4NO3中,氮元素还存在于NO3-中,NO3-是带负电荷的,不能被土壤胶粒吸引,可能会流失,降低肥效。
5.实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大
(1)向Fe(OH)3胶体中加入下列电解质时,其凝聚能力最强的为_________(填序号)。
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,______(填序号)效果最明显,原因是_________________。
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
【解析】(1)Fe(OH)3胶粒带正电,阴离子可中和其电性使其聚沉,Cl-、SO42-、PO43-中PO43-所带电荷最多,其聚沉能力最强。(2)加入带正电荷最多的阳离子,可使黏土溶胶聚沉效果最明显。
答案:(1)④ (2)B Al3+所带正电荷数最大,使黏土溶胶凝聚效果最好
一、选择题(本题包括5小题,每小题4分,共20分)
1.2010年4月,冰岛南部埃亚菲亚德拉冰盖火山喷发,火山灰形成的烟尘几乎使整个欧洲的航线陷于瘫痪。烟尘属于下列分散系中的( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
【解析】选D。云、烟、雾都是胶体,属于气溶胶。
2.(2010·大庆高一检测)如图是同学们经常使用的某品牌修正液包装标签。小明仔
细阅读后,结合自己的生活经验
和所学知识得出了修正液的某些
性质,小明的推测中不合理的是
( )
A.修正液是一种液体,均一、稳定
B.修正液中含有有毒的化学物质
C.修正液的成分对纸张不具腐蚀性
D.修正液的溶剂易挥发、易燃
【解析】选A。由说明书要求使用前摇匀修正液,可知修正液不均一稳定,所以它不是胶体;由用完后及时盖帽的要求及易燃品标识,可知D是正确的;严禁食用,说明B项正确;由生活经验可知C项也是正确的。
3.下列有关Fe(OH)3胶体的说法正确的是( )
A.用渗析法鉴别Fe(OH)3胶体和FeCl3溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液
B.Fe(OH)3胶体微粒带负电荷,在通电的情况下胶体微粒向直流电源的正极移动,这种现象称为电泳
C.向沸腾的蒸馏水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时即得到Fe(OH)3胶体
D.向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅拌,然后继续煮沸,制备Fe(OH)3胶体
【解析】选C。胶体和溶液可用丁达尔效应鉴别,用渗析法分离;金属氢氧化物的胶体微粒应带正电荷,故应向直流电源的负极移动;Fe(OH)3胶体制备时应将饱和FeCl3溶液滴加至沸水中,不能加到NaOH溶液中。
4.下列各组物质中,可用渗析法分离的是( )
A.CaCO3和Na2CO3
B.NaCl和KNO3
C.汽油和水
D.Fe(OH)3胶体和FeCl3溶液
【解析】选D。渗析方法适用于胶体和溶液的分离。渗析时,可用半透膜包住混合物,在流水中冲洗。
5.下列现象或新技术应用中,不涉及胶体性质的是
( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的尿中毒,可利用血液透析
【解析】选A。A中生成了Fe(OH)3沉淀,不是胶体。B利用微波加速血液的聚沉;C为胶体的丁达尔现象;D中血液透析利用了半透膜原理,透析相当于胶体的渗析提纯。
二、非选择题(本题包括1小题,共10分)
6.将1 mol/L的FeCl3溶液逐滴滴入沸水中,液体变为_____色,得到的是___________;反应的化学方程式为_________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_______,这表明____________,这种现象称为____________。
(2)向其中加入饱和(NH4)2SO4溶液,发生的现象是_________________。
(3)向其中逐滴加入过量稀硫酸,现象是________;原因是________________________。
【解析】本题考查了Fe(OH)3胶体的制备和性质。
(1)Fe(OH)3胶体为红褐色,发生反应:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。Fe(OH)3胶体微粒是带正电荷
的,通电后会向阴极移动,所以阴极颜色会加深;
(2)加入(NH4)2SO4溶液,(NH4)2SO4电离出的SO42-
会中和胶粒所带电荷,使胶体聚沉;(3)向Fe(OH)3胶
体中加H2SO4,除聚沉外,Fe(OH)3又可与H2SO4发生中和反
应,所以加H2SO4后,胶体先沉淀,后溶解。
△
====
答案:红褐 Fe(OH)3胶体 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
(1)逐渐加深 Fe(OH)3胶粒带正电荷 电泳
(2)形成红褐色沉淀 (3)先出现红褐色沉淀,后沉淀溶解 H2SO4电离产生的SO42-使Fe(OH)3胶体聚沉后,电离出的H+又与Fe(OH)3沉淀发生中和反应使其溶解
△
====
1.(5分)(双选)某胶体遇盐卤(含Mg2+)或石膏易发生聚沉,而遇食盐水或Na2SO4溶液不易发生聚沉,有关解释正确的是( )
A.胶粒的直径为1~100 nm
B.该胶粒带有正电荷
C.Na+使此胶体聚沉的效果不如Mg2+、Ca2+
D.该胶体遇Fe(OH)3胶体发生聚沉
【解析】选C、D。该胶体遇Mg2+或石膏(CaSO4)易发生聚沉,而遇NaCl或Na2SO4不易聚沉,可说明是高价阳离子使该胶体发生聚沉,从而判断该胶体胶粒是带负电荷的。A项是所有胶体的通性,不是产生该现象的原因;而Fe(OH)3胶粒是带正电荷的,加入带相反电荷的胶粒也能使胶体聚沉。
2.(15分)某化学课外活动小组为了探究胶体的胶粒和溶液的溶质粒子是否能透过半透膜,以及寻找净化胶体的方法,设计了如下渗析实验:
如图所示,在一个半透膜袋中装入由淀粉胶体和少量食盐溶液组成的液体分散系,将此袋系在玻璃棒上并浸入水槽里的蒸馏水中。
请回答下列有关问题:
(1)几分钟后,取水槽中的水于试管中,并向试管内加入少量的用HNO3酸化的AgNO3溶液,发现产生了白色沉淀;另取水槽中的水于试管中,并向试管内加入少量的碘水,未发现新现象,通过这两项实验说明,能透过半透膜的粒子是________,不能透过半透膜的粒子是_______;通过以上实验可以达到的目的是______
__________________________________。
(2)为了尽快达到完全渗析的目的,可以采取的措施是
_______________________________________。
(3)实验室中用饱和FeCl3溶液制备Fe(OH)3胶体时,发现制得的胶体中还有一部分未反应的FeCl3,并且胶体略显浑浊,将该胶体进行净化的方法的操作名称是__________________。
【解析】(1)由题意知,加入HNO3酸化的AgNO3溶液后,产生了白色沉淀,说明蒸馏水中含有NaCl,即Na+、Cl-能透过半透膜;加入少量的碘水后,未发现新现象,说明蒸馏水中不含淀粉,即淀粉胶粒不能透过半透膜;通过以上实验可以达到的目的是:用该实验可以除去淀粉胶体中的NaCl。
(2)为了尽快达到完全渗析的目的,根据高浓度向低浓度扩散原理可以用玻璃棒搅拌水槽中的水,过一段时间就更换水槽里的水。
(3)由于Fe(OH)3胶体中混有未反应的FeCl3,分离两物质时采用渗析的方法;由于Fe(OH)3胶体略显浑浊,说明Fe(OH)3胶体中混有Fe(OH)3沉淀,分离两物质时采用过滤的方法。
答案:(1)Na+和Cl- 淀粉胶粒 分离胶体和溶液的混合物 (2)用玻璃棒轻轻地搅拌水槽中的水,过一段时间后更换水槽中的水 (3)过滤、渗析
【典例1】下列关于胶体的说法中,正确的是
A.胶体与溶液有明显不同的外观特征,胶体呈胶状
B.胶体不稳定,静置后容易产生沉淀
C.利用丁达尔现象可鉴别胶体和溶液
D.要形成胶体,分散质必须符合一定的结构,如氯化钠就不能形成胶体和浊液
【思路点拨】胶体与溶液、浊液的本质区别在于分散质微粒直径的大小不同。
【自主解答】选C。胶体最本质的特征是分散质微粒直径在1~100 nm之间。不同的胶体具有不同的外观特征,有的胶体外观与溶液并无明显不同,因此A错误。胶体也是一种较稳定的分散系,B错误。区分胶体和溶液可利用丁达尔现象,C正确。胶体不是物质结构的反映,而是物质的一种存在形式。如氯化钠分散在水中形成溶液,而分散在乙醇(酒精)中则可形成胶体,若将饱和NaCl溶液降温或蒸发,则可形成浊液;氢氧化铁在水中既能分散形成胶体,也能形成沉淀。故D错误。
【典例2】某溶液逐滴加入Fe(OH)3胶体(胶粒带正电荷)中,开始时产生沉淀,继续滴加沉淀溶解,则该溶液是
A.2mol/L NaOH溶液 B.2mol/L HCl溶液
C.2mol/L NaCl溶液 D.硅酸胶体(胶粒带负电荷)
【思路点拨】开始发生沉淀是Fe(OH)3胶体发生聚沉,之后沉淀溶解是发生了酸与碱的反应!
【自主解答】选B。Fe(OH)3胶体的胶粒带正电荷,NaOH溶液、HCl溶液、NaCl溶液和硅酸胶体(胶粒带负电荷)都能中和Fe(OH)3胶体的胶粒所带的电荷,使
Fe(OH)3胶体发生聚沉,生成Fe(OH)3沉淀。但在本题中,能溶解Fe(OH)3沉淀的只有HCl溶液。
不要只考虑到HCl是电解质能使Fe(OH)3胶体聚沉而忽略了它能与Fe(OH)3发生酸碱中和反应而使沉淀溶解。
知识点一:分散系
1.将KI-淀粉混合液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中一段时间后,某学生取烧杯中液体滴加几滴试剂便立即报告老师说:这个半透膜袋已经破损了,老师肯定了他的说法。这位学生所滴的试剂及观察到的现象是(已知2KI+Cl2====2KCl+I2)( )
A.滴两滴碘水显蓝色
B.滴淀粉试液显蓝色
C.滴AgNO3溶液,溶液出现黄色沉淀
D.滴氯水-淀粉试液显蓝色
解题提示:检验淀粉时可用碘水,因淀粉遇碘变蓝色。
【解析】选A。KI溶液可以透过半透膜,而淀粉溶液实际是胶体,不能透过半透膜。如果半透膜破损,淀粉胶体能进入蒸馏水,由淀粉遇I2变蓝的特征反应可验证淀粉的存在。
2.胶体具有区别于其他分散系的本质特征是( )
A.能透过半透膜
B.能透过滤纸
C.光束通过时能产生光亮的“通路”
D.分散质微粒的粒度在10-9m~10-7m之间
【解析】选D。分散质粒子的直径是分散系的分类依据。
知识点二:胶体的性质及应用
3.(2010·天津五校联考)下列叙述正确的是( )
A.胶体能透过滤纸,也能透过半透膜
B.分散系中分散质粒子直径由小到大的正确顺序是:
溶液<胶体<浊液
C.氯化铁溶液加入到冷水中可以制得氢氧化铁胶体
D.胶体的分散质可以通过过滤从分散剂中分离出来
【解析】选B。A项,胶体能透过滤纸,但不能透过半透膜;B项,三种分散系中分散质粒子直径分别为:溶液<1 nm,胶体1~100 nm,浊液:>100 nm;故B项正确;C中制备Fe(OH)3胶体必须把FeCl3溶液加入到沸水中;D中胶体与溶液的分离可用渗析(透过半透膜)法。
4.已知土壤胶粒带负电荷,因此在水稻田里施用含氮量相同的下列化肥,肥效最差的是( )
A.硫铵 B.氯化铵 C.碳铵 D.硝铵
【解析】选D。土壤胶粒带负电荷 ,能够吸引阳离子。而在(NH4)2SO4、NH4Cl、(NH4)2CO3中氮元素只存在于NH4+中,能被土壤胶粒吸附;而在NH4NO3中,氮元素还存在于NO3-中,NO3-是带负电荷的,不能被土壤胶粒吸引,可能会流失,降低肥效。
5.实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大
(1)向Fe(OH)3胶体中加入下列电解质时,其凝聚能力最强的为_________(填序号)。
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,______(填序号)效果最明显,原因是_________________。
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
【解析】(1)Fe(OH)3胶粒带正电,阴离子可中和其电性使其聚沉,Cl-、SO42-、PO43-中PO43-所带电荷最多,其聚沉能力最强。(2)加入带正电荷最多的阳离子,可使黏土溶胶聚沉效果最明显。
答案:(1)④ (2)B Al3+所带正电荷数最大,使黏土溶胶凝聚效果最好
一、选择题(本题包括5小题,每小题4分,共20分)
1.2010年4月,冰岛南部埃亚菲亚德拉冰盖火山喷发,火山灰形成的烟尘几乎使整个欧洲的航线陷于瘫痪。烟尘属于下列分散系中的( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
【解析】选D。云、烟、雾都是胶体,属于气溶胶。
2.(2010·大庆高一检测)如图是同学们经常使用的某品牌修正液包装标签。小明仔
细阅读后,结合自己的生活经验
和所学知识得出了修正液的某些
性质,小明的推测中不合理的是
( )
A.修正液是一种液体,均一、稳定
B.修正液中含有有毒的化学物质
C.修正液的成分对纸张不具腐蚀性
D.修正液的溶剂易挥发、易燃
【解析】选A。由说明书要求使用前摇匀修正液,可知修正液不均一稳定,所以它不是胶体;由用完后及时盖帽的要求及易燃品标识,可知D是正确的;严禁食用,说明B项正确;由生活经验可知C项也是正确的。
3.下列有关Fe(OH)3胶体的说法正确的是( )
A.用渗析法鉴别Fe(OH)3胶体和FeCl3溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液
B.Fe(OH)3胶体微粒带负电荷,在通电的情况下胶体微粒向直流电源的正极移动,这种现象称为电泳
C.向沸腾的蒸馏水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时即得到Fe(OH)3胶体
D.向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅拌,然后继续煮沸,制备Fe(OH)3胶体
【解析】选C。胶体和溶液可用丁达尔效应鉴别,用渗析法分离;金属氢氧化物的胶体微粒应带正电荷,故应向直流电源的负极移动;Fe(OH)3胶体制备时应将饱和FeCl3溶液滴加至沸水中,不能加到NaOH溶液中。
4.下列各组物质中,可用渗析法分离的是( )
A.CaCO3和Na2CO3
B.NaCl和KNO3
C.汽油和水
D.Fe(OH)3胶体和FeCl3溶液
【解析】选D。渗析方法适用于胶体和溶液的分离。渗析时,可用半透膜包住混合物,在流水中冲洗。
5.下列现象或新技术应用中,不涉及胶体性质的是
( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的尿中毒,可利用血液透析
【解析】选A。A中生成了Fe(OH)3沉淀,不是胶体。B利用微波加速血液的聚沉;C为胶体的丁达尔现象;D中血液透析利用了半透膜原理,透析相当于胶体的渗析提纯。
二、非选择题(本题包括1小题,共10分)
6.将1 mol/L的FeCl3溶液逐滴滴入沸水中,液体变为_____色,得到的是___________;反应的化学方程式为_________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_______,这表明____________,这种现象称为____________。
(2)向其中加入饱和(NH4)2SO4溶液,发生的现象是_________________。
(3)向其中逐滴加入过量稀硫酸,现象是________;原因是________________________。
【解析】本题考查了Fe(OH)3胶体的制备和性质。
(1)Fe(OH)3胶体为红褐色,发生反应:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。Fe(OH)3胶体微粒是带正电荷
的,通电后会向阴极移动,所以阴极颜色会加深;
(2)加入(NH4)2SO4溶液,(NH4)2SO4电离出的SO42-
会中和胶粒所带电荷,使胶体聚沉;(3)向Fe(OH)3胶
体中加H2SO4,除聚沉外,Fe(OH)3又可与H2SO4发生中和反
应,所以加H2SO4后,胶体先沉淀,后溶解。
△
====
答案:红褐 Fe(OH)3胶体 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
(1)逐渐加深 Fe(OH)3胶粒带正电荷 电泳
(2)形成红褐色沉淀 (3)先出现红褐色沉淀,后沉淀溶解 H2SO4电离产生的SO42-使Fe(OH)3胶体聚沉后,电离出的H+又与Fe(OH)3沉淀发生中和反应使其溶解
△
====
1.(5分)(双选)某胶体遇盐卤(含Mg2+)或石膏易发生聚沉,而遇食盐水或Na2SO4溶液不易发生聚沉,有关解释正确的是( )
A.胶粒的直径为1~100 nm
B.该胶粒带有正电荷
C.Na+使此胶体聚沉的效果不如Mg2+、Ca2+
D.该胶体遇Fe(OH)3胶体发生聚沉
【解析】选C、D。该胶体遇Mg2+或石膏(CaSO4)易发生聚沉,而遇NaCl或Na2SO4不易聚沉,可说明是高价阳离子使该胶体发生聚沉,从而判断该胶体胶粒是带负电荷的。A项是所有胶体的通性,不是产生该现象的原因;而Fe(OH)3胶粒是带正电荷的,加入带相反电荷的胶粒也能使胶体聚沉。
2.(15分)某化学课外活动小组为了探究胶体的胶粒和溶液的溶质粒子是否能透过半透膜,以及寻找净化胶体的方法,设计了如下渗析实验:
如图所示,在一个半透膜袋中装入由淀粉胶体和少量食盐溶液组成的液体分散系,将此袋系在玻璃棒上并浸入水槽里的蒸馏水中。
请回答下列有关问题:
(1)几分钟后,取水槽中的水于试管中,并向试管内加入少量的用HNO3酸化的AgNO3溶液,发现产生了白色沉淀;另取水槽中的水于试管中,并向试管内加入少量的碘水,未发现新现象,通过这两项实验说明,能透过半透膜的粒子是________,不能透过半透膜的粒子是_______;通过以上实验可以达到的目的是______
__________________________________。
(2)为了尽快达到完全渗析的目的,可以采取的措施是
_______________________________________。
(3)实验室中用饱和FeCl3溶液制备Fe(OH)3胶体时,发现制得的胶体中还有一部分未反应的FeCl3,并且胶体略显浑浊,将该胶体进行净化的方法的操作名称是__________________。
【解析】(1)由题意知,加入HNO3酸化的AgNO3溶液后,产生了白色沉淀,说明蒸馏水中含有NaCl,即Na+、Cl-能透过半透膜;加入少量的碘水后,未发现新现象,说明蒸馏水中不含淀粉,即淀粉胶粒不能透过半透膜;通过以上实验可以达到的目的是:用该实验可以除去淀粉胶体中的NaCl。
(2)为了尽快达到完全渗析的目的,根据高浓度向低浓度扩散原理可以用玻璃棒搅拌水槽中的水,过一段时间就更换水槽里的水。
(3)由于Fe(OH)3胶体中混有未反应的FeCl3,分离两物质时采用渗析的方法;由于Fe(OH)3胶体略显浑浊,说明Fe(OH)3胶体中混有Fe(OH)3沉淀,分离两物质时采用过滤的方法。
答案:(1)Na+和Cl- 淀粉胶粒 分离胶体和溶液的混合物 (2)用玻璃棒轻轻地搅拌水槽中的水,过一段时间后更换水槽中的水 (3)过滤、渗析
