10-11高中化学课时讲练通课件:3.1.2 碳的多样性(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.1.2 碳的多样性(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 08:12:09 | ||
图片预览









文档简介
(共62张PPT)
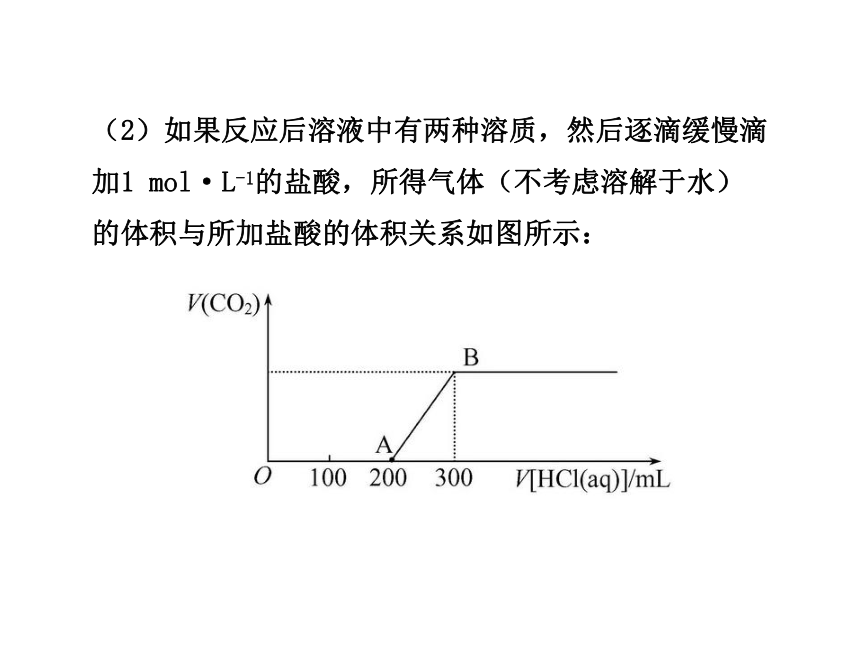
【典例1】向100 mL 3 mol·L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是__;
(2)如果反应后溶液中有两种溶质,然后逐滴缓慢滴加1 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_________。
②产生的CO2在标准状况下的体积为__mL。
③B点时,反应所得溶液中溶质的物质的量浓度是__mol·L-1(溶液体积的变化忽略不计)。
【思路点拨】(1)明确CO2与NaOH溶液反应后溶质的可能组合。(2)根据图像中OA段与AB段消耗盐酸的多少关系确定溶液中溶质的成分。
【自主解答】
答案:(1)Na2CO3或NaHCO3
(2)①OH-+H+ ==== H2O,CO32-+H+ ==== HCO3-
②2 240 ③0.75
【典例2】将足量的CO2通入KOH和Ca(OH)2混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
【思路点拨】(1)首先分析CO2与混合溶液反应的过程;
(2)根据各段反应的方程式得出正确图像。
【自主解答】选D。将足量CO2通入KOH和Ca(OH)2混合液中,首先发生的反应为CO2+Ca(OH)2 ==== CaCO3↓
+H2O①,然后发生CO2与KOH的反应:2KOH+CO2 ==== K2CO3+H2O,K2CO3+CO2+H2O ==== 2KHCO3, 即通入CO2后先生成CaCO3沉淀,后沉淀的量不变。随着CO2的通入,CaCO3沉淀溶解:CaCO3+CO2+H2O ==== Ca(HCO3)2②,由①②两个方程式可以看出CaCO3沉淀生成与消耗的量是相等的,且消耗的CO2的量也是相等的,故这两部分的图像是对称的,应选D。
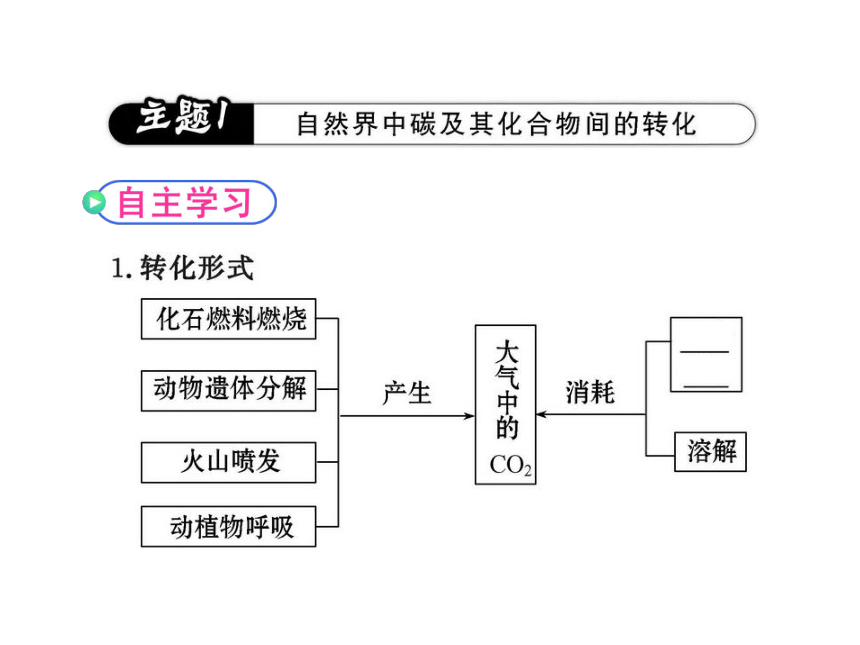
知识点一:CO2与环境问题
1.世界气候变化峰会于2009年 12月19日在丹麦首都哥本哈根闭幕,该峰会讨论了某种气体的各国的排放量,该气体会引起温室效应。则该气体是( )
A.NO B.SO2 C.CO2 D.氟里昂
【解析】选C。NO会引起光化学烟雾及酸雨,SO2引起酸雨,氟里昂导致臭氧空洞。
知识点二:碳及化合物之间的转化
2.将CO2通入下列溶液直至过量,最终溶液中一定有沉淀的是( )
A.Ca(ClO)2溶液 B.饱和Na2CO3溶液
C.CaCl2溶液 D.Ca(OH)2溶液
解题提示:CaCO3存在于中性或碱性环境中,如果
反应前或反应后为酸性环境,则不会有CaCO3生成。
【解析】选B。A、D均先生成CaCO3,CaCO3再溶解。C与CO2不反应。B生成NaHCO3,因NaHCO3的溶解度小于Na2CO3,所以从饱和溶液中析出。
3.无色气体X和灼热的碳反应得到一无色气体Y,Y和灼
热的氧化铜反应又得到无色气体X,则X、Y分别是
( )
A.O2、CO2 B.CO2、CO
C.CO、CO2 D.O2、CO
【解析】选B。根据无色气体X和灼热的碳反应生成的
无色气体Y能与灼热的氧化铜反应,则Y不可能是O2,
也不会是CO2,从而可确定Y是CO,再由X+C CO可
推出X是CO2。也可用代入法进行验证。
4.下列各溶液与盐酸反应,不能用离子方程式HCO3-+H+ ==== CO2↑+H2O表示该化学反应的是( )
A.碳酸氢钾溶液 B.纯碱溶液
C.碳酸氢钙溶液 D.小苏打溶液
【解析】选B。B的离子方程式应为
CO32-+2H+ ==== H2O+CO2↑
或CO32-+H+ ==== HCO3-
5.物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___,B是___,C是___,X粉未是
___。
(2)写出反应Ⅰ的化学方程式________。
(3)写出反应Ⅱ的离子方程式________。
【解析】本题是一道无机推断题,解题的关键是抓住
“题眼”,即“淡黄色粉末”、“蓝色沉淀”,又因
淡黄色粉末A+CO2 气体B+固体C,故A应为Na2O2,B为
O2,C为Na2CO3,蓝色沉淀很显然为Cu(OH)2,则Na2CO3与
澄清石灰水反应生成的白色沉淀为CaCO3,无色溶液为
NaOH。又由O2+X粉未 黑色固体,而黑色固体与
稀H2SO4反应生成含Cu2+的蓝色溶液,则X为Cu,黑色固体为CuO。由此可顺利得出答案。
答案:(1)Na2O2 O2 Na2CO3 Cu
(2)2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)Cu2++2OH- ==== Cu(OH)2↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.大气中二氧化碳增加,影响植物的生长,例如水果越来越大。这提示我们,随着大气中二氧化碳含量升高,( )
A.植物中的有机物含量降低
B.植物的生长速率降低
C.植物光合作用减弱
D.植物光合作用增强
【解析】选D。题干中提示“例如水果越来越大”,就意味着光合作用增强。
2.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A.NaHCO3和NaOH B.NaOH和CO2
C.Na和O2 D.Na2CO3和HCl
【解析】选A。B中的产物可能为Na2CO3或NaHCO3。C中的产物可能为Na2O或Na2O2。D中的产物可能为NaHCO3或NaCl。A中产物只能为Na2CO3和H2O。
3.请据图回答,经数小时后,U形管A、B两处的液面会出现下列哪种情况(实验装置里的空气足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
A.A处上升,B处下降 B.A、B两处都下降
C.A处下降,B处上升 D.A、B两处都不变
【解析】选C。由于小白鼠吸入O2,呼出CO2,呼出的CO2被NaOH溶液吸收后,密闭容器内压强减小,致使A处液面下降,B处液面上升。
4.由气体甲开始,可发生如下四个变化:
则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
【解析】选C。乙能与石灰水生成固体,则乙为CO2,丁为CaCO3;乙与灼热的炭反应生成丙,丙能还原CuO,则丙为CO,同时也进一步说明乙为CO2,甲气体为O2。
5.(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
【解析】选C。向溶液中滴加0.1 mol·L-1稀盐酸,稀盐酸会先和NaOH反应,然后再和Na2CO3反应产生CO2,
0.4 g NaOH的物质的量为0.01 mol,完全反应消耗HCl 0.01 mol,1.06 g Na2CO3的物质的量为0.01 mol,完
全反应消耗HCl 0.02 mol,产生CO2 0.01 mol;故图像C是正确的。
二、非选择题(本题包括1小题,共10分)
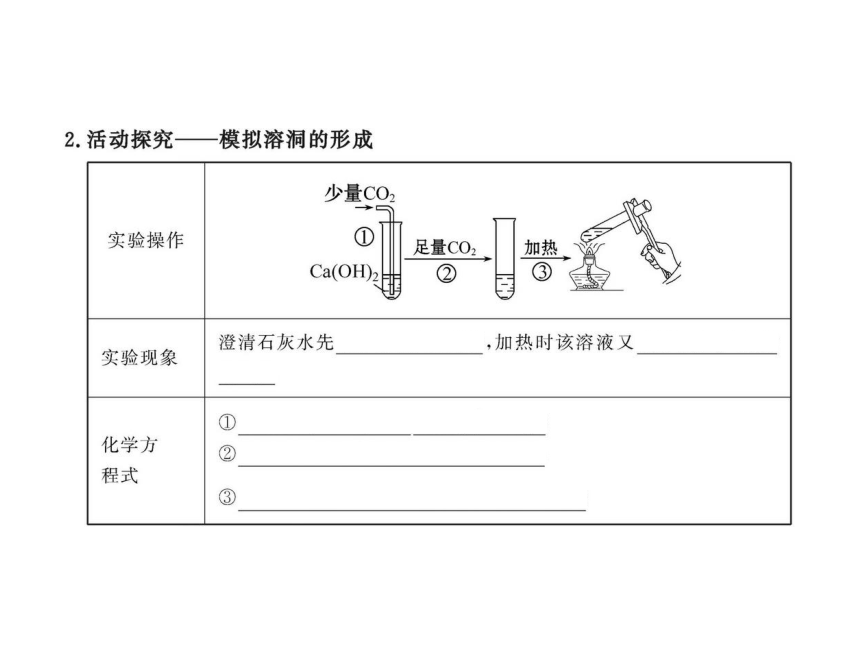
6.向一定量的饱和Ca(OH)2溶液中通入CO2气体,产生CaCO3白色沉淀的质量与通入的CO2气体之间的关系曲线如图所示,试回答:
(1)OA段曲线与AB段曲线所表示的反应的化学方程式
________。
(2)A点时已参加反应的CO2与Ca(OH)2的物质的量之比为___。
(3)B处溶液中存在的浓度较大的两种离子是____和____(填离子符号)
(4)将B处生成的溶液煮沸,可看到的现象是________。
【解析】(1)CO2通入到Ca(OH)2溶液中,先发生
Ca(OH)2+CO2 ==== CaCO3↓+H2O,后发生CaCO3+H2O+
CO2 ===== Ca(HCO3)2。OA段沉淀质量逐渐增多,所以
OA段应发生上述第一个反应,AB段发生第二个反应。
(2)由上述反应知到A点时,CO2与Ca(OH)2物质的量之比为1∶1。
(3)B处溶液中溶质为Ca(HCO3)2,浓度较大的离子为HCO3-和Ca2+。
(4)B处为Ca(HCO3)2溶液,加热煮沸逐渐转化生成CaCO3。
答案:(1)OA:Ca(OH)2+CO2 ==== CaCO3↓+H2O;
AB:CaCO3+H2O+CO2 ==== Ca(HCO3)2
(2)1∶1 (3)Ca2+ HCO3- (4)有白色沉淀生成
1.(5分)某混合气体中可能含有H2、CO、CO2、HCl及水蒸气中的两种或多种,混合气体依次通过①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓硫酸(无现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。则对该混合气体成分的判断正确的是( )
A.一定没有CO2,肯定有CO和H2
B.一定有CO、CO2和水蒸气
C.一定有H2和CO2
D.有CO2和水蒸气
【解析】选C。澄清石灰水没有变浑浊,而氢氧化钡溶液变浑浊了,说明气体有两种可能:①原气体中有大量的CO2,它与Ca(OH)2反应生成Ca(HCO3)2溶液后还有剩余,通过Ba(OH)2因生成了BaCO3沉淀而变浑浊;
②原气体有CO2和HCl,通过Ca(OH)2时HCl被吸收掉从而生成CaCl2,CO2不与CaCl2反应,所以无现象,再通过Ba(OH)2时,CO2与之反应生成了BaCO3沉淀而变浑浊。从题干后面所给信息不难判断出一定有H2。
2.(15分)课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
下面是关于“一氧化碳的化学性质”的课题式课堂教学中的解决问题阶段,甲同学设计的证明一氧化碳具有还原性的实验装置如图所示。
(1)点燃酒精灯A、B的先后顺序为:先__后__。
(2)硬质玻璃管中发生反应的化学方程式为___。
(3)洗气瓶中的实验现象为______。
(4)酒精灯B的作用为______。
(5)乙同学认为甲同学设计的装置有待优
化,如尾气可先储存在瓶内,然后再处理。
如图是他设计的贮气瓶,尾气应从___
(填“a”或“b”)口通入。
(6)丙同学质疑:一氧化碳能否使澄清石灰水变浑浊?因此,在一氧化碳通入氧化铜之前,应先通入澄清石灰水,以排除一氧化碳与澄清石灰水反应。你认为丙的设计__(填“必要”或“不必要”)。
【解析】本题考查CO还原CuO实验,同时综合考查了实
验设计与评价,由于CO+CuO Cu+CO2,CO能把CuO
还原成Cu,而本身被氧化成CO2,故会观察到硬质玻璃
管中黑色粉末变成红色,同时澄清石灰水变浑浊。
△
====
由于CO有毒,尾气必须经过燃烧处理,因此B处酒精灯的作用就是燃烧除去多余的CO;当检验CO是否能使石灰水变浑浊时,可在不点燃A处酒精灯时,先让CO通入石灰水来进行验证,没必要在CO通入CuO之前先通入澄清石灰水来进行验证。
答案:(1)B A (2)CuO+CO Cu+CO2
(3)澄清石灰水变浑浊
(4)通过燃烧除去多余的CO
(5)a (6)不必要
△
====
【典例1】向100 mL 3 mol·L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是__;
(2)如果反应后溶液中有两种溶质,然后逐滴缓慢滴加1 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_________。
②产生的CO2在标准状况下的体积为__mL。
③B点时,反应所得溶液中溶质的物质的量浓度是__mol·L-1(溶液体积的变化忽略不计)。
【思路点拨】(1)明确CO2与NaOH溶液反应后溶质的可能组合。(2)根据图像中OA段与AB段消耗盐酸的多少关系确定溶液中溶质的成分。
【自主解答】
答案:(1)Na2CO3或NaHCO3
(2)①OH-+H+ ==== H2O,CO32-+H+ ==== HCO3-
②2 240 ③0.75
【典例2】将足量的CO2通入KOH和Ca(OH)2混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
【思路点拨】(1)首先分析CO2与混合溶液反应的过程;
(2)根据各段反应的方程式得出正确图像。
【自主解答】选D。将足量CO2通入KOH和Ca(OH)2混合液中,首先发生的反应为CO2+Ca(OH)2 ==== CaCO3↓
+H2O①,然后发生CO2与KOH的反应:2KOH+CO2 ==== K2CO3+H2O,K2CO3+CO2+H2O ==== 2KHCO3, 即通入CO2后先生成CaCO3沉淀,后沉淀的量不变。随着CO2的通入,CaCO3沉淀溶解:CaCO3+CO2+H2O ==== Ca(HCO3)2②,由①②两个方程式可以看出CaCO3沉淀生成与消耗的量是相等的,且消耗的CO2的量也是相等的,故这两部分的图像是对称的,应选D。
知识点一:CO2与环境问题
1.世界气候变化峰会于2009年 12月19日在丹麦首都哥本哈根闭幕,该峰会讨论了某种气体的各国的排放量,该气体会引起温室效应。则该气体是( )
A.NO B.SO2 C.CO2 D.氟里昂
【解析】选C。NO会引起光化学烟雾及酸雨,SO2引起酸雨,氟里昂导致臭氧空洞。
知识点二:碳及化合物之间的转化
2.将CO2通入下列溶液直至过量,最终溶液中一定有沉淀的是( )
A.Ca(ClO)2溶液 B.饱和Na2CO3溶液
C.CaCl2溶液 D.Ca(OH)2溶液
解题提示:CaCO3存在于中性或碱性环境中,如果
反应前或反应后为酸性环境,则不会有CaCO3生成。
【解析】选B。A、D均先生成CaCO3,CaCO3再溶解。C与CO2不反应。B生成NaHCO3,因NaHCO3的溶解度小于Na2CO3,所以从饱和溶液中析出。
3.无色气体X和灼热的碳反应得到一无色气体Y,Y和灼
热的氧化铜反应又得到无色气体X,则X、Y分别是
( )
A.O2、CO2 B.CO2、CO
C.CO、CO2 D.O2、CO
【解析】选B。根据无色气体X和灼热的碳反应生成的
无色气体Y能与灼热的氧化铜反应,则Y不可能是O2,
也不会是CO2,从而可确定Y是CO,再由X+C CO可
推出X是CO2。也可用代入法进行验证。
4.下列各溶液与盐酸反应,不能用离子方程式HCO3-+H+ ==== CO2↑+H2O表示该化学反应的是( )
A.碳酸氢钾溶液 B.纯碱溶液
C.碳酸氢钙溶液 D.小苏打溶液
【解析】选B。B的离子方程式应为
CO32-+2H+ ==== H2O+CO2↑
或CO32-+H+ ==== HCO3-
5.物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___,B是___,C是___,X粉未是
___。
(2)写出反应Ⅰ的化学方程式________。
(3)写出反应Ⅱ的离子方程式________。
【解析】本题是一道无机推断题,解题的关键是抓住
“题眼”,即“淡黄色粉末”、“蓝色沉淀”,又因
淡黄色粉末A+CO2 气体B+固体C,故A应为Na2O2,B为
O2,C为Na2CO3,蓝色沉淀很显然为Cu(OH)2,则Na2CO3与
澄清石灰水反应生成的白色沉淀为CaCO3,无色溶液为
NaOH。又由O2+X粉未 黑色固体,而黑色固体与
稀H2SO4反应生成含Cu2+的蓝色溶液,则X为Cu,黑色固体为CuO。由此可顺利得出答案。
答案:(1)Na2O2 O2 Na2CO3 Cu
(2)2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)Cu2++2OH- ==== Cu(OH)2↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.大气中二氧化碳增加,影响植物的生长,例如水果越来越大。这提示我们,随着大气中二氧化碳含量升高,( )
A.植物中的有机物含量降低
B.植物的生长速率降低
C.植物光合作用减弱
D.植物光合作用增强
【解析】选D。题干中提示“例如水果越来越大”,就意味着光合作用增强。
2.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A.NaHCO3和NaOH B.NaOH和CO2
C.Na和O2 D.Na2CO3和HCl
【解析】选A。B中的产物可能为Na2CO3或NaHCO3。C中的产物可能为Na2O或Na2O2。D中的产物可能为NaHCO3或NaCl。A中产物只能为Na2CO3和H2O。
3.请据图回答,经数小时后,U形管A、B两处的液面会出现下列哪种情况(实验装置里的空气足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
A.A处上升,B处下降 B.A、B两处都下降
C.A处下降,B处上升 D.A、B两处都不变
【解析】选C。由于小白鼠吸入O2,呼出CO2,呼出的CO2被NaOH溶液吸收后,密闭容器内压强减小,致使A处液面下降,B处液面上升。
4.由气体甲开始,可发生如下四个变化:
则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
【解析】选C。乙能与石灰水生成固体,则乙为CO2,丁为CaCO3;乙与灼热的炭反应生成丙,丙能还原CuO,则丙为CO,同时也进一步说明乙为CO2,甲气体为O2。
5.(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
【解析】选C。向溶液中滴加0.1 mol·L-1稀盐酸,稀盐酸会先和NaOH反应,然后再和Na2CO3反应产生CO2,
0.4 g NaOH的物质的量为0.01 mol,完全反应消耗HCl 0.01 mol,1.06 g Na2CO3的物质的量为0.01 mol,完
全反应消耗HCl 0.02 mol,产生CO2 0.01 mol;故图像C是正确的。
二、非选择题(本题包括1小题,共10分)
6.向一定量的饱和Ca(OH)2溶液中通入CO2气体,产生CaCO3白色沉淀的质量与通入的CO2气体之间的关系曲线如图所示,试回答:
(1)OA段曲线与AB段曲线所表示的反应的化学方程式
________。
(2)A点时已参加反应的CO2与Ca(OH)2的物质的量之比为___。
(3)B处溶液中存在的浓度较大的两种离子是____和____(填离子符号)
(4)将B处生成的溶液煮沸,可看到的现象是________。
【解析】(1)CO2通入到Ca(OH)2溶液中,先发生
Ca(OH)2+CO2 ==== CaCO3↓+H2O,后发生CaCO3+H2O+
CO2 ===== Ca(HCO3)2。OA段沉淀质量逐渐增多,所以
OA段应发生上述第一个反应,AB段发生第二个反应。
(2)由上述反应知到A点时,CO2与Ca(OH)2物质的量之比为1∶1。
(3)B处溶液中溶质为Ca(HCO3)2,浓度较大的离子为HCO3-和Ca2+。
(4)B处为Ca(HCO3)2溶液,加热煮沸逐渐转化生成CaCO3。
答案:(1)OA:Ca(OH)2+CO2 ==== CaCO3↓+H2O;
AB:CaCO3+H2O+CO2 ==== Ca(HCO3)2
(2)1∶1 (3)Ca2+ HCO3- (4)有白色沉淀生成
1.(5分)某混合气体中可能含有H2、CO、CO2、HCl及水蒸气中的两种或多种,混合气体依次通过①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓硫酸(无现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。则对该混合气体成分的判断正确的是( )
A.一定没有CO2,肯定有CO和H2
B.一定有CO、CO2和水蒸气
C.一定有H2和CO2
D.有CO2和水蒸气
【解析】选C。澄清石灰水没有变浑浊,而氢氧化钡溶液变浑浊了,说明气体有两种可能:①原气体中有大量的CO2,它与Ca(OH)2反应生成Ca(HCO3)2溶液后还有剩余,通过Ba(OH)2因生成了BaCO3沉淀而变浑浊;
②原气体有CO2和HCl,通过Ca(OH)2时HCl被吸收掉从而生成CaCl2,CO2不与CaCl2反应,所以无现象,再通过Ba(OH)2时,CO2与之反应生成了BaCO3沉淀而变浑浊。从题干后面所给信息不难判断出一定有H2。
2.(15分)课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
下面是关于“一氧化碳的化学性质”的课题式课堂教学中的解决问题阶段,甲同学设计的证明一氧化碳具有还原性的实验装置如图所示。
(1)点燃酒精灯A、B的先后顺序为:先__后__。
(2)硬质玻璃管中发生反应的化学方程式为___。
(3)洗气瓶中的实验现象为______。
(4)酒精灯B的作用为______。
(5)乙同学认为甲同学设计的装置有待优
化,如尾气可先储存在瓶内,然后再处理。
如图是他设计的贮气瓶,尾气应从___
(填“a”或“b”)口通入。
(6)丙同学质疑:一氧化碳能否使澄清石灰水变浑浊?因此,在一氧化碳通入氧化铜之前,应先通入澄清石灰水,以排除一氧化碳与澄清石灰水反应。你认为丙的设计__(填“必要”或“不必要”)。
【解析】本题考查CO还原CuO实验,同时综合考查了实
验设计与评价,由于CO+CuO Cu+CO2,CO能把CuO
还原成Cu,而本身被氧化成CO2,故会观察到硬质玻璃
管中黑色粉末变成红色,同时澄清石灰水变浑浊。
△
====
由于CO有毒,尾气必须经过燃烧处理,因此B处酒精灯的作用就是燃烧除去多余的CO;当检验CO是否能使石灰水变浑浊时,可在不点燃A处酒精灯时,先让CO通入石灰水来进行验证,没必要在CO通入CuO之前先通入澄清石灰水来进行验证。
答案:(1)B A (2)CuO+CO Cu+CO2
(3)澄清石灰水变浑浊
(4)通过燃烧除去多余的CO
(5)a (6)不必要
△
====
