10-11高中化学课时讲练通课件:3.2.3 氮的循环(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.2.3 氮的循环(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览









文档简介
(共44张PPT)
【典例】将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全溶解时收集到气体1.12 L(标准状况),则消耗硝酸的物质的量是
A.0.12 mol B.0.11 mol
C.0.09 mol D.0.08 mol
【思路点拨】解答本题要注意以下两点:
(1)由得失电子守恒分析出气体的成分。
(2)可以通过化学方程式建立方程组求解。也可以利用氮原子守恒求解。
【自主解答】选B。若1.12 L气体全部为NO2,则与所给铜的量矛盾。随着反应的进行,浓硝酸不断变稀,又
生成了NO。则通过分析反应过程可得
N化合价不变:2HNO3~Cu(NO3)2 N化合价改变:
HNO3(浓)~NO2
N化合价改变:HNO3(稀)~NO 则根据氮原子守恒可得所消耗的硝酸的物质的量n(HNO3)(为化合价不变)+n(HNO3)(化合价改变)=2n(Cu)+n(NO)+n(NO2)=
=0.11 mol。
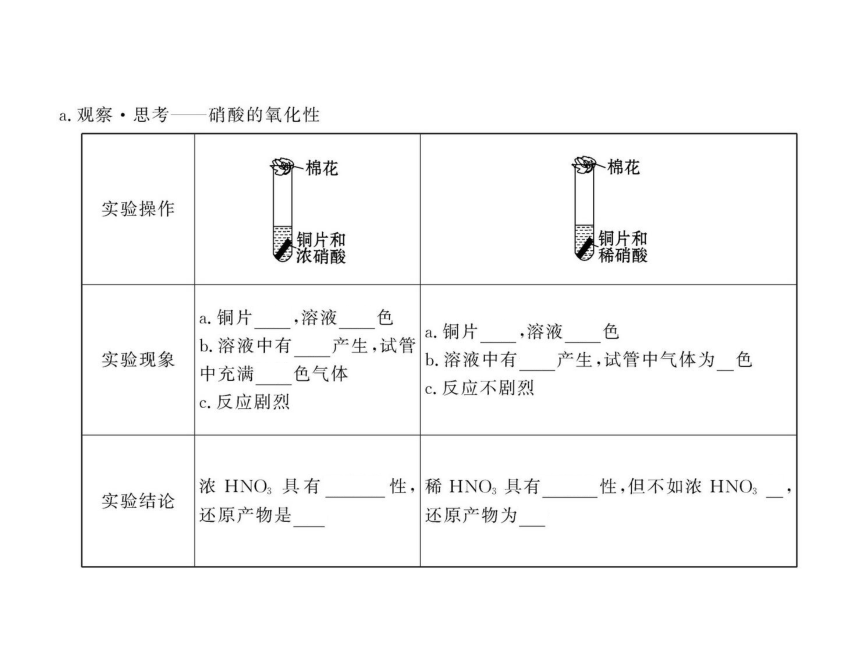
知识点一:硝酸
1.实验室不需用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.硝酸银
C.氯水 D.浓盐酸
【解析】选D。见光或受热易分解的应用棕色试剂瓶保存,A、B、C都见光易分解,浓盐酸易挥发,不分解。
2.下列反应中,浓硝酸既表现出氧化性又表现出酸性的是( )
A.浓硝酸中滴入石蕊试液并微热
B.氧化铁与浓硝酸反应
C.氢氧化铝与浓硝酸反应
D.碳与浓硝酸反应
【解析】选A。在浓硝酸中滴入石蕊试液,石蕊试液先变红,此时浓硝酸表现出酸性,后退色,浓硝酸又表现出强氧化性。
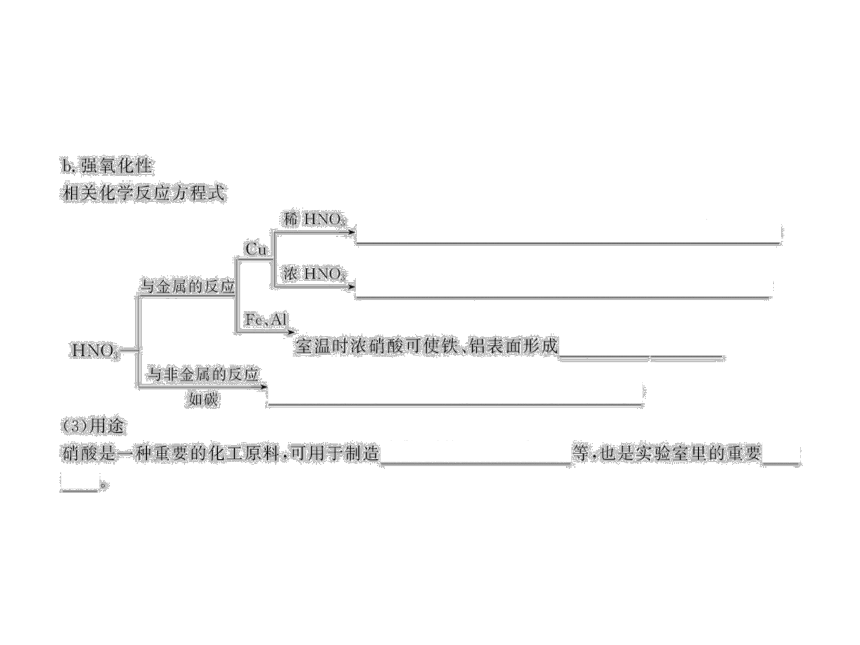
3.为除去镀在铝表面的铜镀层,可选用的试剂是
( )
A.稀硝酸 B.浓硝酸
C.浓硫酸 D.浓盐酸
【解析】选B。除去铝表面的铜镀层,所选用的试剂应只跟铜反应而不跟铝反应或能使铝钝化。稀硝酸既能溶解铜又能溶解铝;常温下浓硫酸跟铜不反应,加热时浓硫酸与铜、铝均能反应(此时钝化膜被破坏);浓盐酸不与铜反应;常温下,浓硝酸与铜反应而使铜镀层溶解,铝则因为钝化而被保护。
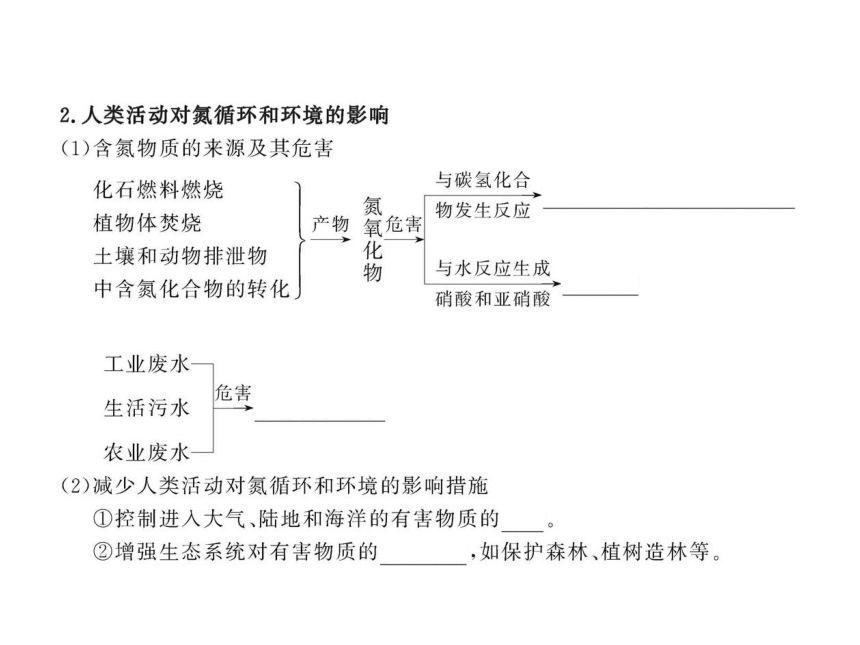
知识点二:人类活动对氮循环和环境的影响
4.下列与氮循环无关的生态环境问题是( )
A.温室效应 B.白色污染
C.水体富营养化 D.酸雨
【解析】选B。与氮循环有关的环境问题主要有温室效应、水体污染及酸雨,其污染物分别为N2O、硝酸盐和铵盐等氮肥、硝酸。
5.可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策。汽车尾气(含有烃类、CO、SO2和NO等物质)是城市空气的污染源,治理方法之一是在汽车排气管上装一个“催化转化器”(用铂?钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的催化氧化。
(1)写出CO与NO在催化剂作用下的化学反应方程式
______。
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______。
(3)控制城市空气污染源方法可行的有__。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
【解析】汽车尾气是大气污染的一个主要来源,设法减少汽车尾气中有害气体的含量是控制污染的源头,污染一旦形成,设法降低其危害属于治理,消除污染必须标本兼治。
答案:(1)2CO+2NO 催化剂 2CO2+N2
(2)SO2转化为SO3,产生硫酸酸雾
(3)A、B
=====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列气体能造成空气中光化学污染的是( )
A.CO2 B.Cl2
C.SO2 D.NO和NO2
【解析】选D。CO2造成温室效应,SO2形成酸雨,NO和NO2等氮氧化物形成光化学烟雾和酸雨。
2.常温下不能溶于浓硝酸的金属是( )
A.Cu B.Na
C.Al D.Mg
【解析】选C。常温下,铁、铝在浓硝酸中会钝化,但在加热的条件下会反应生成NO2。
3.将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
【解析】选B。浓度越大,反应越快,浓HNO3反应快,
产生气泡快,A错。相同的铜,消耗硝酸的量分别为
Cu~ HNO3(稀),Cu~4HNO3(浓),B对。浓硝酸
反应时生成红棕色的NO2,稀硝酸反应生成无色的NO,
C错。相同的Cu全部反应,转移电子数相同,D错。
4.将铜粉放入稀H2SO4中,加热后无明显现象,但当加入某物质后,铜粉质量减少,溶液呈蓝色且有气体逸出,此物质是( )
A.Na2CO3 B.KNO3
C.NaOH D.HCl
【解析】选B。因铜的活动性比氢弱而铜与稀硫酸不能发生反应,但在加入硝酸盐后因引入NO3-,使得发生下列反应:3Cu+2NO3-+8H+ ==== 3Cu2++2NO↑+4H2O,使溶液呈蓝色且有气体逸出。故正确答案为B。
5.将6.4 g铜与400 mL 5 mol·L-1的足量HNO3溶液充分反应,还原产物为NO2和NO。如果反应结束后的溶液中含有H+ a mol,则此时溶液中NO3-的物质的量为
( )
A.0.5a mol B.(a+0.2)mol
C.2a mol D.(0.2-a)mol
【解析】选B。反应后溶液为HNO3和Cu(NO3)2的混合溶液,所以n(NO3-)=n(H+)+2n(Cu2+)=(a+0.1×2)mol=(a+0.2)mol
二、非选择题(本题包括1小题,共10分)
6.在下列反应或处理方式中,分别体现或利用了硝酸的什么性质,请把有关的字母填在题后的空白处:
A.酸性 B.氧化性
C.挥发性 D.不稳定性
①石蕊试液滴入浓硝酸中显红色,放置后又变无色
________。
②碳酸钙放入硝酸中,可以溶解并放出气体__。
③用铝槽车运输浓硝酸__。
④用黑纸包裹盛有浓硝酸的试剂瓶__ 。
【解析】①酸性使石蕊变红,氧化性使石蕊被氧化而变无色。
②硝酸酸性强于碳酸,是强酸制备弱酸。
③常温下,铝在浓硝酸中钝化。
④浓硝酸不稳定,受热或见光易分解。
答案:①A、B ②A ③B ④D
(20分)在100 mL某混合酸中,HNO3的物质的量浓度为0.4 mol·L-1,H2SO4的物质的量浓度为
0.1 mol·L-1,向其中加入1.92 g铜粉,微热,待充分反应后,求溶液中Cu2+的物质的量浓度为多少?
【解析】在100 mL溶液中,HNO3和H2SO4共电离出
0.06 mol H+、0.04 mol NO3-和0.01 mol SO42-。Cu和 0.04 mol HNO3完全反应后还有剩余,此时溶液中仍有0.03 mol NO3-和0.02 mol H+。 0.015 mol Cu2+、
0.01 mol SO42-,由此可见,溶液中还有相当于
0.02 mol HNO3存在仍可和Cu反应。
可根据铜和稀硝酸反应的离子方程式计算:
3Cu+2NO3-+8H+ ==== 3Cu2++2NO↑+4H2O
1.92 g Cu即0.03 mol Cu完全溶解,需n(H+)=
0.08 mol,n(NO3-)=0.02 mol,而此时溶液中有
0.06 mol的H+(不足量)、0.04 mol NO3-(足量),因此按H+的物质的量进行计算
8H+ ~ 3Cu2+
8 3
0.06 mol n(Cu2+)
所以Cu2+的物质的量为n(Cu2+)= =
0.022 5 mol,则Cu2+的物质的量浓度为c(Cu2+)=
=0.225 mol·L-1。
答案:Cu2+的物质的量浓度为0.225 mol·L-1。
【典例】将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全溶解时收集到气体1.12 L(标准状况),则消耗硝酸的物质的量是
A.0.12 mol B.0.11 mol
C.0.09 mol D.0.08 mol
【思路点拨】解答本题要注意以下两点:
(1)由得失电子守恒分析出气体的成分。
(2)可以通过化学方程式建立方程组求解。也可以利用氮原子守恒求解。
【自主解答】选B。若1.12 L气体全部为NO2,则与所给铜的量矛盾。随着反应的进行,浓硝酸不断变稀,又
生成了NO。则通过分析反应过程可得
N化合价不变:2HNO3~Cu(NO3)2 N化合价改变:
HNO3(浓)~NO2
N化合价改变:HNO3(稀)~NO 则根据氮原子守恒可得所消耗的硝酸的物质的量n(HNO3)(为化合价不变)+n(HNO3)(化合价改变)=2n(Cu)+n(NO)+n(NO2)=
=0.11 mol。
知识点一:硝酸
1.实验室不需用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.硝酸银
C.氯水 D.浓盐酸
【解析】选D。见光或受热易分解的应用棕色试剂瓶保存,A、B、C都见光易分解,浓盐酸易挥发,不分解。
2.下列反应中,浓硝酸既表现出氧化性又表现出酸性的是( )
A.浓硝酸中滴入石蕊试液并微热
B.氧化铁与浓硝酸反应
C.氢氧化铝与浓硝酸反应
D.碳与浓硝酸反应
【解析】选A。在浓硝酸中滴入石蕊试液,石蕊试液先变红,此时浓硝酸表现出酸性,后退色,浓硝酸又表现出强氧化性。
3.为除去镀在铝表面的铜镀层,可选用的试剂是
( )
A.稀硝酸 B.浓硝酸
C.浓硫酸 D.浓盐酸
【解析】选B。除去铝表面的铜镀层,所选用的试剂应只跟铜反应而不跟铝反应或能使铝钝化。稀硝酸既能溶解铜又能溶解铝;常温下浓硫酸跟铜不反应,加热时浓硫酸与铜、铝均能反应(此时钝化膜被破坏);浓盐酸不与铜反应;常温下,浓硝酸与铜反应而使铜镀层溶解,铝则因为钝化而被保护。
知识点二:人类活动对氮循环和环境的影响
4.下列与氮循环无关的生态环境问题是( )
A.温室效应 B.白色污染
C.水体富营养化 D.酸雨
【解析】选B。与氮循环有关的环境问题主要有温室效应、水体污染及酸雨,其污染物分别为N2O、硝酸盐和铵盐等氮肥、硝酸。
5.可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策。汽车尾气(含有烃类、CO、SO2和NO等物质)是城市空气的污染源,治理方法之一是在汽车排气管上装一个“催化转化器”(用铂?钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的催化氧化。
(1)写出CO与NO在催化剂作用下的化学反应方程式
______。
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______。
(3)控制城市空气污染源方法可行的有__。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
【解析】汽车尾气是大气污染的一个主要来源,设法减少汽车尾气中有害气体的含量是控制污染的源头,污染一旦形成,设法降低其危害属于治理,消除污染必须标本兼治。
答案:(1)2CO+2NO 催化剂 2CO2+N2
(2)SO2转化为SO3,产生硫酸酸雾
(3)A、B
=====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列气体能造成空气中光化学污染的是( )
A.CO2 B.Cl2
C.SO2 D.NO和NO2
【解析】选D。CO2造成温室效应,SO2形成酸雨,NO和NO2等氮氧化物形成光化学烟雾和酸雨。
2.常温下不能溶于浓硝酸的金属是( )
A.Cu B.Na
C.Al D.Mg
【解析】选C。常温下,铁、铝在浓硝酸中会钝化,但在加热的条件下会反应生成NO2。
3.将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
【解析】选B。浓度越大,反应越快,浓HNO3反应快,
产生气泡快,A错。相同的铜,消耗硝酸的量分别为
Cu~ HNO3(稀),Cu~4HNO3(浓),B对。浓硝酸
反应时生成红棕色的NO2,稀硝酸反应生成无色的NO,
C错。相同的Cu全部反应,转移电子数相同,D错。
4.将铜粉放入稀H2SO4中,加热后无明显现象,但当加入某物质后,铜粉质量减少,溶液呈蓝色且有气体逸出,此物质是( )
A.Na2CO3 B.KNO3
C.NaOH D.HCl
【解析】选B。因铜的活动性比氢弱而铜与稀硫酸不能发生反应,但在加入硝酸盐后因引入NO3-,使得发生下列反应:3Cu+2NO3-+8H+ ==== 3Cu2++2NO↑+4H2O,使溶液呈蓝色且有气体逸出。故正确答案为B。
5.将6.4 g铜与400 mL 5 mol·L-1的足量HNO3溶液充分反应,还原产物为NO2和NO。如果反应结束后的溶液中含有H+ a mol,则此时溶液中NO3-的物质的量为
( )
A.0.5a mol B.(a+0.2)mol
C.2a mol D.(0.2-a)mol
【解析】选B。反应后溶液为HNO3和Cu(NO3)2的混合溶液,所以n(NO3-)=n(H+)+2n(Cu2+)=(a+0.1×2)mol=(a+0.2)mol
二、非选择题(本题包括1小题,共10分)
6.在下列反应或处理方式中,分别体现或利用了硝酸的什么性质,请把有关的字母填在题后的空白处:
A.酸性 B.氧化性
C.挥发性 D.不稳定性
①石蕊试液滴入浓硝酸中显红色,放置后又变无色
________。
②碳酸钙放入硝酸中,可以溶解并放出气体__。
③用铝槽车运输浓硝酸__。
④用黑纸包裹盛有浓硝酸的试剂瓶__ 。
【解析】①酸性使石蕊变红,氧化性使石蕊被氧化而变无色。
②硝酸酸性强于碳酸,是强酸制备弱酸。
③常温下,铝在浓硝酸中钝化。
④浓硝酸不稳定,受热或见光易分解。
答案:①A、B ②A ③B ④D
(20分)在100 mL某混合酸中,HNO3的物质的量浓度为0.4 mol·L-1,H2SO4的物质的量浓度为
0.1 mol·L-1,向其中加入1.92 g铜粉,微热,待充分反应后,求溶液中Cu2+的物质的量浓度为多少?
【解析】在100 mL溶液中,HNO3和H2SO4共电离出
0.06 mol H+、0.04 mol NO3-和0.01 mol SO42-。Cu和 0.04 mol HNO3完全反应后还有剩余,此时溶液中仍有0.03 mol NO3-和0.02 mol H+。 0.015 mol Cu2+、
0.01 mol SO42-,由此可见,溶液中还有相当于
0.02 mol HNO3存在仍可和Cu反应。
可根据铜和稀硝酸反应的离子方程式计算:
3Cu+2NO3-+8H+ ==== 3Cu2++2NO↑+4H2O
1.92 g Cu即0.03 mol Cu完全溶解,需n(H+)=
0.08 mol,n(NO3-)=0.02 mol,而此时溶液中有
0.06 mol的H+(不足量)、0.04 mol NO3-(足量),因此按H+的物质的量进行计算
8H+ ~ 3Cu2+
8 3
0.06 mol n(Cu2+)
所以Cu2+的物质的量为n(Cu2+)= =
0.022 5 mol,则Cu2+的物质的量浓度为c(Cu2+)=
=0.225 mol·L-1。
答案:Cu2+的物质的量浓度为0.225 mol·L-1。
