10-11高中化学课时讲练通课件:3.3.1 硫的转化(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.3.1 硫的转化(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共49张PPT)
【典例】(双选)下列说法正确的是
A.1 mol Fe分别与足量的Cl2、S反应消耗a mol Cl2,
b mol S,且a=b。
B.分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、
水以及过滤操作
C.硫与金属或非金属反应均做氧化剂
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化物
【思路点拨】解答本题应注意以下两点:
1.从Cu与S、Fe与S、Fe与Cl2反应的化学方程式入手,找到反应的比例关系。
2.从硫的溶解性考虑。
【自主解答】选B、D。Fe与Cl2、S反应的化学方程式
为:2Fe+3Cl2 2FeCl3,Fe+S FeS,故1 mol Fe
分别与足量的Cl2、S反应消耗1.5 mol Cl2,1 mol S,
故a>b,A选项不正确。分离黑火药中的三组分可利用
它们溶解性的差异。先用CS2处理,使硫溶解。滤渣再
用水处理,溶解硝酸钾,过滤,滤渣为炭粉。滤液蒸
发、浓缩、结晶,得到硝酸钾,B选项正确。当硫单质
点燃
====
△
====
与金属反应时,硫作氧化剂;与非金属反应时应具体分
析硫的价态变化,如在S+O2 SO2中S作还原剂,在
S+H2 H2S中S作氧化剂,C选项不正确。
Cu与S反应时
2Cu + S Cu2S
2×64 32 160
6.4 g 1.6 g 8.0 g
即6.4 g Cu和1.6 g S恰好反应生成8.0 g Cu2S,D选项
正确。
点燃
====
△
====
△
====
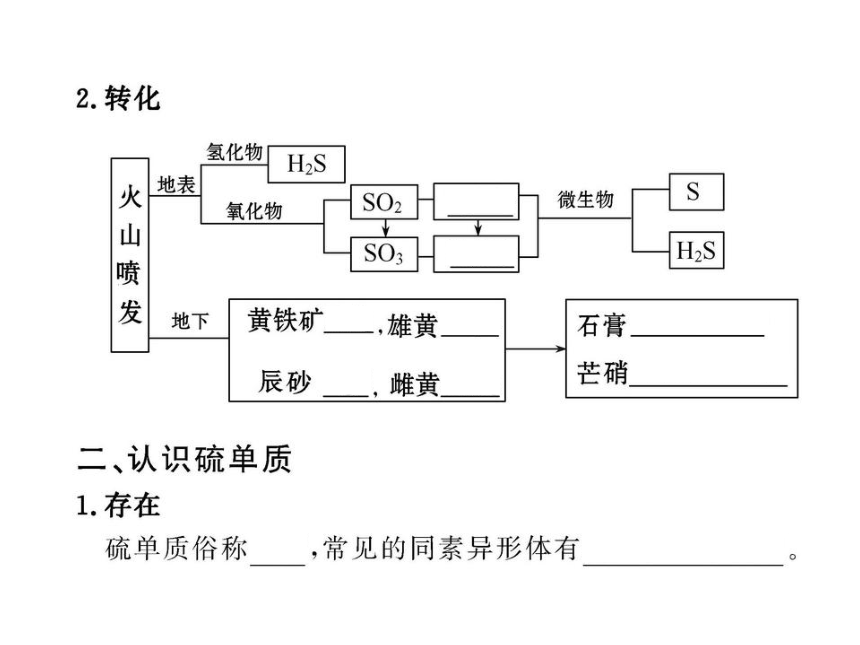
知识点一:硫在自然界中的存在
1.(双选)在自然界中既能以游离态形式存在又能以化合态形式存在的元素是( )
A.氯 B.钠 C.氧 D.硫
【解析】选C、D。元素在自然界中的存在形态与元素活泼性有关,但活泼性强的元素在自然界中也有游离态(如O2)。
2.下列说法中,不正确的是( )
A.硫是一种淡黄色不溶于水的晶体,微溶于酒精,易
溶于CS2它有多种同素异形体,斜方硫和单斜硫是常
见的两种
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.雄黄、雌黄和辰砂都是含硫的矿物
D.硫在空气中燃烧产物是SO2,在纯氧中燃烧产物是
SO3
【解析】选D。硫在空气中和在纯氧中燃烧产物都是SO2。
知识点二:硫的性质
3.实验室常用热的NaOH溶液洗去试管上沾有的硫,其
反应如下:6NaOH+3S 2Na2S+Na2SO3+3H2O,在此反
应中,氧化剂与还原剂的质量比是( )
A.2∶1 B.1∶2 C.5∶6 D.6∶5
【解析】选A。氧化剂是指反应中化合价降低的物质,还原剂是指反应中化合价升高的物质。从化学方程式看,反应中只有硫元素的化合价发生变化,且3个S中
有2个化合价降低,一个化合价升高。
△
====
4.0.1 mol某单质跟足量的硫充分反应后,质量增加1.6 g,则组成这种单质的元素是( )
A.铁 B.铜 C.铝 D.锌
解题提示:Fe+S FeS 2Cu+S Cu2S
2Al+3S Al2S3 Zn+S ZnS
由质量的改变量找到参加反应的硫的质量,继而根据
金属单质和参加反应的硫的物质的量之比推断出该金
属单质。
△
====
△
====
△
====
△
====
【解析】选B。单质与硫充分反应后,质量增加的
1.6 g,必为参加反应的硫的质量,即参加反应的硫的
物质的量为 。0.1 mol某单质跟
0.05 mol S反应,金属显+1价。
5.汞蒸气有毒,人在汞蒸气浓度为10-5kg/m3的空气中停留1~2天就会出现汞中毒症状。某同学不慎将温度计打碎了,散落了好多汞珠,他首先将大个的汞珠收集起来,然后在碎汞上面撒了一层硫粉。请问:
(1)该同学应用了硫单质的什么性质?
(从氧化还原反应的角度回答)
(2)写出所发生反应的化学方程式。
(3)写出两种除汞以外的金属单质与硫反应的化学方程式。
【解析】当向碎汞上撒上一层硫粉时,发生反应Hg+S ==== HgS,则从氧化还原反应的角度考虑,此方法应用了硫单质的氧化性。除汞与S反应外,其他金属单质如Fe、Cu、Al、Zn等都可与S发生反应。
答案:(1)氧化性 (2)Hg+S ==== HgS
(3)Fe+S FeS
2Cu+S Cu2S(答案合理即可)
△
====
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.(双选)常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8互称同素异形体
D.把硫单质在空气中加热到750 ℃即得S2
【解析】选B、C。硫单质之间的转化为化学变化,相互间称为同素异形体,燃烧的产物为SO2,硫单质在空气中加热会燃烧,不可能相互转化。
2.能从下列各组混合物中把硫粉分离出来的共同方法是( )
①砂粒和硫粉 ②铁粉和硫粉 ③木炭和硫粉
A.用水溶解 B.用酒精溶解
C.加热使硫升华 D.用二硫化碳溶解
【解析】选D。①②③均可用加入CS2溶解硫再过滤的方法进行分离。硫不溶于水,微溶于酒精,易溶于CS2,所以A、B均错。加热时硫易燃烧且能与Fe反应,故C错。
3.下列叙述中错误的是( )
A.消除散落在地面上的汞珠的方法是撒上硫粉
B.铜丝擦亮后伸入硫蒸气中产物是Cu2S
C.硫与金属或非金属反应均作氧化剂
D.可以用热浓NaOH溶液除去附在试管内壁上的硫
【解析】选C。汞与硫粉反应能直接生成HgS,A对。
2Cu+S Cu2S,B对。硫与金属反应做氧化剂,与非
金属H2反应时做氧化剂,与非金属O2反应时做还原
剂,C错。硫能与热的NaOH溶液反应生成可溶性盐,D
对。
△
====
4.下列物质可以由对应的单质直接化合生成的是
( )
A.SO3 B.FeS C.CuS D.FeCl2
【解析】选B。S与O2、Cu分别生成SO2和Cu2S,Fe与Cl2生成FeCl3,S与Fe生成FeS。
5.能够说明硫的氧化性比氯弱的事实有( )
①通常状况下硫为固体,氯气为气体
②与金属单质反应,硫被还原为-2价,氯被还原为-1
价
③Cl2与铁反应生成FeCl3,S与铁反应生成FeS
④将Cl2通入氢硫酸(H2S)中可置换出硫
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理物质,故错。氧化性强弱是指得电子能力强弱,氧化性强弱与得电子多少无直接关系,②错。③④均能说明Cl2得电子能力比S强,③④对。
二、非选择题(本题包括1小题,共10分)
6.硫通常是一种淡黄色的晶体,有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对三种蒸气的测定结果是:
(1)橙色的蒸气密度折算到标准状况下是11.42 g/L,则它的化学式___。
(2)红棕色蒸气的质量是同体积空气质量的6.62倍,则它的化学式是___。
(3)无色蒸气对氢气的相对密度是64,则它的化学式是___。
此事实说明,硫有_________。
【解析】(1)M=ρVm=11.42 g/L×22.4 L/mol=
256 g/mol
则根据硫蒸气的化学式为Sx,可得
32x=256 x=8
所以它的化学式为S8。
(2)同温同压同体积时,气体质量比等于气体相对分子质量比。红棕色蒸气的相对分子质量为29×6.62
=192,则32x=192 x=6 所以它的化学式为S6。
(3)同温同压下,气体密度比等于相对分子质量之比,所以无色蒸气相对分子质量为2×64=128,则
32x=128 x=4 所以它的化学式为S4。
以上事实说明硫有多种同素异形体。
答案:(1)S8 (2)S6 (3)S4 多种同素异形体
1.(5分)下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S ⑧FeCl3
A.②③⑤⑦⑧ B.①④⑥⑦
C.②③⑤⑥⑦ D.④⑥⑦⑧
【解析】选A。硫与具有可变化合价的金属反应时,只
能将其氧化至较低价态,所以金属Fe和Cu在加热条件
下与硫单质反应时,只能生成FeS和Cu2S,而不是
Fe2S3和CuS。而氯气的氧化性很强,在与Fe反应时可
将其氧化为高价态,故反应产物为FeCl3,而不是FeCl2。
硫在与其他非金属反应时,若该元素的非金属性弱于
硫,则硫表现出氧化性,在生成物中硫为-2价,如
H2+S H2S;若该元素的非金属性强于硫,则硫将
被氧化,表现出还原性,在生成物中硫将显正价,如S
与氧气点燃时生成二氧化硫。
高温
====
2.(15分)为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)为什么反应在“惰性气体环境”中进行___。
(2)操作②的作用是___,还可以改用___。操作③的化学方程式是_________。
(3)混合粉末A中需硫粉过量,原因是如果铁过量_____
_________。
(4)如何说明溶液D中含有Fe2+而不含有Fe3+?______
_________。
【解析】首先要搞清实验的设计目的和原理,结合Fe与S的反应特点,要防止空气中O2的氧化等问题即可解决。加入过量硫是为了保证Fe完全反应,防止过量的Fe与H2SO4反应生成Fe2+干扰实验。在惰性气体环境中反应是防止空气中O2参与反应。Fe2+检验要避免被氧化成Fe3+,用SCN-检验和区别Fe2+和Fe3+。
答案:(1)防止空气中的O2参与反应
(2)除去混合物中的硫粉 CS2
FeS+H2SO4 ==== FeSO4+H2S↑
(3)铁粉与H2SO4反应产生的Fe2+干扰实验结果
(4)加入KSCN溶液,如果溶液变红则含Fe3+,不变红则含Fe2+
【典例】(双选)下列说法正确的是
A.1 mol Fe分别与足量的Cl2、S反应消耗a mol Cl2,
b mol S,且a=b。
B.分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、
水以及过滤操作
C.硫与金属或非金属反应均做氧化剂
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化物
【思路点拨】解答本题应注意以下两点:
1.从Cu与S、Fe与S、Fe与Cl2反应的化学方程式入手,找到反应的比例关系。
2.从硫的溶解性考虑。
【自主解答】选B、D。Fe与Cl2、S反应的化学方程式
为:2Fe+3Cl2 2FeCl3,Fe+S FeS,故1 mol Fe
分别与足量的Cl2、S反应消耗1.5 mol Cl2,1 mol S,
故a>b,A选项不正确。分离黑火药中的三组分可利用
它们溶解性的差异。先用CS2处理,使硫溶解。滤渣再
用水处理,溶解硝酸钾,过滤,滤渣为炭粉。滤液蒸
发、浓缩、结晶,得到硝酸钾,B选项正确。当硫单质
点燃
====
△
====
与金属反应时,硫作氧化剂;与非金属反应时应具体分
析硫的价态变化,如在S+O2 SO2中S作还原剂,在
S+H2 H2S中S作氧化剂,C选项不正确。
Cu与S反应时
2Cu + S Cu2S
2×64 32 160
6.4 g 1.6 g 8.0 g
即6.4 g Cu和1.6 g S恰好反应生成8.0 g Cu2S,D选项
正确。
点燃
====
△
====
△
====
知识点一:硫在自然界中的存在
1.(双选)在自然界中既能以游离态形式存在又能以化合态形式存在的元素是( )
A.氯 B.钠 C.氧 D.硫
【解析】选C、D。元素在自然界中的存在形态与元素活泼性有关,但活泼性强的元素在自然界中也有游离态(如O2)。
2.下列说法中,不正确的是( )
A.硫是一种淡黄色不溶于水的晶体,微溶于酒精,易
溶于CS2它有多种同素异形体,斜方硫和单斜硫是常
见的两种
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.雄黄、雌黄和辰砂都是含硫的矿物
D.硫在空气中燃烧产物是SO2,在纯氧中燃烧产物是
SO3
【解析】选D。硫在空气中和在纯氧中燃烧产物都是SO2。
知识点二:硫的性质
3.实验室常用热的NaOH溶液洗去试管上沾有的硫,其
反应如下:6NaOH+3S 2Na2S+Na2SO3+3H2O,在此反
应中,氧化剂与还原剂的质量比是( )
A.2∶1 B.1∶2 C.5∶6 D.6∶5
【解析】选A。氧化剂是指反应中化合价降低的物质,还原剂是指反应中化合价升高的物质。从化学方程式看,反应中只有硫元素的化合价发生变化,且3个S中
有2个化合价降低,一个化合价升高。
△
====
4.0.1 mol某单质跟足量的硫充分反应后,质量增加1.6 g,则组成这种单质的元素是( )
A.铁 B.铜 C.铝 D.锌
解题提示:Fe+S FeS 2Cu+S Cu2S
2Al+3S Al2S3 Zn+S ZnS
由质量的改变量找到参加反应的硫的质量,继而根据
金属单质和参加反应的硫的物质的量之比推断出该金
属单质。
△
====
△
====
△
====
△
====
【解析】选B。单质与硫充分反应后,质量增加的
1.6 g,必为参加反应的硫的质量,即参加反应的硫的
物质的量为 。0.1 mol某单质跟
0.05 mol S反应,金属显+1价。
5.汞蒸气有毒,人在汞蒸气浓度为10-5kg/m3的空气中停留1~2天就会出现汞中毒症状。某同学不慎将温度计打碎了,散落了好多汞珠,他首先将大个的汞珠收集起来,然后在碎汞上面撒了一层硫粉。请问:
(1)该同学应用了硫单质的什么性质?
(从氧化还原反应的角度回答)
(2)写出所发生反应的化学方程式。
(3)写出两种除汞以外的金属单质与硫反应的化学方程式。
【解析】当向碎汞上撒上一层硫粉时,发生反应Hg+S ==== HgS,则从氧化还原反应的角度考虑,此方法应用了硫单质的氧化性。除汞与S反应外,其他金属单质如Fe、Cu、Al、Zn等都可与S发生反应。
答案:(1)氧化性 (2)Hg+S ==== HgS
(3)Fe+S FeS
2Cu+S Cu2S(答案合理即可)
△
====
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.(双选)常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8互称同素异形体
D.把硫单质在空气中加热到750 ℃即得S2
【解析】选B、C。硫单质之间的转化为化学变化,相互间称为同素异形体,燃烧的产物为SO2,硫单质在空气中加热会燃烧,不可能相互转化。
2.能从下列各组混合物中把硫粉分离出来的共同方法是( )
①砂粒和硫粉 ②铁粉和硫粉 ③木炭和硫粉
A.用水溶解 B.用酒精溶解
C.加热使硫升华 D.用二硫化碳溶解
【解析】选D。①②③均可用加入CS2溶解硫再过滤的方法进行分离。硫不溶于水,微溶于酒精,易溶于CS2,所以A、B均错。加热时硫易燃烧且能与Fe反应,故C错。
3.下列叙述中错误的是( )
A.消除散落在地面上的汞珠的方法是撒上硫粉
B.铜丝擦亮后伸入硫蒸气中产物是Cu2S
C.硫与金属或非金属反应均作氧化剂
D.可以用热浓NaOH溶液除去附在试管内壁上的硫
【解析】选C。汞与硫粉反应能直接生成HgS,A对。
2Cu+S Cu2S,B对。硫与金属反应做氧化剂,与非
金属H2反应时做氧化剂,与非金属O2反应时做还原
剂,C错。硫能与热的NaOH溶液反应生成可溶性盐,D
对。
△
====
4.下列物质可以由对应的单质直接化合生成的是
( )
A.SO3 B.FeS C.CuS D.FeCl2
【解析】选B。S与O2、Cu分别生成SO2和Cu2S,Fe与Cl2生成FeCl3,S与Fe生成FeS。
5.能够说明硫的氧化性比氯弱的事实有( )
①通常状况下硫为固体,氯气为气体
②与金属单质反应,硫被还原为-2价,氯被还原为-1
价
③Cl2与铁反应生成FeCl3,S与铁反应生成FeS
④将Cl2通入氢硫酸(H2S)中可置换出硫
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理物质,故错。氧化性强弱是指得电子能力强弱,氧化性强弱与得电子多少无直接关系,②错。③④均能说明Cl2得电子能力比S强,③④对。
二、非选择题(本题包括1小题,共10分)
6.硫通常是一种淡黄色的晶体,有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对三种蒸气的测定结果是:
(1)橙色的蒸气密度折算到标准状况下是11.42 g/L,则它的化学式___。
(2)红棕色蒸气的质量是同体积空气质量的6.62倍,则它的化学式是___。
(3)无色蒸气对氢气的相对密度是64,则它的化学式是___。
此事实说明,硫有_________。
【解析】(1)M=ρVm=11.42 g/L×22.4 L/mol=
256 g/mol
则根据硫蒸气的化学式为Sx,可得
32x=256 x=8
所以它的化学式为S8。
(2)同温同压同体积时,气体质量比等于气体相对分子质量比。红棕色蒸气的相对分子质量为29×6.62
=192,则32x=192 x=6 所以它的化学式为S6。
(3)同温同压下,气体密度比等于相对分子质量之比,所以无色蒸气相对分子质量为2×64=128,则
32x=128 x=4 所以它的化学式为S4。
以上事实说明硫有多种同素异形体。
答案:(1)S8 (2)S6 (3)S4 多种同素异形体
1.(5分)下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S ⑧FeCl3
A.②③⑤⑦⑧ B.①④⑥⑦
C.②③⑤⑥⑦ D.④⑥⑦⑧
【解析】选A。硫与具有可变化合价的金属反应时,只
能将其氧化至较低价态,所以金属Fe和Cu在加热条件
下与硫单质反应时,只能生成FeS和Cu2S,而不是
Fe2S3和CuS。而氯气的氧化性很强,在与Fe反应时可
将其氧化为高价态,故反应产物为FeCl3,而不是FeCl2。
硫在与其他非金属反应时,若该元素的非金属性弱于
硫,则硫表现出氧化性,在生成物中硫为-2价,如
H2+S H2S;若该元素的非金属性强于硫,则硫将
被氧化,表现出还原性,在生成物中硫将显正价,如S
与氧气点燃时生成二氧化硫。
高温
====
2.(15分)为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)为什么反应在“惰性气体环境”中进行___。
(2)操作②的作用是___,还可以改用___。操作③的化学方程式是_________。
(3)混合粉末A中需硫粉过量,原因是如果铁过量_____
_________。
(4)如何说明溶液D中含有Fe2+而不含有Fe3+?______
_________。
【解析】首先要搞清实验的设计目的和原理,结合Fe与S的反应特点,要防止空气中O2的氧化等问题即可解决。加入过量硫是为了保证Fe完全反应,防止过量的Fe与H2SO4反应生成Fe2+干扰实验。在惰性气体环境中反应是防止空气中O2参与反应。Fe2+检验要避免被氧化成Fe3+,用SCN-检验和区别Fe2+和Fe3+。
答案:(1)防止空气中的O2参与反应
(2)除去混合物中的硫粉 CS2
FeS+H2SO4 ==== FeSO4+H2S↑
(3)铁粉与H2SO4反应产生的Fe2+干扰实验结果
(4)加入KSCN溶液,如果溶液变红则含Fe3+,不变红则含Fe2+
