10-11高中化学课时讲练通课件:3.4.1 海水中的元素(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.4.1 海水中的元素(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览







文档简介
(共53张PPT)
【典例】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是_____(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:A.盐酸、B.Na2CO3溶液、C.NaOH溶液。请你正确排列加入的顺序:__、__、__(填编号);
(3)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为__(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
【思路点拨】解答本题要注意以下两点:
1.根据流程图,逐步分析各步反应。
2.除杂时要遵循除杂不引杂的原则,如引入新的杂质,则必须在后边反应除去。
【自主解答】(1)逐步分析各步骤的变化,判断答案:
①蒸发、结晶、过滤属于物理变化。
②粗盐精制是用Na2CO3和NaOH除去粗盐中的Ca2+、Mg2+,不发生氧化还原反应。
③电解食盐水是氧化还原反应。
④、⑤、⑥、⑦、⑧五个步骤是生产生石灰,熟石灰,沉淀Mg2+,制取MgCl2,均不是氧化还原反应。
⑨电解MgCl2制金属Mg是氧化还原反应。
(2)除去Ca2+、Mg2+时,要最后加入盐酸,以除去过量的OH-和CO32-。
(3)因为MgCl2的溶解度随温度的升高而增大,所以从MgCl2溶液中获取MgCl2·6H2O晶体,可以先将溶液加热浓缩,制成热的MgCl2饱和溶液,然后冷却结晶,过滤即得MgCl2·6H2O晶体。
答案:(1)③⑨
(2)B C A(或C B A) (3)B、C
知识点一:海水中的元素
1.海水中元素含量的差异是很大的,下列元素中不是海水中的常量元素的是( )
A.氯 B.氟 C.溴 D.锂
【解析】选D。氯、氟、溴为常量元素,锂为微量元素,故选D。
知识点二:镁的性质
2.下列关于海水中的元素,对其用途的说法中不正确的是( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.食盐中加碘加的是碘单质
D.镁用于制造飞机、汽车
【解析】选C。食盐加碘加的是碘酸钾(KIO3)。
3.镁粉是做焰火、闪光粉、鞭炮的不可缺少的原料,工业制造镁蒸气要在某气体中冷却。下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①和② B.②和③
C.③和④ D.④和⑤
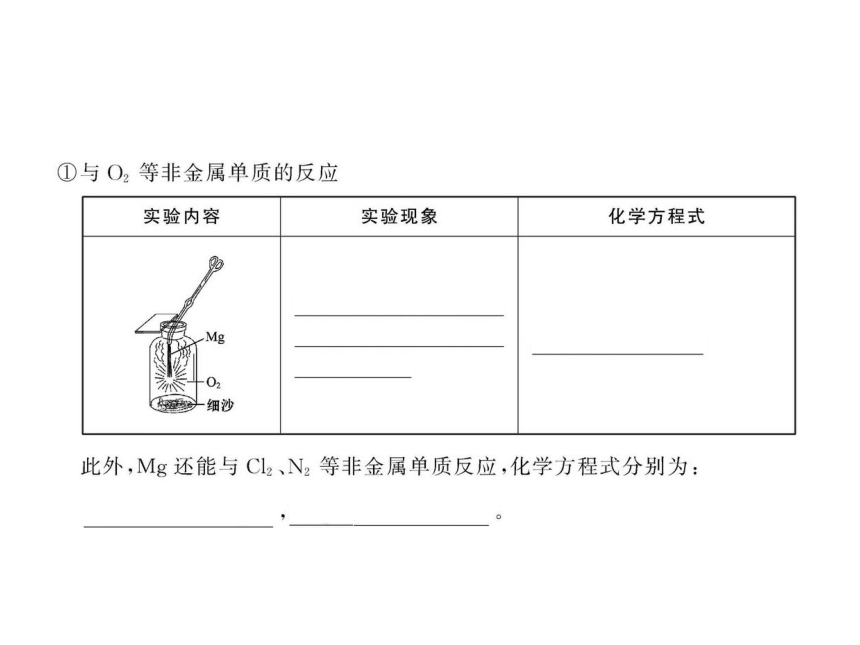
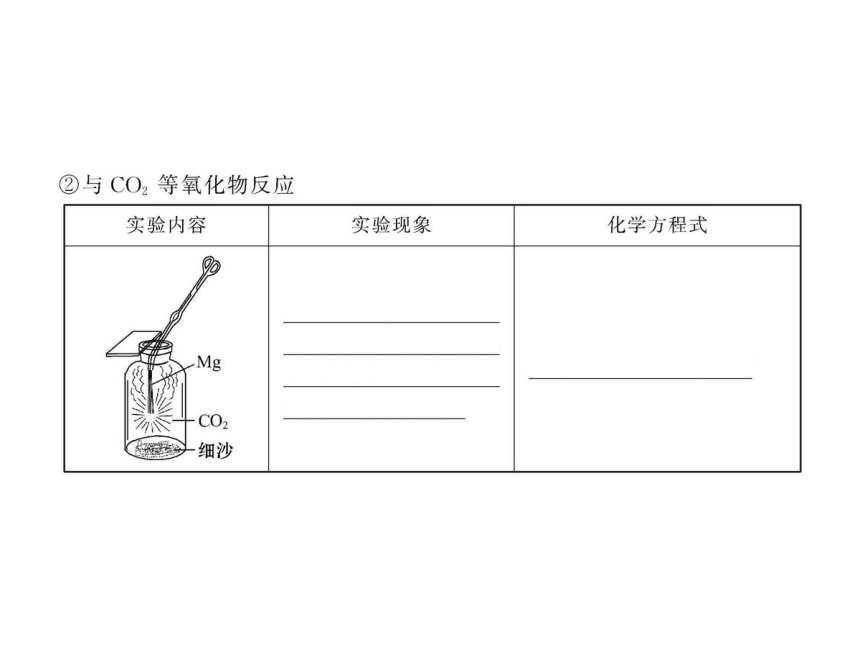
【解析】选C。镁蒸气在某气体中冷却,则该气体必须在高温下不与镁反应。而高温下O2、N2、CO2都能与镁发生反应。
4.下列有关镁的叙述正确的是( )
A.镁条燃烧引起的火灾可用CO2进行扑灭
B.单质镁因坚硬、轻巧、易于加工,可用来作窗框等
C.镁制容器可用来装浓硝酸
D.镁在空气中燃烧产物并不全是MgO
【解析】选D。镁是很活泼的金属,具有强还原性,燃
着的镁能够夺取二氧化碳中的氧而继续燃烧。单质镁
柔软,镁铝合金坚硬、轻巧。镁在空气中燃烧时不仅
跟氧气化合生成氧化镁,还有少量与氮气化合:
3Mg+N2 Mg3N2。常温下铝遇浓硝酸表面钝化,镁无
钝化现象,因此镁制容器不能用以装浓硝酸。故选D项。
点燃
====
5.镁可以在O2,N2,CO2中燃烧生成相应的化合物。
(1)镁在空气中燃烧,除发生反应N2+3Mg Mg3N2
外,还能发生其他反应,写出反应的化学方程式
_________。
(2)镁条在氧气中燃烧时看到的现象是_____。
(3)有同学认为空气中氮气含量最大,所以产物中氮化镁含量最大。事实上是这样吗?为什么?
(4)通过镁在空气中燃烧这一事实,你对燃烧这一概念,有何新的认识?
点燃
====
【解析】镁是较活泼金属,镁在空气中燃烧,产物较复杂。但产物中MgO最多,这是由于氧气较活泼所致。燃烧是剧烈的发热发光的氧化还原反应,不一定有氧气参加。
答案:(1)2Mg+O2 2MgO,2Mg+CO2 2MgO+C
(2)剧烈燃烧,发出耀眼的白光,生成大量白色粉末
(3)不是,因为氮气比氧气稳定。
(4)燃烧不一定有氧气参加。
点燃
====
点燃
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
【解析】选D。氯、溴、碘、钠、镁、铝、氢各元素在海水中均以化合态存在,要获得各元素的单质,必发生化学变化,食盐可通过海水的浓缩、蒸发、结晶等物理过程获得,淡水可通过海水的蒸馏获得,故选D。
2.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到
钾单质
D.利用潮汐发电是将化学能转化为电能
【解析】选A。B项,蒸发过程为物理变化;C项,海水中的钾元素为化合态,得到单质钾的过程为化学变化;D项,潮汐是涨潮、落潮的过程,潮汐发电过程中无化学变化。
3.一定量的Mg和MgO的混合物投入100 mL 2 mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4 mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小的是( )
A.100 mL
B.50 mL
C.25 mL
D.由于Mg、MgO的质量未知无法判断
【解析】选B。Mg元素全部沉淀后,溶液中只有NaCl,
其中Na+全部来自于NaOH溶液,Cl-全部来自于稀HCl,
且有n(NaOH)=n(HCl)=0.100 L×2 mol/L=0.2 mol
=c(NaOH)·V(NaOH),所以V(NaOH)= =0.05 L
=50 mL。
4.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物的叙述中不正确的是( )
A.Li2SO4易溶于水
B.Li与N2反应产物是Li3N
C.LiOH难溶于水
D.LiOH与Li2CO3受热都很难分解
【解析】选D。类比镁及其化合物的性质:MgSO4易溶于水,所以 Li2SO4也易溶于水,A选项正确;Mg与N2反应生成Mg3N2,所以Li与N2反应可以生成Li3N,B选项正确;Mg(OH)2难溶于水,所以LiOH也难溶于水,C选项正确;Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,D选项错误。
5.将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
【解析】选C。镁、铝各0.3 mol分别与100 mL
1 mol/L的盐酸反应时,盐酸不足,则产生H2都是
0.05 mol。钠与盐酸反应时,盐酸也不足,但是剩余的钠还可以与水继续反应生成H2,即剩余的0.2 mol Na与H2O反应又产生0.1 mol H2,所以共产生H2
0.15 mol。
二、非选择题(本题包括1小题,共10分)
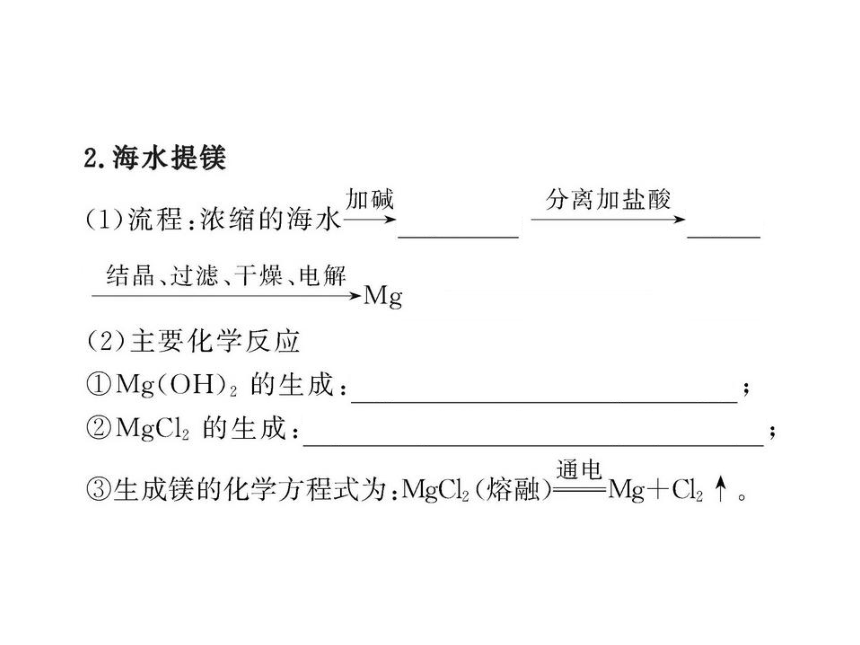
6.由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥 ②加熟石灰 ③加盐酸④过滤 ⑤浓缩、结晶
(1)其先后顺序正确的是___。
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
(2)写出步骤③中发生反应的离子方程式_____。
(3)过滤操作要用到的玻璃仪器有_____。
【解析】(1)由海水制备无水氯化镁的步骤应为:
故其正确顺序应为②④③⑤①,答案应选D。
(2)步骤③中加盐酸后,Mg(OH)2与盐酸发生反应,离子方程式为Mg(OH)2+2H+ ==== Mg2++2H2O
(3)在过滤操作中要用到的玻璃仪器为漏斗、玻璃棒、烧杯。
答案:(1)D (2)Mg(OH)2+2H+ ==== Mg2++2H2O
(3)漏斗、玻璃棒、烧杯
1.(5分)某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐退去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。
则下列关于镁与溴水的反应机理的论述中正确的是
( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
【解析】选D。由①③可知Mg与液溴和水均不反应。由②知镁与溴在水存在下反应。由④知水为催化剂。
2.(15分)镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色的石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A___、C ___、D ___。
(2)写出下列变化的化学方程式:
① _________,
② _________。
【解析】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色的石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即它为MgCl2和NH4Cl的混合物。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl ==== 3MgCl2+2NH4Cl
②MgCl2+2NaOH ==== Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
【典例】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是_____(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:A.盐酸、B.Na2CO3溶液、C.NaOH溶液。请你正确排列加入的顺序:__、__、__(填编号);
(3)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为__(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
【思路点拨】解答本题要注意以下两点:
1.根据流程图,逐步分析各步反应。
2.除杂时要遵循除杂不引杂的原则,如引入新的杂质,则必须在后边反应除去。
【自主解答】(1)逐步分析各步骤的变化,判断答案:
①蒸发、结晶、过滤属于物理变化。
②粗盐精制是用Na2CO3和NaOH除去粗盐中的Ca2+、Mg2+,不发生氧化还原反应。
③电解食盐水是氧化还原反应。
④、⑤、⑥、⑦、⑧五个步骤是生产生石灰,熟石灰,沉淀Mg2+,制取MgCl2,均不是氧化还原反应。
⑨电解MgCl2制金属Mg是氧化还原反应。
(2)除去Ca2+、Mg2+时,要最后加入盐酸,以除去过量的OH-和CO32-。
(3)因为MgCl2的溶解度随温度的升高而增大,所以从MgCl2溶液中获取MgCl2·6H2O晶体,可以先将溶液加热浓缩,制成热的MgCl2饱和溶液,然后冷却结晶,过滤即得MgCl2·6H2O晶体。
答案:(1)③⑨
(2)B C A(或C B A) (3)B、C
知识点一:海水中的元素
1.海水中元素含量的差异是很大的,下列元素中不是海水中的常量元素的是( )
A.氯 B.氟 C.溴 D.锂
【解析】选D。氯、氟、溴为常量元素,锂为微量元素,故选D。
知识点二:镁的性质
2.下列关于海水中的元素,对其用途的说法中不正确的是( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.食盐中加碘加的是碘单质
D.镁用于制造飞机、汽车
【解析】选C。食盐加碘加的是碘酸钾(KIO3)。
3.镁粉是做焰火、闪光粉、鞭炮的不可缺少的原料,工业制造镁蒸气要在某气体中冷却。下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①和② B.②和③
C.③和④ D.④和⑤
【解析】选C。镁蒸气在某气体中冷却,则该气体必须在高温下不与镁反应。而高温下O2、N2、CO2都能与镁发生反应。
4.下列有关镁的叙述正确的是( )
A.镁条燃烧引起的火灾可用CO2进行扑灭
B.单质镁因坚硬、轻巧、易于加工,可用来作窗框等
C.镁制容器可用来装浓硝酸
D.镁在空气中燃烧产物并不全是MgO
【解析】选D。镁是很活泼的金属,具有强还原性,燃
着的镁能够夺取二氧化碳中的氧而继续燃烧。单质镁
柔软,镁铝合金坚硬、轻巧。镁在空气中燃烧时不仅
跟氧气化合生成氧化镁,还有少量与氮气化合:
3Mg+N2 Mg3N2。常温下铝遇浓硝酸表面钝化,镁无
钝化现象,因此镁制容器不能用以装浓硝酸。故选D项。
点燃
====
5.镁可以在O2,N2,CO2中燃烧生成相应的化合物。
(1)镁在空气中燃烧,除发生反应N2+3Mg Mg3N2
外,还能发生其他反应,写出反应的化学方程式
_________。
(2)镁条在氧气中燃烧时看到的现象是_____。
(3)有同学认为空气中氮气含量最大,所以产物中氮化镁含量最大。事实上是这样吗?为什么?
(4)通过镁在空气中燃烧这一事实,你对燃烧这一概念,有何新的认识?
点燃
====
【解析】镁是较活泼金属,镁在空气中燃烧,产物较复杂。但产物中MgO最多,这是由于氧气较活泼所致。燃烧是剧烈的发热发光的氧化还原反应,不一定有氧气参加。
答案:(1)2Mg+O2 2MgO,2Mg+CO2 2MgO+C
(2)剧烈燃烧,发出耀眼的白光,生成大量白色粉末
(3)不是,因为氮气比氧气稳定。
(4)燃烧不一定有氧气参加。
点燃
====
点燃
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
【解析】选D。氯、溴、碘、钠、镁、铝、氢各元素在海水中均以化合态存在,要获得各元素的单质,必发生化学变化,食盐可通过海水的浓缩、蒸发、结晶等物理过程获得,淡水可通过海水的蒸馏获得,故选D。
2.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到
钾单质
D.利用潮汐发电是将化学能转化为电能
【解析】选A。B项,蒸发过程为物理变化;C项,海水中的钾元素为化合态,得到单质钾的过程为化学变化;D项,潮汐是涨潮、落潮的过程,潮汐发电过程中无化学变化。
3.一定量的Mg和MgO的混合物投入100 mL 2 mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4 mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小的是( )
A.100 mL
B.50 mL
C.25 mL
D.由于Mg、MgO的质量未知无法判断
【解析】选B。Mg元素全部沉淀后,溶液中只有NaCl,
其中Na+全部来自于NaOH溶液,Cl-全部来自于稀HCl,
且有n(NaOH)=n(HCl)=0.100 L×2 mol/L=0.2 mol
=c(NaOH)·V(NaOH),所以V(NaOH)= =0.05 L
=50 mL。
4.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物的叙述中不正确的是( )
A.Li2SO4易溶于水
B.Li与N2反应产物是Li3N
C.LiOH难溶于水
D.LiOH与Li2CO3受热都很难分解
【解析】选D。类比镁及其化合物的性质:MgSO4易溶于水,所以 Li2SO4也易溶于水,A选项正确;Mg与N2反应生成Mg3N2,所以Li与N2反应可以生成Li3N,B选项正确;Mg(OH)2难溶于水,所以LiOH也难溶于水,C选项正确;Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,D选项错误。
5.将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
【解析】选C。镁、铝各0.3 mol分别与100 mL
1 mol/L的盐酸反应时,盐酸不足,则产生H2都是
0.05 mol。钠与盐酸反应时,盐酸也不足,但是剩余的钠还可以与水继续反应生成H2,即剩余的0.2 mol Na与H2O反应又产生0.1 mol H2,所以共产生H2
0.15 mol。
二、非选择题(本题包括1小题,共10分)
6.由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥 ②加熟石灰 ③加盐酸④过滤 ⑤浓缩、结晶
(1)其先后顺序正确的是___。
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
(2)写出步骤③中发生反应的离子方程式_____。
(3)过滤操作要用到的玻璃仪器有_____。
【解析】(1)由海水制备无水氯化镁的步骤应为:
故其正确顺序应为②④③⑤①,答案应选D。
(2)步骤③中加盐酸后,Mg(OH)2与盐酸发生反应,离子方程式为Mg(OH)2+2H+ ==== Mg2++2H2O
(3)在过滤操作中要用到的玻璃仪器为漏斗、玻璃棒、烧杯。
答案:(1)D (2)Mg(OH)2+2H+ ==== Mg2++2H2O
(3)漏斗、玻璃棒、烧杯
1.(5分)某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐退去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。
则下列关于镁与溴水的反应机理的论述中正确的是
( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
【解析】选D。由①③可知Mg与液溴和水均不反应。由②知镁与溴在水存在下反应。由④知水为催化剂。
2.(15分)镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色的石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A___、C ___、D ___。
(2)写出下列变化的化学方程式:
① _________,
② _________。
【解析】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色的石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即它为MgCl2和NH4Cl的混合物。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl ==== 3MgCl2+2NH4Cl
②MgCl2+2NaOH ==== Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
