10-11高中化学课时讲练通课件:4.1.1 硅 无机非金属材料(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:4.1.1 硅 无机非金属材料(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共46张PPT)
【典例1】下列有关说法中正确的是
A.硅单质既不能与酸反应又不能与碱反应
B.硅在自然界中以化合态存在
C.硅是制造光导纤维的材料
D.硅元素在地壳中的含量居第一位
【思路点拨】牢记硅的基本性质及特性、用途。
【自主解答】选B。单质硅可以与氢氟酸和强碱溶液反应,所以A项错误;SiO2是制造光导纤维的材料;硅在地壳中的含量仅次于氧,位于第二位。
【典例2】对于碳和硅元素的说法,下列叙述中正确的是
A.SiO2和CO2均由分子直接组成
B.C、Si的最外层电子数都是4,次外层电子数都是8
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧
化钙反应
D.碳和硅元素的主要化合价是+4价和+2价
【思路点拨】结合C、Si的原子结构特点,CO2、SiO2的组成和结构分析各项。
【自主解答】选C。CO2由分子构成,SiO2由原子构成,所以A错。碳原子的次外层只有2个电子,B错。CO2、SiO2均能与CaO反应生成盐,C对。硅元素的主要化合价是+4价。
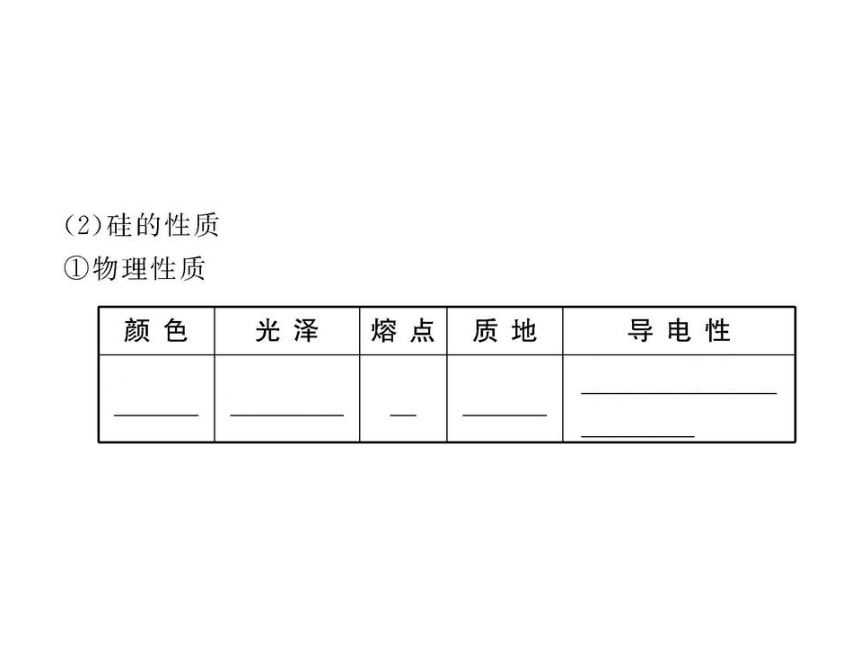
知识点一:半导体材料和单质硅
1.可以用做半导体材料的是( )
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
【解析】选C。常用的半导体材料为高纯硅。
2.下列关于硅及硅的化合物的叙述中不正确的是
( )
①硅的结构和金刚石相似,所以都具有熔点高、硬度大等特点
②硅是地壳中含量最多的非金属
③晶体硅是良好的半导体材料
④SiO2是制造光导纤维的重要原料
⑤SiO2是酸性氧化物,不溶于任何酸
A.①②⑤ B.①⑤ C.③④ D.②⑤
【解析】选D。①晶体硅和金刚石都具有熔点高、硬度大的性质;②地壳中硅的含量占第二位;③单质硅的导电能力介于导体和绝缘体之间,是半导体;④SiO2的重要用途就是制造光导纤维;⑤SiO2可与氢氟酸反应。
知识点二:SiO2和光导纤维
3.已知可溶性硅酸盐是矿物胶,则下列能贮存在带有玻璃塞的磨口试剂瓶里的试剂是( )
A.液溴 B.氢氧化钾溶液
C.氢氟酸 D.石灰水
【解析】选A。KOH溶液、Ca(OH)2溶液等碱性物质能与玻璃中的主要成分SiO2反应生成黏稠的硅酸盐,将瓶口与瓶塞黏住难以将瓶子打开,故B、D不可,C中氢氟酸与玻璃中的SiO2反应。
4.下列关于SiO2的说法,正确的是( )
A.SiO2是制造光导纤维的重要材料
B.SiO2溶于水生成硅酸
C.SiO2对应水化物酸性比碳酸强
D.SiO2是酸性氧化物,不跟任何酸反应
【解析】选A。SiO2具有全反射光来传导光线的作用,故可用作制造光导纤维;SiO2不能溶于水;H2SiO3的酸性比碳酸弱;SiO2是酸性氧化物,可是可与氢氟酸反应。
5.根据如图所示A、B、D、E的变化关系,回答下列问题:
(1)写出A、D的名称:A:___、D:___。
(2)写出B→A的化学方程式:________。
(3)写出下列反应的离子方程式:
A→E:_________;
B→E:_________。
【解析】由图分析:A与O2反应生成B,而B与碳在高温下反应生成A可推知A是单质,B是氧化物,而A、B均能与NaOH溶液反应,应确认A是硅,B是二氧化硅,则E是硅酸钠,D是硅酸。
答案:(1)硅 硅酸 (2)SiO2+2C Si+2CO↑
(3)Si+2OH-+H2O ==== SiO32-+2H2↑
SiO2+2OH- ==== SiO32-+H2O
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.在①浓硝酸 ②水 ③王水 ④氢氟酸 ⑤氢氧化钾溶液中,能与二氧化硅起化学反应的有( )
A.①② B.②④ C.④⑤ D.③④
【解析】选C。SiO2难溶于水,一般不与酸反应,能与强碱反应,但可与氢氟酸反应。
2.将过量的CO2分别通入①CaCl2溶液、②Na2SiO3溶液、③Ca(ClO)2溶液、④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.只有①②③④ B.只有②④
C.只有①②③ D.只有②③
【解析】选B。CO2与CaCl2不反应;与Na2SiO3溶液反应生成H2SiO3沉淀;与Ca(ClO)2反应生成可溶性的盐Ca(HCO3)2和HClO;与饱和Na2CO3溶液反应生成溶解度比Na2CO3小的NaHCO3晶体。
3.(双选)下列关于碳和硅的叙述中,不正确的是
( )
A.氧化物都能与NaOH溶液反应
B.单质在加热时都能与氧气反应
C.氧化物都能溶于水生成相应的酸
D.常温下,碳和硅的单质化学性质都不活泼
【解析】选A、C。CO与NaOH溶液不反应,故A项错;碳、硅与氧气在加热时都反应,B项对;SiO2与水不反应,CO与水也不反应,C项错;碳、硅的化学性质在常温下比较稳定,D项对。
4.现有下列5个转化,其中不可能通过一步反应实现的是( )
A.①② B.③④ C.②③④ D.②③④⑤
【解析】选B。反应①可以是SiO2与NaOH溶液反应生成;反应②可以是硅和氧气在高温下反应生成;SiO2不溶于水且不和盐酸、Cl2反应,故反应③④不能一步发生;Na2O2和H2O反应可生成NaOH。
5.将2.8 g硅粉与2.3 g钠同时放入足量水中,采用恰当的方法收集反应过程中产生的气体(全部收集),这些气体在标准状况下的体积为( )
A.1.12 L B.4.48 L
C.5.6 L D.3.36 L
【解析】选D。本题重点是考查钠与水、硅与碱溶液的反应的有关计算。
2Na+2H2O ==== 2NaOH + H2↑
2×23 g 2 mol 22.4 L
2.3 g 0.1 mol 1.12 L
Si + 2NaOH+H2O ==== Na2SiO3+2H2↑
28 g 2 mol 2×22.4 L
1.4 g 0.1 mol 2.24 L
反应后硅有剩余,V(H2)=1.12 L+2.24 L=3.36 L。
二、非选择题(本题包括1小题,共10分)
6.A、B、C、D均为化合物,其中A是
一种高熔点化合物,不溶于硫酸、
硝酸,却溶于氢氟酸。A、B、C、D
间的转化关系如图。请完成下列问题。
(1)A、B、C、D的化学式分别是__、__、__、__。
(2)A?B的化学反应方程式是_______。
(3)C?D的化学反应方程式是_______。
【解析】由“A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸”推出A为SiO2,然后推出B为CO,C为CO2,D为H2SiO3。
答案:(1)SiO2 CO CO2 H2SiO3
(2)SiO2+2C Si+2CO↑
(3)SiO32-+CO2+H2O ==== H2SiO3↓+CO32-
高温
====
1.(5分)对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
高温
====
【解析】选C。从反应方程式可以看出,只有碳元素化合价发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化剂和还原剂质量比为1∶2。
2.(15分)已知A是一种不
溶于水的固体非金属氧化
物,根据如图中的转化关
系,回答:
(1)A是___,B是___,D是___。
(2)写出下列反应的化学方程式:
①_______________________,
⑤_______________________。
(3)写出下列反应的离子方程式:
②______________________,
③______________________,
④______________________。
【解析】由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的。由SiO2→B→H2SiO3,可知B为Na2SiO3。
答案:(1)SiO2 Na2SiO3 H2SiO3
(2)①Na2CO3+SiO2 Na2SiO3+CO2↑
⑤H2SiO3 H2O+SiO2
(3)②CO2+H2O+SiO32- ==== CO32-+H2SiO3↓
③SiO2+2OH- ==== SiO32-+H2O
④SiO32-+2H+ ==== H2SiO3↓
高温
====
△
====
【典例1】下列有关说法中正确的是
A.硅单质既不能与酸反应又不能与碱反应
B.硅在自然界中以化合态存在
C.硅是制造光导纤维的材料
D.硅元素在地壳中的含量居第一位
【思路点拨】牢记硅的基本性质及特性、用途。
【自主解答】选B。单质硅可以与氢氟酸和强碱溶液反应,所以A项错误;SiO2是制造光导纤维的材料;硅在地壳中的含量仅次于氧,位于第二位。
【典例2】对于碳和硅元素的说法,下列叙述中正确的是
A.SiO2和CO2均由分子直接组成
B.C、Si的最外层电子数都是4,次外层电子数都是8
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧
化钙反应
D.碳和硅元素的主要化合价是+4价和+2价
【思路点拨】结合C、Si的原子结构特点,CO2、SiO2的组成和结构分析各项。
【自主解答】选C。CO2由分子构成,SiO2由原子构成,所以A错。碳原子的次外层只有2个电子,B错。CO2、SiO2均能与CaO反应生成盐,C对。硅元素的主要化合价是+4价。
知识点一:半导体材料和单质硅
1.可以用做半导体材料的是( )
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
【解析】选C。常用的半导体材料为高纯硅。
2.下列关于硅及硅的化合物的叙述中不正确的是
( )
①硅的结构和金刚石相似,所以都具有熔点高、硬度大等特点
②硅是地壳中含量最多的非金属
③晶体硅是良好的半导体材料
④SiO2是制造光导纤维的重要原料
⑤SiO2是酸性氧化物,不溶于任何酸
A.①②⑤ B.①⑤ C.③④ D.②⑤
【解析】选D。①晶体硅和金刚石都具有熔点高、硬度大的性质;②地壳中硅的含量占第二位;③单质硅的导电能力介于导体和绝缘体之间,是半导体;④SiO2的重要用途就是制造光导纤维;⑤SiO2可与氢氟酸反应。
知识点二:SiO2和光导纤维
3.已知可溶性硅酸盐是矿物胶,则下列能贮存在带有玻璃塞的磨口试剂瓶里的试剂是( )
A.液溴 B.氢氧化钾溶液
C.氢氟酸 D.石灰水
【解析】选A。KOH溶液、Ca(OH)2溶液等碱性物质能与玻璃中的主要成分SiO2反应生成黏稠的硅酸盐,将瓶口与瓶塞黏住难以将瓶子打开,故B、D不可,C中氢氟酸与玻璃中的SiO2反应。
4.下列关于SiO2的说法,正确的是( )
A.SiO2是制造光导纤维的重要材料
B.SiO2溶于水生成硅酸
C.SiO2对应水化物酸性比碳酸强
D.SiO2是酸性氧化物,不跟任何酸反应
【解析】选A。SiO2具有全反射光来传导光线的作用,故可用作制造光导纤维;SiO2不能溶于水;H2SiO3的酸性比碳酸弱;SiO2是酸性氧化物,可是可与氢氟酸反应。
5.根据如图所示A、B、D、E的变化关系,回答下列问题:
(1)写出A、D的名称:A:___、D:___。
(2)写出B→A的化学方程式:________。
(3)写出下列反应的离子方程式:
A→E:_________;
B→E:_________。
【解析】由图分析:A与O2反应生成B,而B与碳在高温下反应生成A可推知A是单质,B是氧化物,而A、B均能与NaOH溶液反应,应确认A是硅,B是二氧化硅,则E是硅酸钠,D是硅酸。
答案:(1)硅 硅酸 (2)SiO2+2C Si+2CO↑
(3)Si+2OH-+H2O ==== SiO32-+2H2↑
SiO2+2OH- ==== SiO32-+H2O
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.在①浓硝酸 ②水 ③王水 ④氢氟酸 ⑤氢氧化钾溶液中,能与二氧化硅起化学反应的有( )
A.①② B.②④ C.④⑤ D.③④
【解析】选C。SiO2难溶于水,一般不与酸反应,能与强碱反应,但可与氢氟酸反应。
2.将过量的CO2分别通入①CaCl2溶液、②Na2SiO3溶液、③Ca(ClO)2溶液、④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.只有①②③④ B.只有②④
C.只有①②③ D.只有②③
【解析】选B。CO2与CaCl2不反应;与Na2SiO3溶液反应生成H2SiO3沉淀;与Ca(ClO)2反应生成可溶性的盐Ca(HCO3)2和HClO;与饱和Na2CO3溶液反应生成溶解度比Na2CO3小的NaHCO3晶体。
3.(双选)下列关于碳和硅的叙述中,不正确的是
( )
A.氧化物都能与NaOH溶液反应
B.单质在加热时都能与氧气反应
C.氧化物都能溶于水生成相应的酸
D.常温下,碳和硅的单质化学性质都不活泼
【解析】选A、C。CO与NaOH溶液不反应,故A项错;碳、硅与氧气在加热时都反应,B项对;SiO2与水不反应,CO与水也不反应,C项错;碳、硅的化学性质在常温下比较稳定,D项对。
4.现有下列5个转化,其中不可能通过一步反应实现的是( )
A.①② B.③④ C.②③④ D.②③④⑤
【解析】选B。反应①可以是SiO2与NaOH溶液反应生成;反应②可以是硅和氧气在高温下反应生成;SiO2不溶于水且不和盐酸、Cl2反应,故反应③④不能一步发生;Na2O2和H2O反应可生成NaOH。
5.将2.8 g硅粉与2.3 g钠同时放入足量水中,采用恰当的方法收集反应过程中产生的气体(全部收集),这些气体在标准状况下的体积为( )
A.1.12 L B.4.48 L
C.5.6 L D.3.36 L
【解析】选D。本题重点是考查钠与水、硅与碱溶液的反应的有关计算。
2Na+2H2O ==== 2NaOH + H2↑
2×23 g 2 mol 22.4 L
2.3 g 0.1 mol 1.12 L
Si + 2NaOH+H2O ==== Na2SiO3+2H2↑
28 g 2 mol 2×22.4 L
1.4 g 0.1 mol 2.24 L
反应后硅有剩余,V(H2)=1.12 L+2.24 L=3.36 L。
二、非选择题(本题包括1小题,共10分)
6.A、B、C、D均为化合物,其中A是
一种高熔点化合物,不溶于硫酸、
硝酸,却溶于氢氟酸。A、B、C、D
间的转化关系如图。请完成下列问题。
(1)A、B、C、D的化学式分别是__、__、__、__。
(2)A?B的化学反应方程式是_______。
(3)C?D的化学反应方程式是_______。
【解析】由“A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸”推出A为SiO2,然后推出B为CO,C为CO2,D为H2SiO3。
答案:(1)SiO2 CO CO2 H2SiO3
(2)SiO2+2C Si+2CO↑
(3)SiO32-+CO2+H2O ==== H2SiO3↓+CO32-
高温
====
1.(5分)对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
高温
====
【解析】选C。从反应方程式可以看出,只有碳元素化合价发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化剂和还原剂质量比为1∶2。
2.(15分)已知A是一种不
溶于水的固体非金属氧化
物,根据如图中的转化关
系,回答:
(1)A是___,B是___,D是___。
(2)写出下列反应的化学方程式:
①_______________________,
⑤_______________________。
(3)写出下列反应的离子方程式:
②______________________,
③______________________,
④______________________。
【解析】由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的。由SiO2→B→H2SiO3,可知B为Na2SiO3。
答案:(1)SiO2 Na2SiO3 H2SiO3
(2)①Na2CO3+SiO2 Na2SiO3+CO2↑
⑤H2SiO3 H2O+SiO2
(3)②CO2+H2O+SiO32- ==== CO32-+H2SiO3↓
③SiO2+2OH- ==== SiO32-+H2O
④SiO32-+2H+ ==== H2SiO3↓
高温
====
△
====
