10-11高中化学课时讲练通课件:单元质量评估(三)(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:单元质量评估(三)(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 08:12:09 | ||
图片预览











文档简介
(共36张PPT)
第3章 自然界中的元素
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 N-14
O-16 S-32 Cu-64
一、选择题(本题包括12小题,每小题4分,共48分)
1.水体污染是一种严重的污染问题,下列措施中,不会
造成水体污染的是( )
①控制工业生产中的“废水”和城市污水
②减少有机农药的使用
③多植树造林
④减少SO2等气体的排放
⑤水生植物的繁殖
A.①②③④⑤ B.①②③④
C.③④⑤ D.①②③
【解析】选A。⑤会在某种程度上破坏生物链,不会造成水体污染,故选①②③④⑤。
2.我国城市环境中的大气污染物主要是( )
A.CO2、Cl2、N2、酸雨
B.SO2、NO2、CO、烟尘
C.NH3、CO2、NO、雾
D.HCl、SO2、N2、粉尘
【解析】选B。CO2、N2不是空气污染物。空气中78%的气
体是N2,CO2占空气成分的0.03%。
3.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及
判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均
有气体生成,A错;加入Ca(OH)2均有沉淀生成,
B错。加热后质量一定减少,D错。加入BaCl2如果有沉
淀生成则证明有Na2CO3。
4.(2010·玉溪高一检测)香烟烟雾中往往含有CO和
SO2气体,下列关于这两种气体的说法正确的是( )
A.两者都易溶于水
B.两者都是形成酸雨的主要原因
C.两者都能使品红溶液退色
D.两者都污染环境,危害健康
【解析】选D。A项,CO不溶于水;B项,SO2是形成酸雨
的主要原因,CO不是;C项,SO2能使品红溶液退色,但
CO不能;D项,CO、SO2都是大气污染物,故D项说法正
确。
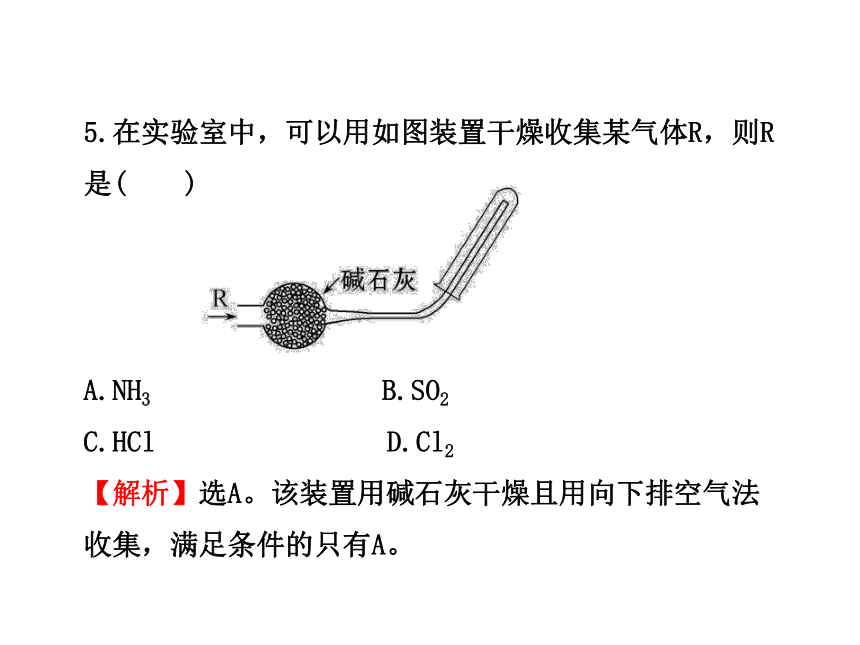
5.在实验室中,可以用如图装置干燥收集某气体R,则R是( )
A.NH3 B.SO2
C.HCl D.Cl2
【解析】选A。该装置用碱石灰干燥且用向下排空气法收集,满足条件的只有A。
6.(2010·泰安高一检测)可用离子方程式CO32-+2H+
====H2O+CO2↑表示的是( )
A.石灰石和盐酸 B.小苏打和盐酸
C.纯碱和盐酸 D.苏打和醋酸
【解析】选C。A项,CaCO3应写分子式,离子方程式为
CaCO3+2H+====CO2↑+H2O+Ca2+;B项,NaHCO3应拆成Na+和
HCO3-,离子方程式为HCO3-+H+====CO2↑+H2O;C项,离子
方程式为CO32-+2H+====CO2↑+H2O;D项,醋酸为弱酸,应
写分子式,离子方程式为CO32-+2CH3COOH====2CH3COO-
+H2O+CO2↑。故应选C项。
7.根据下列说法可以肯定溶液中大量存在CO32-的是
( )
A.加入AgNO3溶液有白色沉淀生成
B.加入稀盐酸有无色无味气体生成
C.加入Ba(OH)2溶液有白色沉淀生成,再加稀盐酸沉淀溶
解,产生使澄清石灰水变浑浊的无色无味气体
D.加入CaCl2溶液时有白色沉淀产生,再加稀盐酸,产生
使澄清石灰水变浑浊的无色无味气体
【解析】选D。A项溶液中若有Cl-,同样会产生AgCl白
色沉淀;B、C项中会有HCO3-的干扰,则B中反应为:
HCO3-+H+====CO2↑+H2O;C中反应为Ba2++OH-+HCO3-
==== BaCO3↓+H2O, BaCO3+2H+====Ba2++CO2↑+H2O,
同样会有上述现象产生,故选D。
8.向盛有KI溶液的试管中加入适量溴水和四氯化碳,振
荡后静置,可见到的现象是( )
A.上层为紫色液体,下层为无色液体
B.上层为无色液体,下层为紫色液体
C.均为紫色液体
D.上层为橙色液体,下层为紫色液体
【解析】选B。溴水与KI反应生成KBr和I2,溶有I2的四氯化碳为紫色液体,又因四氯化碳不溶于水且密度大于水。故下层为紫色液体,上层为无色液体。
9.(2009·山东高考改造题)下列推断合理的是 ( )
A.常温下,铁与浓硫酸发生钝化,故可用铁质容器盛放
冷的浓硫酸
B.金刚石是自然界中硬度最大的物质,不可以和氧气发
生反应
C.浓H2SO4有强氧化性,常温下与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液退色后加热,恢复原色;
将SO2通入溴水中,溴水退色后加热,也能恢复原色
【解析】选A。B中金刚石与O2反应生成CO2;C中浓
H2SO4与Cu在常温下难以反应;D中SO2与溴水反应生成
H2SO4和HBr,加热不能恢复原色。
10.溴化碘(IBr)的化学性质与氯气相似,能跟大多数
金属反应生成金属卤化物,能跟水反应:IBr+H2O====
HBr+HIO,下列有关叙述中不正确的是( )
A.IBr与Br2具有相似的化学性质
B.在很多化学反应中IBr作氧化剂
C.IBr与水反应时,它既是氧化剂,又是还原剂
D.跟NaOH溶液反应可生成NaBr和NaIO
【解析】选C。在IBr中,I显+1价,Br显-1价,因此在
IBr+H2O====HBr+HIO中各元素化合价均无变化,为非氧
化还原反应,IBr与碱的反应也是非氧化还原反应,产
物应为NaBr和NaIO。IBr中+1价的碘在反应时易转化为
-1价,因此IBr常用作氧化剂。
11.在一定温度和压强下,将装有N2和NO2混合气体的试
管倒立在水中,经足够时间后,试管内气体的体积缩小
为原体积的3/5,则原混合气体中N2和NO2的体积比是
( )
A.2∶3 B.3∶2
C.3∶5 D.5∶3
【解析】选A。设原混合气体中NO2体积为x,N2为1-x,因
为3NO2+H2O====2HNO3+NO,则 +(1-x)= x=0.6,
(1-x)∶x=0.4∶0.6=2∶3。
12.有一瓶无色气体,可能含HCl、CO2、H2S、HBr、SO2
中的一种或几种,将其通入氯水中,得到无色透明溶
液,把溶液分成两份,向一份中加入盐酸酸化的氯化钡
溶液,出现白色沉淀。另一份中加入硝酸酸化的AgNO3
溶液,也有白色沉淀生成,以下结论中,正确的是( )
①原气体中肯定有SO2
②原气体中可能有SO2
③原气体中肯定没有H2S,HBr
④不能肯定原气体中是否是有HCl
⑤原气体中肯定没有CO2
⑥原气体中肯定有HCl
A.只有①③④ B.只有①④⑤
C.只有①③⑥ D.只有①③⑤⑥
【解析】选A。根据题意“通入氯水中,得到无色透明
溶液”,可以排除H2S、HBr气体的存在,如果存在
SO2,Cl2可以将其氧化为H2SO4,从而符合后面的信息;
但“加入硝酸酸化的AgNO3溶液,也有白色沉淀生
成”,不能肯定一定存在HCl,因为通入Cl2可以引入
Cl-,据以上信息可以得出原气体中肯定没有H2S、HBr,
肯定有SO2,但不能肯定原气体中是否含有HCl,故选A。
二、非选择题(本题包括4小题,共52分)
13.(10分)某兴趣小组设计出如图所示装置来改进教
材中“铜与硝酸反应”实验,以探究化学实验的绿色
化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管
口,塞紧试管c和d的胶塞,加热c。其目的是_______
________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分
液漏斗a向c中加入2 mL浓硝酸。反应一段时间后,再由
a向c中加2 mL蒸馏水,c中的实验现象是__________
________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学
理念的最佳方案是_______,理由是________________。
【解析】(1)实验前要检验装置的气密性。
(2)Cu和浓HNO3反应生成NO2,加水时3NO2+H2O====NO
+2HNO3。
(3)甲:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O;
乙:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O;
丙:2Cu+O2====2CuO,CuO+2HNO3====Cu(NO3)2+H2O。
三种方案相比:丙方案消耗酸最少,没有污染性气体产
生,体现了环保节能的原则。
△
答案:(1)检查装置气密性
(2)反应变缓,气体颜色变淡
(3)丙 耗酸量最少,无污染
14.(13分)A、B、C、D、E五种物质中含有同一种元
素,其相互转化关系如图所示。
(1)如果A是淡黄色固体,则B是________________,
E是_________________(均填写化学式)。
E→C的化学方程式是_________。
(2)如果A是无色气体,
B→C的化学方程式为____________。
E→C的化学方程式为____________。
【解析】(1)若A是淡黄色固体,则A为S,B为H2S,C为
SO2,D为SO3,E为浓H2SO4,则E→C的化学方程式是
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O;(2)若A是无色
气体,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3,故
B→C的化学方程式为4NH3+5O2======4NO+6H2O,
E→C的化学方程式为3Cu+8HNO3(稀)====3Cu(NO3)2+
2NO↑+4H2O。
△
高温
催化剂
答案:(1)H2S 浓H2SO4
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
(2)4NH3+5O2======4NO+6H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
高温
催化剂
△
15.(12分)实验室制备氨气的反应中,涉及发生、干燥、收集和尾气处理。
(1)实验室制备氨气的反应原理(写化学方程式)
_______________________________。
(2)用_________干燥氨气。
(3)用_________法收集氨气。
(4)在试管口放一沾有稀H2SO4的棉花,其作用是____________________________________。
(5)如何验证氨气已收集满了?
________________________________________。
【解析】在实验室中常用固体NH4Cl和Ca(OH)2反应制氨
气,用碱石灰干燥氨气,因氨气易溶于水,且密度小于
空气,常用向下排空气法收集。常用湿润的红色石蕊试
纸来验证氨气是否已集满。
答案:(1)2NH4Cl+Ca(OH)2====CaCl2+2NH3↑+2H2O
(2)碱石灰
(3)向下排空气
(4)吸收多余的氨气;防止与空气形成对流
(5)将湿润的红色石蕊试纸放在试管口,若试纸变蓝色,则证明已收集满了
△
16.(17分)某校科技小组同学采集酸雨样品,每隔一
段时间测定pH,得到下列数据:
(1)酸雨的形成是由于工业生产过程中大量矿物燃料的
使用,使空气中_____气体较多,与降水结合产生,请
写出酸雨形成的化学反应方程式_________________。
(2)解释酸雨放置时,pH变化的主要原因_________,
写出pH变化的离子方程式_________。
(3)如果将刚取样的上述雨水和自来水(用氯气消毒)
相混合,pH将______(填“增大”、“减小”或“不
变”),原因是(用化学方程式表示) _________。
(4)为防治酸雨,降低硫氧化物造成的污染,硫酸厂
用氨水来吸收SO2,其化学方程式为______________。
【解析】(1)矿物燃料燃烧产生SO2气体,与H2O反应产
生H2SO3,SO2+H2O H2SO3。
(2)H2SO3中S元素的化合价为+4价,具有较强的还原
性,能被空气中的O2氧化,生成H2SO4。
(3)Cl2可将H2SO3氧化为H2SO4,同时生成HCl。
(4)SO2和氨水发生酸碱中和反应。
答案:(1)SO2 SO2+H2O H2SO3,
2H2SO3+O2====2H2SO4
(2)H2SO3易被空气中的O2氧化生成强酸H2SO4
2H2SO3+O2====4H++2SO42-
(3)减小 H2SO3+Cl2+H2O====H2SO4+2HCl
(4)SO2+2NH3·H2O====(NH4)2SO3+H2O
第3章 自然界中的元素
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 N-14
O-16 S-32 Cu-64
一、选择题(本题包括12小题,每小题4分,共48分)
1.水体污染是一种严重的污染问题,下列措施中,不会
造成水体污染的是( )
①控制工业生产中的“废水”和城市污水
②减少有机农药的使用
③多植树造林
④减少SO2等气体的排放
⑤水生植物的繁殖
A.①②③④⑤ B.①②③④
C.③④⑤ D.①②③
【解析】选A。⑤会在某种程度上破坏生物链,不会造成水体污染,故选①②③④⑤。
2.我国城市环境中的大气污染物主要是( )
A.CO2、Cl2、N2、酸雨
B.SO2、NO2、CO、烟尘
C.NH3、CO2、NO、雾
D.HCl、SO2、N2、粉尘
【解析】选B。CO2、N2不是空气污染物。空气中78%的气
体是N2,CO2占空气成分的0.03%。
3.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及
判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均
有气体生成,A错;加入Ca(OH)2均有沉淀生成,
B错。加热后质量一定减少,D错。加入BaCl2如果有沉
淀生成则证明有Na2CO3。
4.(2010·玉溪高一检测)香烟烟雾中往往含有CO和
SO2气体,下列关于这两种气体的说法正确的是( )
A.两者都易溶于水
B.两者都是形成酸雨的主要原因
C.两者都能使品红溶液退色
D.两者都污染环境,危害健康
【解析】选D。A项,CO不溶于水;B项,SO2是形成酸雨
的主要原因,CO不是;C项,SO2能使品红溶液退色,但
CO不能;D项,CO、SO2都是大气污染物,故D项说法正
确。
5.在实验室中,可以用如图装置干燥收集某气体R,则R是( )
A.NH3 B.SO2
C.HCl D.Cl2
【解析】选A。该装置用碱石灰干燥且用向下排空气法收集,满足条件的只有A。
6.(2010·泰安高一检测)可用离子方程式CO32-+2H+
====H2O+CO2↑表示的是( )
A.石灰石和盐酸 B.小苏打和盐酸
C.纯碱和盐酸 D.苏打和醋酸
【解析】选C。A项,CaCO3应写分子式,离子方程式为
CaCO3+2H+====CO2↑+H2O+Ca2+;B项,NaHCO3应拆成Na+和
HCO3-,离子方程式为HCO3-+H+====CO2↑+H2O;C项,离子
方程式为CO32-+2H+====CO2↑+H2O;D项,醋酸为弱酸,应
写分子式,离子方程式为CO32-+2CH3COOH====2CH3COO-
+H2O+CO2↑。故应选C项。
7.根据下列说法可以肯定溶液中大量存在CO32-的是
( )
A.加入AgNO3溶液有白色沉淀生成
B.加入稀盐酸有无色无味气体生成
C.加入Ba(OH)2溶液有白色沉淀生成,再加稀盐酸沉淀溶
解,产生使澄清石灰水变浑浊的无色无味气体
D.加入CaCl2溶液时有白色沉淀产生,再加稀盐酸,产生
使澄清石灰水变浑浊的无色无味气体
【解析】选D。A项溶液中若有Cl-,同样会产生AgCl白
色沉淀;B、C项中会有HCO3-的干扰,则B中反应为:
HCO3-+H+====CO2↑+H2O;C中反应为Ba2++OH-+HCO3-
==== BaCO3↓+H2O, BaCO3+2H+====Ba2++CO2↑+H2O,
同样会有上述现象产生,故选D。
8.向盛有KI溶液的试管中加入适量溴水和四氯化碳,振
荡后静置,可见到的现象是( )
A.上层为紫色液体,下层为无色液体
B.上层为无色液体,下层为紫色液体
C.均为紫色液体
D.上层为橙色液体,下层为紫色液体
【解析】选B。溴水与KI反应生成KBr和I2,溶有I2的四氯化碳为紫色液体,又因四氯化碳不溶于水且密度大于水。故下层为紫色液体,上层为无色液体。
9.(2009·山东高考改造题)下列推断合理的是 ( )
A.常温下,铁与浓硫酸发生钝化,故可用铁质容器盛放
冷的浓硫酸
B.金刚石是自然界中硬度最大的物质,不可以和氧气发
生反应
C.浓H2SO4有强氧化性,常温下与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液退色后加热,恢复原色;
将SO2通入溴水中,溴水退色后加热,也能恢复原色
【解析】选A。B中金刚石与O2反应生成CO2;C中浓
H2SO4与Cu在常温下难以反应;D中SO2与溴水反应生成
H2SO4和HBr,加热不能恢复原色。
10.溴化碘(IBr)的化学性质与氯气相似,能跟大多数
金属反应生成金属卤化物,能跟水反应:IBr+H2O====
HBr+HIO,下列有关叙述中不正确的是( )
A.IBr与Br2具有相似的化学性质
B.在很多化学反应中IBr作氧化剂
C.IBr与水反应时,它既是氧化剂,又是还原剂
D.跟NaOH溶液反应可生成NaBr和NaIO
【解析】选C。在IBr中,I显+1价,Br显-1价,因此在
IBr+H2O====HBr+HIO中各元素化合价均无变化,为非氧
化还原反应,IBr与碱的反应也是非氧化还原反应,产
物应为NaBr和NaIO。IBr中+1价的碘在反应时易转化为
-1价,因此IBr常用作氧化剂。
11.在一定温度和压强下,将装有N2和NO2混合气体的试
管倒立在水中,经足够时间后,试管内气体的体积缩小
为原体积的3/5,则原混合气体中N2和NO2的体积比是
( )
A.2∶3 B.3∶2
C.3∶5 D.5∶3
【解析】选A。设原混合气体中NO2体积为x,N2为1-x,因
为3NO2+H2O====2HNO3+NO,则 +(1-x)= x=0.6,
(1-x)∶x=0.4∶0.6=2∶3。
12.有一瓶无色气体,可能含HCl、CO2、H2S、HBr、SO2
中的一种或几种,将其通入氯水中,得到无色透明溶
液,把溶液分成两份,向一份中加入盐酸酸化的氯化钡
溶液,出现白色沉淀。另一份中加入硝酸酸化的AgNO3
溶液,也有白色沉淀生成,以下结论中,正确的是( )
①原气体中肯定有SO2
②原气体中可能有SO2
③原气体中肯定没有H2S,HBr
④不能肯定原气体中是否是有HCl
⑤原气体中肯定没有CO2
⑥原气体中肯定有HCl
A.只有①③④ B.只有①④⑤
C.只有①③⑥ D.只有①③⑤⑥
【解析】选A。根据题意“通入氯水中,得到无色透明
溶液”,可以排除H2S、HBr气体的存在,如果存在
SO2,Cl2可以将其氧化为H2SO4,从而符合后面的信息;
但“加入硝酸酸化的AgNO3溶液,也有白色沉淀生
成”,不能肯定一定存在HCl,因为通入Cl2可以引入
Cl-,据以上信息可以得出原气体中肯定没有H2S、HBr,
肯定有SO2,但不能肯定原气体中是否含有HCl,故选A。
二、非选择题(本题包括4小题,共52分)
13.(10分)某兴趣小组设计出如图所示装置来改进教
材中“铜与硝酸反应”实验,以探究化学实验的绿色
化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管
口,塞紧试管c和d的胶塞,加热c。其目的是_______
________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分
液漏斗a向c中加入2 mL浓硝酸。反应一段时间后,再由
a向c中加2 mL蒸馏水,c中的实验现象是__________
________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学
理念的最佳方案是_______,理由是________________。
【解析】(1)实验前要检验装置的气密性。
(2)Cu和浓HNO3反应生成NO2,加水时3NO2+H2O====NO
+2HNO3。
(3)甲:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O;
乙:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O;
丙:2Cu+O2====2CuO,CuO+2HNO3====Cu(NO3)2+H2O。
三种方案相比:丙方案消耗酸最少,没有污染性气体产
生,体现了环保节能的原则。
△
答案:(1)检查装置气密性
(2)反应变缓,气体颜色变淡
(3)丙 耗酸量最少,无污染
14.(13分)A、B、C、D、E五种物质中含有同一种元
素,其相互转化关系如图所示。
(1)如果A是淡黄色固体,则B是________________,
E是_________________(均填写化学式)。
E→C的化学方程式是_________。
(2)如果A是无色气体,
B→C的化学方程式为____________。
E→C的化学方程式为____________。
【解析】(1)若A是淡黄色固体,则A为S,B为H2S,C为
SO2,D为SO3,E为浓H2SO4,则E→C的化学方程式是
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O;(2)若A是无色
气体,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3,故
B→C的化学方程式为4NH3+5O2======4NO+6H2O,
E→C的化学方程式为3Cu+8HNO3(稀)====3Cu(NO3)2+
2NO↑+4H2O。
△
高温
催化剂
答案:(1)H2S 浓H2SO4
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
(2)4NH3+5O2======4NO+6H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
高温
催化剂
△
15.(12分)实验室制备氨气的反应中,涉及发生、干燥、收集和尾气处理。
(1)实验室制备氨气的反应原理(写化学方程式)
_______________________________。
(2)用_________干燥氨气。
(3)用_________法收集氨气。
(4)在试管口放一沾有稀H2SO4的棉花,其作用是____________________________________。
(5)如何验证氨气已收集满了?
________________________________________。
【解析】在实验室中常用固体NH4Cl和Ca(OH)2反应制氨
气,用碱石灰干燥氨气,因氨气易溶于水,且密度小于
空气,常用向下排空气法收集。常用湿润的红色石蕊试
纸来验证氨气是否已集满。
答案:(1)2NH4Cl+Ca(OH)2====CaCl2+2NH3↑+2H2O
(2)碱石灰
(3)向下排空气
(4)吸收多余的氨气;防止与空气形成对流
(5)将湿润的红色石蕊试纸放在试管口,若试纸变蓝色,则证明已收集满了
△
16.(17分)某校科技小组同学采集酸雨样品,每隔一
段时间测定pH,得到下列数据:
(1)酸雨的形成是由于工业生产过程中大量矿物燃料的
使用,使空气中_____气体较多,与降水结合产生,请
写出酸雨形成的化学反应方程式_________________。
(2)解释酸雨放置时,pH变化的主要原因_________,
写出pH变化的离子方程式_________。
(3)如果将刚取样的上述雨水和自来水(用氯气消毒)
相混合,pH将______(填“增大”、“减小”或“不
变”),原因是(用化学方程式表示) _________。
(4)为防治酸雨,降低硫氧化物造成的污染,硫酸厂
用氨水来吸收SO2,其化学方程式为______________。
【解析】(1)矿物燃料燃烧产生SO2气体,与H2O反应产
生H2SO3,SO2+H2O H2SO3。
(2)H2SO3中S元素的化合价为+4价,具有较强的还原
性,能被空气中的O2氧化,生成H2SO4。
(3)Cl2可将H2SO3氧化为H2SO4,同时生成HCl。
(4)SO2和氨水发生酸碱中和反应。
答案:(1)SO2 SO2+H2O H2SO3,
2H2SO3+O2====2H2SO4
(2)H2SO3易被空气中的O2氧化生成强酸H2SO4
2H2SO3+O2====4H++2SO42-
(3)减小 H2SO3+Cl2+H2O====H2SO4+2HCl
(4)SO2+2NH3·H2O====(NH4)2SO3+H2O
