10-11高中化学课时讲练通课件:3.2.1 氮的循环(鲁科版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.2.1 氮的循环(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览








文档简介
(共47张PPT)
【典例】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升。
【思路点拨】根据NO2和H2O反应,NO和O2反应的情况分析,剩余气体可能是NO或O2。找出NO2、O2和H2O反应的关系,判断哪种气体过量。分别讨论原混合气体的组成。
【自主解答】(1)若剩余的是NO,可以看成先发生了
反应4NO2+O2+2H2O ==== 4HNO3。剩余的NO2又与水作
用,最终有2 mL NO产生。由反应3NO2+H2O ==== 2HNO3
+NO得剩余的NO2体积为2 mL×3=6 mL。则原有O2的体
积为(10 mL-6 mL)× =0.8 mL,NO2体积为10 mL-
0.8 mL=9.2 mL。
(2)若剩余的是O2,则有10 mL-2 mL=8 mL NO2和O2的
混合气体按4NO2+O2+2H2O ==== 4HNO3进行。所以NO2的
体积为8 mL× =6.4 mL,O2的体积为10 mL-6.4 mL
=3.6 mL。
答案:(1)若剩余的是NO,则NO2和O2的体积分别为9.2 mL和0.8 mL。
(2)若剩余的是O2,则NO2和O2的体积分别为6.4 mL和3.6 mL。
知识点一:氮的循环中氮气
1.氮气可以用来填充灯泡,原因是( )
A.密度小 B.化学性质很稳定
C.无色 D.价格低廉
【解析】选B。N2中的氮氮叁键很牢固,化学性质很稳定,通常可用来作保护气。
2.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是( )
A.铜和稀硝酸反应 B.氮气和氧气发生反应
C.氨的催化氧化 D.二氧化氮气体溶于水
【解析】选B。城市NO主要来自汽车尾气,在汽车汽缸内吸入空气(含N2和O2)在电火花塞放电时N2和O2会生成NO。
知识点二:一氧化氮和二氧化氮
3.NO有毒,会结合血红蛋白造成人体缺氧。不过,人们发现它可作为一种传递神经信息的“信使分子”,在使血管扩张、免疫、增强记忆力等方面有着极其重要的作用。下列关于NO的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化
合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得
到
D.一氧化氮易溶于水,不能用排水法收集
【解析】选C。NO为无色的气体,能在常温常压下与空气中的O2直接化合为NO2,同时NO不溶于水,能用排水法收集。NO可由N2和O2在放电的条件下直接化合得到。
4. 在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质质量比为( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
【解析】选C。3NO2+H2O ==== 2HNO3+NO,其中生成HNO3的NO2发生氧化反应,生成NO的NO2发生还原反应,故二者质量之比为2∶1。
5.某同学收集了一集气瓶红棕色气体,用玻璃片盖好,然后向其中加入少量水,振荡后变为无色,然后轻轻移开玻璃片使少量空气进入瓶内,气体又变为红棕色。
(1)集气瓶内红棕色气体是:_______。
(2)气体颜色变化的原因是:_______;
有关的化学方程式是:_______。
(3)在收集该红棕色气体时用什么方法?做该实验时应注意什么问题?为什么?
【解析】在中学阶段常见的红棕色气体有NO2和溴(Br2)蒸气,能产生题干现象的是NO2,由于NO2的密度比空气大,应用向上排空气法收集;又因NO2是毒性气体,应收集尾气,同时应在通风条件下进行,防止意外发生。
答案:(1)NO2
(2)NO2与H2O反应生成无色NO,NO遇空气中的O2反应生成红棕色的NO2
3NO2+H2O ==== 2HNO3+NO、
2NO+O2 ==== 2NO2
(3)收集NO2应用向上排空气法。做该实验时要注意通风及尾气吸收,因为NO和NO2都有毒。
一、选择题(本题包括5小题,每小题4分,共20分)
1.将空气中氮气转化成含氮的化合物的过程称为固氮。如图中能实现人工固氮的是( )
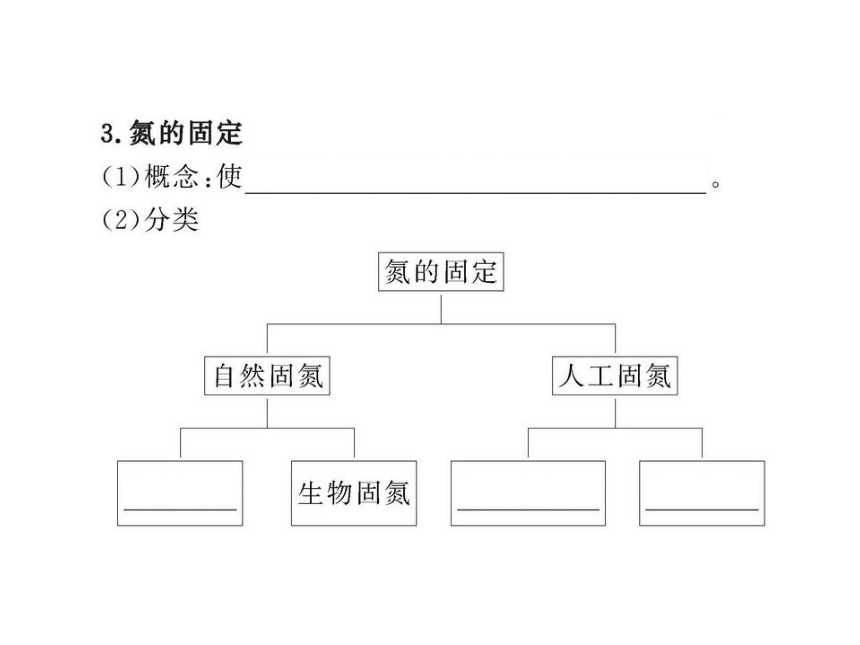
【解析】选D。氮的固定是指使空气中游离态的氮转化
为含氮化合物的过程,主要有自然固氮和人工固氮两
种方式。通过闪电等产生含氮化合物属于自然固氮中
的高能固氮,根瘤菌能够将空气中的氮气通过生物化
学过程转化为含氮化合物,属于自然固氮中的生物固
氮。氨的工业合成原理为N2+3H2 2NH3,是
目前普遍使用的人工固氮方法。电解饱和食盐水原理
为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,与氮的固定无
关。
通电
====
2.下列气体都有毒,使人中毒的原理和CO相似的是
( )
A.Cl2 B.SO2 C.NO D.NO2
【解析】选C。NO和CO都是与人体血红蛋白结合,造成人体缺氧。
3.在体积V L的密闭容器中通入a mol NO,b mol O2后,反应容器内氮原子和氧原子个数比为( )
【解析】选C。反应前后氮原子守恒,氧原子守恒,氮原子为a mol,氧原子为(a+2b)mol。
4.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
( )
A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
【解析】选B。混合气体为无色,一定不含NO2,通过足量的过氧化钠时,气体显红棕色,说明气体中一定含有NO和CO2,CO2与过氧化钠生成的O2再与NO反应生成红棕色的NO2,最后通入水槽中时气体全部被吸收,说明甲气体中无N2。
5.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
解题提示:小苏打即为NaHCO3。
【解析】选C。少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2恰好与NO反应生成NO2,逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
二、非选择题(本题包括1小题,共10分)
6.在标准状况下,将O2和NO2按1∶4的体积比充满干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设瓶内溶液不扩散,最终烧瓶内溶液中溶质的物质的量浓度为___。
【解析】根据4NO2+O2+2H2O ==== 4HNO3,设烧瓶的容
积为V L,则NO2的体积为4/5V L,又因NO2与O2体积比
4∶1,所以最终液体充满烧瓶,溶液的体积为V L,
NO2的物质的量为4/5V× mol,HNO3的物质的量为
4/5V× mol,所以所得HNO3溶液中HNO3的物质的
量浓度为 × mol/L= mol·L-1。
答案: mol·L-1
1.(8分)如图所示,当向试管内
通入21 mLO2时,最后试管中的液
面仍在原来的位置,则原试管中
的NO为( )
A.6 mL B.12 mL
C.16 mL D.18 mL
【解析】选B。通O2后,试管内发生反应为4NO+3O2+
2H2O ==== 4HNO3,则最后剩余气体为O2,且其体积等
于原来试管内NO体积,设NO体积为x mL,则剩余O2体
积为x mL,反应消耗掉O2体积为 mL,则有 =21,
x=12。
2.(12分)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③HCl和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1,V2,V3,则V1,V2,V3的大小顺序是________。
【解析】V1>V3>V2。
①NO不与H2O反应,设原有NO,NO2各3体积,则由反应3NO2+H2O ==== 2HNO3+NO知,3体积的NO2与H2O反应后,变为1体积NO,此时剩余NO的总体积与原来气体的体积比为4∶6。
②由4NO2+O2+2H2O ==== 4HNO3可知等体积的NO2与O2混合溶于水时O2过量,若二者皆为4体积,则剩余3体积O2,与原来总体积的比为3∶8。
③N2不与水反应,HCl完全溶于水,气体剩余体积为原来的一半。
答案:V1>V3>V2
【典例】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升。
【思路点拨】根据NO2和H2O反应,NO和O2反应的情况分析,剩余气体可能是NO或O2。找出NO2、O2和H2O反应的关系,判断哪种气体过量。分别讨论原混合气体的组成。
【自主解答】(1)若剩余的是NO,可以看成先发生了
反应4NO2+O2+2H2O ==== 4HNO3。剩余的NO2又与水作
用,最终有2 mL NO产生。由反应3NO2+H2O ==== 2HNO3
+NO得剩余的NO2体积为2 mL×3=6 mL。则原有O2的体
积为(10 mL-6 mL)× =0.8 mL,NO2体积为10 mL-
0.8 mL=9.2 mL。
(2)若剩余的是O2,则有10 mL-2 mL=8 mL NO2和O2的
混合气体按4NO2+O2+2H2O ==== 4HNO3进行。所以NO2的
体积为8 mL× =6.4 mL,O2的体积为10 mL-6.4 mL
=3.6 mL。
答案:(1)若剩余的是NO,则NO2和O2的体积分别为9.2 mL和0.8 mL。
(2)若剩余的是O2,则NO2和O2的体积分别为6.4 mL和3.6 mL。
知识点一:氮的循环中氮气
1.氮气可以用来填充灯泡,原因是( )
A.密度小 B.化学性质很稳定
C.无色 D.价格低廉
【解析】选B。N2中的氮氮叁键很牢固,化学性质很稳定,通常可用来作保护气。
2.去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是( )
A.铜和稀硝酸反应 B.氮气和氧气发生反应
C.氨的催化氧化 D.二氧化氮气体溶于水
【解析】选B。城市NO主要来自汽车尾气,在汽车汽缸内吸入空气(含N2和O2)在电火花塞放电时N2和O2会生成NO。
知识点二:一氧化氮和二氧化氮
3.NO有毒,会结合血红蛋白造成人体缺氧。不过,人们发现它可作为一种传递神经信息的“信使分子”,在使血管扩张、免疫、增强记忆力等方面有着极其重要的作用。下列关于NO的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化
合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得
到
D.一氧化氮易溶于水,不能用排水法收集
【解析】选C。NO为无色的气体,能在常温常压下与空气中的O2直接化合为NO2,同时NO不溶于水,能用排水法收集。NO可由N2和O2在放电的条件下直接化合得到。
4. 在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质质量比为( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
【解析】选C。3NO2+H2O ==== 2HNO3+NO,其中生成HNO3的NO2发生氧化反应,生成NO的NO2发生还原反应,故二者质量之比为2∶1。
5.某同学收集了一集气瓶红棕色气体,用玻璃片盖好,然后向其中加入少量水,振荡后变为无色,然后轻轻移开玻璃片使少量空气进入瓶内,气体又变为红棕色。
(1)集气瓶内红棕色气体是:_______。
(2)气体颜色变化的原因是:_______;
有关的化学方程式是:_______。
(3)在收集该红棕色气体时用什么方法?做该实验时应注意什么问题?为什么?
【解析】在中学阶段常见的红棕色气体有NO2和溴(Br2)蒸气,能产生题干现象的是NO2,由于NO2的密度比空气大,应用向上排空气法收集;又因NO2是毒性气体,应收集尾气,同时应在通风条件下进行,防止意外发生。
答案:(1)NO2
(2)NO2与H2O反应生成无色NO,NO遇空气中的O2反应生成红棕色的NO2
3NO2+H2O ==== 2HNO3+NO、
2NO+O2 ==== 2NO2
(3)收集NO2应用向上排空气法。做该实验时要注意通风及尾气吸收,因为NO和NO2都有毒。
一、选择题(本题包括5小题,每小题4分,共20分)
1.将空气中氮气转化成含氮的化合物的过程称为固氮。如图中能实现人工固氮的是( )
【解析】选D。氮的固定是指使空气中游离态的氮转化
为含氮化合物的过程,主要有自然固氮和人工固氮两
种方式。通过闪电等产生含氮化合物属于自然固氮中
的高能固氮,根瘤菌能够将空气中的氮气通过生物化
学过程转化为含氮化合物,属于自然固氮中的生物固
氮。氨的工业合成原理为N2+3H2 2NH3,是
目前普遍使用的人工固氮方法。电解饱和食盐水原理
为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,与氮的固定无
关。
通电
====
2.下列气体都有毒,使人中毒的原理和CO相似的是
( )
A.Cl2 B.SO2 C.NO D.NO2
【解析】选C。NO和CO都是与人体血红蛋白结合,造成人体缺氧。
3.在体积V L的密闭容器中通入a mol NO,b mol O2后,反应容器内氮原子和氧原子个数比为( )
【解析】选C。反应前后氮原子守恒,氧原子守恒,氮原子为a mol,氧原子为(a+2b)mol。
4.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
( )
A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
【解析】选B。混合气体为无色,一定不含NO2,通过足量的过氧化钠时,气体显红棕色,说明气体中一定含有NO和CO2,CO2与过氧化钠生成的O2再与NO反应生成红棕色的NO2,最后通入水槽中时气体全部被吸收,说明甲气体中无N2。
5.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
解题提示:小苏打即为NaHCO3。
【解析】选C。少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2恰好与NO反应生成NO2,逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
二、非选择题(本题包括1小题,共10分)
6.在标准状况下,将O2和NO2按1∶4的体积比充满干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设瓶内溶液不扩散,最终烧瓶内溶液中溶质的物质的量浓度为___。
【解析】根据4NO2+O2+2H2O ==== 4HNO3,设烧瓶的容
积为V L,则NO2的体积为4/5V L,又因NO2与O2体积比
4∶1,所以最终液体充满烧瓶,溶液的体积为V L,
NO2的物质的量为4/5V× mol,HNO3的物质的量为
4/5V× mol,所以所得HNO3溶液中HNO3的物质的
量浓度为 × mol/L= mol·L-1。
答案: mol·L-1
1.(8分)如图所示,当向试管内
通入21 mLO2时,最后试管中的液
面仍在原来的位置,则原试管中
的NO为( )
A.6 mL B.12 mL
C.16 mL D.18 mL
【解析】选B。通O2后,试管内发生反应为4NO+3O2+
2H2O ==== 4HNO3,则最后剩余气体为O2,且其体积等
于原来试管内NO体积,设NO体积为x mL,则剩余O2体
积为x mL,反应消耗掉O2体积为 mL,则有 =21,
x=12。
2.(12分)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③HCl和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体体积分别为V1,V2,V3,则V1,V2,V3的大小顺序是________。
【解析】V1>V3>V2。
①NO不与H2O反应,设原有NO,NO2各3体积,则由反应3NO2+H2O ==== 2HNO3+NO知,3体积的NO2与H2O反应后,变为1体积NO,此时剩余NO的总体积与原来气体的体积比为4∶6。
②由4NO2+O2+2H2O ==== 4HNO3可知等体积的NO2与O2混合溶于水时O2过量,若二者皆为4体积,则剩余3体积O2,与原来总体积的比为3∶8。
③N2不与水反应,HCl完全溶于水,气体剩余体积为原来的一半。
答案:V1>V3>V2
