10-11高中化学课时讲练通课件:综合质量评估(鲁科版选修4)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:综合质量评估(鲁科版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 19:17:25 | ||
图片预览











文档简介
(共50张PPT)
(1~3章)
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.化学反应中通常伴随着能量变化,下列说法中错误的是( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
【解析】选B。煤是重要的能源,燃烧时放出大量的热能,但这不是煤中的全部化学能,因为其主要燃烧产物CO2中仍有化学能,A项正确。电解物质时,是将电能转化为化学能,而不是化学能转化为电能,B项错误。TNT(三硝基甲苯)爆炸时,部分化学能转化成了动能,C项正确。镁条燃烧时放出大量热,产生耀眼的白光,故镁条的部分化学能转化成了光能,D项正确。
2.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生成铁锈
D.银质奖牌长期放置后在其奖牌的表面变暗
【解析】选D。A项黄铜(铜锌合金)若发生电化学腐蚀时,被腐蚀的金属应是金属性较活泼的锌而不是铜,B项生铁中含较多的碳,比软铁芯(几乎是纯铁)在电解质作用下更容易形成原电池,也更容易生锈。C项铁质器件附有铜配件时,在接触电解质溶液时,铁是原电池的负极,易被腐蚀生成铁锈。D项银质奖牌久置后可能与氧气或硫氧化成银的化合物而使其表面变暗,这是化学腐蚀,与电化学腐蚀无关。
3.(2010·黄冈高二检测)下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
【解析】选D。铁在浓硫酸中发生钝化,A选项不正确;盐酸跟锌片反应的实质是:Zn+2H+====Zn2++H2↑。加入适量的氯化钠溶液,氯化钠电离出的Na+、Cl-对化学平衡没有影响,但盐酸此时已被稀释了,H+浓度变小,反应速率应变慢,所以B选项也不正确;升高温度对任何反应来说,都将加快反应速率,C选项不正确。减小压强反应速率减慢,D选项正确。
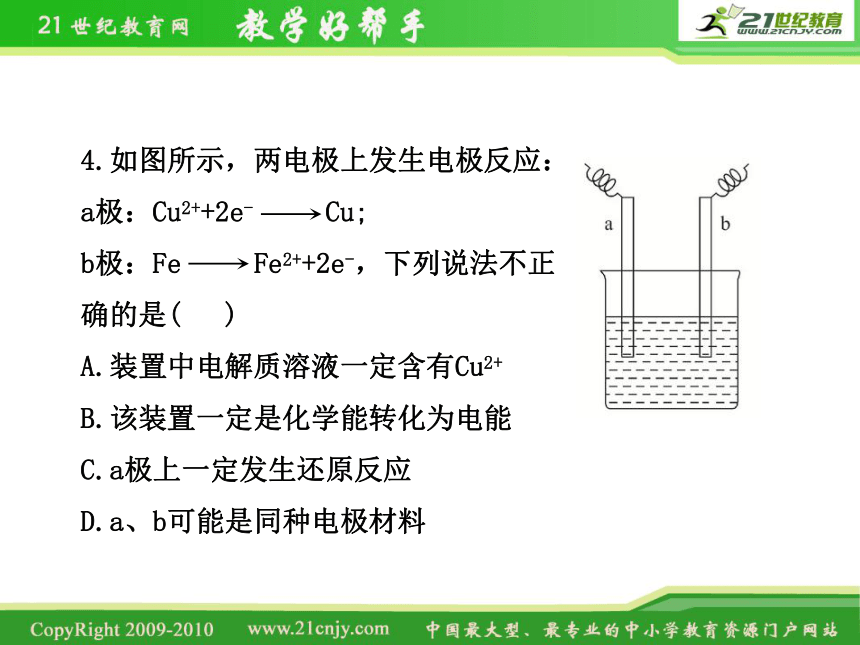
4.如图所示,两电极上发生电极反应:
a极:Cu2++2e- Cu;
b极:Fe Fe2++2e-,下列说法不正
确的是( )
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a极上一定发生还原反应
D.a、b可能是同种电极材料
【解析】选B。电解质溶液中含有Cu2+,才能发生反应
Cu2++2e- Cu,故A正确;该装置可以是原电池,也可
以是电解池,B错误;a极上发生还原反应,C正确;若
为电解池,则两电极均可用铁材料,D正确。
5.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是
( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
【解析】选C。A项和D项均会使测定结果偏高,B项无影响。
6.(2010·杭州高二检测)能正确表示下列反应的离子方程式是( )
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
====CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O====
CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:
HCO3-+Ca2++OH-====CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-====
3Fe3++NO↑+2H2O
【解析】选D。A选项CO2过量时,应该生成HCO3-,方程式应为:ClO-+CO2+H2O====HClO+HCO3-;B选项HClO可将CaSO3氧化为CaSO4,正确的方程式为:Ca2++ClO-+SO2+
H2O====CaSO4↓+Cl-+2H+;C选项要考虑到Mg(OH)2为沉淀即可, Mg2++2HCO3-+2Ca2++4OH-====Mg(OH)2↓+
2CaCO3↓+2H2O。
7.如图甲A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
A.此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
【解析】选D。据题意知ΔH=0,ΔS>0,根据ΔG=ΔH-TΔS=-TΔS<0,所以该过程的逆过程不能自发进行,所以D错误。
8.常温下,某溶液中由水电离出来的[H+]=1.0×
10-13 mol·L-1,该溶液可能是( )
①二氧化硫溶于水形成的溶液
②氯化铵水溶液
③硝酸钠水溶液
④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
【解析】选A。由水电离出来的[H+]=1.0×10-13 mol
·L-1,说明水的电离受到抑制,说明溶液既可能呈酸
性,也可能呈碱性。①SO2+H2O H2SO3,H2SO3
HSO3-+H+,HSO3- SO32-+H+,溶液呈酸性;④NaOH====
Na++OH-,溶液呈碱性。
9.一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达到平衡后,C的浓度仍为w mol/L
的是( )
A.4 mol A +2 mol B
B.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
C. 3 mol C+1 mol D +1 mol B
D.3 mol C+2 mol D
【解析】选B。根据题意:
所以,以3 mol C+1 mol D或以1 mol A+0.5 mol B
+1.5 mol C+0.5 mol D作为起始物质均可形成与反应1等效的平衡。
10.下图是可逆反应A+2B 2C+3D的化学反应速率与化
学平衡随外界条件改变(先降温后加压)而变化的情
况,由此可推断( )
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应
D.A、B、C、D均为气体
【解析】选B。通过观察上图可知,降温时平衡向正反应方向移动,故正反应为放热反应,A选项错;加压时平衡向正反应方向移动,故B正确。
11.下列说法中,正确的是( )
A.向饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH会增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+
Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水含有较多Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+、Mg2+
【解析】选C。温度升高,Ca(OH)2的溶解度降低,pH减小,A项错;B项平衡左移的原因是增大了Cl-的浓度,通过平衡移动能减弱这种改变而不会抵消,故该项错;D项只通过加热煮沸不能除去由SO42-引起的硬度,故D项错误。
12.已知在25 ℃,101 kPa下,拆开1 mol C—H中的化学键要吸收415 kJ的能量,拆开1 mol C—C中的化学键要吸收331 kJ的能量,拆开1 mol O2中的O=O键要吸收
498 kJ的能量,形成水分子中的1 mol H—O键要放出465 kJ的能量,形成二氧化碳分子中的1 mol C=O键要放出798 kJ的能量(丙烷燃烧过程中不考虑其他能量转化)。则下列说法正确的是( )
A.丙烷完全燃烧的热化学方程式为C3H8+5O2====3CO2+4H2O ΔH=-2 036 kJ/ mol
B.C3H8(g)+ 5O2(g)====3CO2(g)+ 4H2O(g)
ΔH<-2 036 kJ/mol
C.丙烷完全燃烧的热化学方程式为:
C3H8(g)+5O2(g)====3CO2(g)+4H2O(g)
ΔH=2 036 kJ/mol
D.丙烷燃烧的能量变化可用下图表示
【解析】选D。C3H8分子中含有两个C-C键,8个C—H键,
C3H8在燃烧过程中所有的化学键均要发生断裂,1 mol
C3H8吸收的热量=2×331 kJ+8×415 kJ=3 982 kJ,
5 mol O2吸收的热量=5×498 kJ=2490 kJ,生成的
mol CO2和4 mol H2O放出的热量=3×2×798 kJ+4×2
×465 kJ=8 508 kJ,故1 mol C3H8完全燃烧生成CO2和
H2O(g)放出热量=8 508 kJ-6 472 kJ=2 036 kJ,故
火炬中丙烷完全燃烧的热化学方程式为:
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=
-2 036 kJ/ mol。选项A,没有注明物质的状态错误。
选项C中ΔH忽视“-”错误。选项B,因H2O(l)
H2O(g)吸收热量,故生成H2O(g)放出更少的热量,
ΔH值越小,放出热量越多,故有ΔH>-2 036 kJ/ mol。
选项D,因C3H8(g)完全燃烧是放热反应,反应物的总
能量大于生成物的总能量,正确。
二、非选择题(本题包括4小题,共52分)
13. (14分)(1)室温下,如果将0.1 mol NH4Cl和
0.05 mol NaOH全部溶于水,形成混合溶液(假设无损失),
①______和____两种粒子的物质的量之和等于
0.1 mol。
②______和____两种粒子的物质的量之和比OH-多
0.05 mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[Cl-]>[NH4+]>[OH-]>[H+]
C.[Cl-]>[H+]>[NH4+]>[OH-]
D.[NH4+]>[Cl-]>[OH-]>[H+]
①若溶液中只溶解了一种溶质,该溶质的名称是_____,上述离子浓度大小顺序关系中正确的是(选填序号)___________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________。
③若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前[HCl]_____[NH3·H2O](填“>”、“<”或“=”,下同),混合后溶液中[NH4+]与[Cl-]的关系:[NH4+]________[Cl-]。
【解析】(1)二者溶于水后,要先发生NH4++OH-
NH3·H2O的反应,由物料守恒知,n(Cl-)=0.1 mol,
n(NH4+)+n(NH3·H2O)=0.1 mol;
由电荷守恒知[Na+]+[NH4+]+[H+]=[Cl-]+
[OH-],因[Cl-]=2[Na+]=0.1 mol,所以[NH4+]+[H+]-[OH-]=0.05 mol。
(2)①水能电离出H+和OH-,现在还有NH4+和Cl-,而要求只有一种溶质,故其只能为NH4Cl,考虑到NH4+的水解,能得出[Cl-]>[NH4+]>[H+]>[OH-]。
②由[H+]>[NH4+]可知H+是一种大量存在的离子,所以应该有HCl,NH4+的提供者只能是NH4Cl了。
③等物质的量的稀盐酸与氨水混合后,溶质为NH4Cl,其水解后呈酸性,现在要求为中性,故NH3·H2O应稍多一些,由电中性知[NH4+]+[H+]=[Cl-]+[OH-],现在[H+]=[OH-],所以[NH4+]=[Cl-]
答案:(1)①NH3·H2O NH4+
②NH4+ 4H+
(2)①氯化铵 A ②NH4Cl和HCl ③< =
14.(16分)(2010·镇江高二检测)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验1判断Cl-的存在________(填“一定存在”、“一定不存在”或“不能确定”);根据实验
1~3判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+是否存在?___________,判断的理由是___________。
【解析】本题非常成功的地方是将传统的离子共存和无机化合物的推断巧妙嫁接,解本题的关键是要根据实验结果初步推断出物质的存在可能性,最后用数据检验。该混合物加足量NaOH溶液并加热产生气体,说明存在NH4+,由1.12 L氨气可知,NH4+的物质的量为0.05 mol,在第三步操作中,沉淀有两种,说明存在SO42-和CO32-,则该混合物中不存在Ba2+,同时也不存在Mg2+。
(1)由于未知溶液分三组分别做实验,Cl-和SO42-都可以与AgNO3溶液产生白色沉淀,所以无法确定Cl-的存在;第三步操作中第二次称量的是BaSO4固体的质量,
说明原溶液中有SO42-,根据离子共存规律一定没有Ba2+;根据已知的离子可知,第一次称量的固体中还有BaCO3,说明原溶液中还有CO32-,而Mg2+与CO32-不能共存,所以一定没有Mg2+。
(2)根据第三步操作称得固体的质量,可求得:
n(BaSO4)=2.33÷233=0.01(mol),
n(BaCO3)=(6.27 g-2.33 g)÷197 g· mol-1=
0.02 mol。所以n(SO42-)=0.01 mol,[SO42-]=0.01
÷0.1=0.1 (mol·L-1);n(CO32-)=0.02 mol,
[CO32-]=0.02 mol÷0.1 L=0.2 mol·L-1。
(3)利用第二步操作可求得n(NH4+)=0.05 mol,[NH4+]=0.5 mol·L-1。
根据电荷守恒规律:2×[CO32-]+2×[SO42-]=0.6 mol
·L-1,而1×[NH4+]=0.5 mol·L-1,
所以必然还有阳离子,已知的还剩K+。故一定有K+。
答案:(1)不能确定 Ba2+、Mg2+
(2)
(3)存在 溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒,得K+一定存在
15.(9分)已知:在某温度下,存在可逆反应X(g)+Y(g)
2Z(g)。在该温度下,向容积为2 L的恒容密闭容器
中加入2 mol X和2 mol Y,在1 min时达到平衡,混合气
体中Z的体积分数[x(Z)]随时间(t)的变化曲线如图所
示,在2 min时再向此容器中加入2 mol Z,在3 min时反
应重新达到平衡至4 min。
求:
(1)该反应在前1 min内用X表示的平均速率为_____。
(2)该温度下的平衡常数为_____________。
(3)请在上图中将0~4 min的变化曲线图补充完整。(必须注明图中纵坐标的对应数值)
【解析】设第一次平衡时(即1 min时),有a mol的X转化为Z。
X(g)+Y(g) 2Z(g)
开始时:2 2 0
变化量:a a 2a
平衡时:2-a 2-a 2a
由于反应前后气体的分子数不变,所以加入2 mol Z重新达到平衡时,Z的体积分数与第一次平衡时相同,即为50%。
答案:(1)0.5 mol·L-1·min-1 (2)4
(3)见解析
16.(13分)(2010·长春高二检测)如图装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。
(1)试分析电源的正负极、CuSO4溶液的pH变化及CuSO4溶液中各离子浓度的变化情况。
(2)其中B装置为何要用U形管?
(3)若电源输出电子0.5 mol,求A中析出铜多少克,B中产生气体多少升?
【解析】此题是典型的电解装置,根据现象不难推断,
a、b为惰性电极,a附近溶液呈红色,即a附近溶液呈碱
性,析出H2,发生还原反应,是阴极,故电源X是负极,
Y是正极。在A装置中,铂极是阴极,铜极是阳极,阳极
是活性电极本身放电,阴极是Cu2+放电,电极反应为,
阳极:Cu Cu2++2e-(氧化反应),阴极:Cu2++2e-
Cu(还原反应),故A装置是典型的电镀装置,pH
无变化,各离子浓度也无变化。B用U形管是为了让H2和
Cl2分开,防止混合爆炸。电解方程式:
答案:(1)X是负极,Y是正极。pH无变化,各离子浓度也无变化。
(2)防止H2、Cl2接触爆炸。
(3)16 g,11.2 L
(1~3章)
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.化学反应中通常伴随着能量变化,下列说法中错误的是( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
【解析】选B。煤是重要的能源,燃烧时放出大量的热能,但这不是煤中的全部化学能,因为其主要燃烧产物CO2中仍有化学能,A项正确。电解物质时,是将电能转化为化学能,而不是化学能转化为电能,B项错误。TNT(三硝基甲苯)爆炸时,部分化学能转化成了动能,C项正确。镁条燃烧时放出大量热,产生耀眼的白光,故镁条的部分化学能转化成了光能,D项正确。
2.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生成铁锈
D.银质奖牌长期放置后在其奖牌的表面变暗
【解析】选D。A项黄铜(铜锌合金)若发生电化学腐蚀时,被腐蚀的金属应是金属性较活泼的锌而不是铜,B项生铁中含较多的碳,比软铁芯(几乎是纯铁)在电解质作用下更容易形成原电池,也更容易生锈。C项铁质器件附有铜配件时,在接触电解质溶液时,铁是原电池的负极,易被腐蚀生成铁锈。D项银质奖牌久置后可能与氧气或硫氧化成银的化合物而使其表面变暗,这是化学腐蚀,与电化学腐蚀无关。
3.(2010·黄冈高二检测)下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
【解析】选D。铁在浓硫酸中发生钝化,A选项不正确;盐酸跟锌片反应的实质是:Zn+2H+====Zn2++H2↑。加入适量的氯化钠溶液,氯化钠电离出的Na+、Cl-对化学平衡没有影响,但盐酸此时已被稀释了,H+浓度变小,反应速率应变慢,所以B选项也不正确;升高温度对任何反应来说,都将加快反应速率,C选项不正确。减小压强反应速率减慢,D选项正确。
4.如图所示,两电极上发生电极反应:
a极:Cu2++2e- Cu;
b极:Fe Fe2++2e-,下列说法不正
确的是( )
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a极上一定发生还原反应
D.a、b可能是同种电极材料
【解析】选B。电解质溶液中含有Cu2+,才能发生反应
Cu2++2e- Cu,故A正确;该装置可以是原电池,也可
以是电解池,B错误;a极上发生还原反应,C正确;若
为电解池,则两电极均可用铁材料,D正确。
5.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是
( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴定前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
【解析】选C。A项和D项均会使测定结果偏高,B项无影响。
6.(2010·杭州高二检测)能正确表示下列反应的离子方程式是( )
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
====CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O====
CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:
HCO3-+Ca2++OH-====CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-====
3Fe3++NO↑+2H2O
【解析】选D。A选项CO2过量时,应该生成HCO3-,方程式应为:ClO-+CO2+H2O====HClO+HCO3-;B选项HClO可将CaSO3氧化为CaSO4,正确的方程式为:Ca2++ClO-+SO2+
H2O====CaSO4↓+Cl-+2H+;C选项要考虑到Mg(OH)2为沉淀即可, Mg2++2HCO3-+2Ca2++4OH-====Mg(OH)2↓+
2CaCO3↓+2H2O。
7.如图甲A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
A.此过程为混乱程度小的向混乱程度大的方向的变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
【解析】选D。据题意知ΔH=0,ΔS>0,根据ΔG=ΔH-TΔS=-TΔS<0,所以该过程的逆过程不能自发进行,所以D错误。
8.常温下,某溶液中由水电离出来的[H+]=1.0×
10-13 mol·L-1,该溶液可能是( )
①二氧化硫溶于水形成的溶液
②氯化铵水溶液
③硝酸钠水溶液
④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
【解析】选A。由水电离出来的[H+]=1.0×10-13 mol
·L-1,说明水的电离受到抑制,说明溶液既可能呈酸
性,也可能呈碱性。①SO2+H2O H2SO3,H2SO3
HSO3-+H+,HSO3- SO32-+H+,溶液呈酸性;④NaOH====
Na++OH-,溶液呈碱性。
9.一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达到平衡后,C的浓度仍为w mol/L
的是( )
A.4 mol A +2 mol B
B.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
C. 3 mol C+1 mol D +1 mol B
D.3 mol C+2 mol D
【解析】选B。根据题意:
所以,以3 mol C+1 mol D或以1 mol A+0.5 mol B
+1.5 mol C+0.5 mol D作为起始物质均可形成与反应1等效的平衡。
10.下图是可逆反应A+2B 2C+3D的化学反应速率与化
学平衡随外界条件改变(先降温后加压)而变化的情
况,由此可推断( )
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应
D.A、B、C、D均为气体
【解析】选B。通过观察上图可知,降温时平衡向正反应方向移动,故正反应为放热反应,A选项错;加压时平衡向正反应方向移动,故B正确。
11.下列说法中,正确的是( )
A.向饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH会增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+
Cl-(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水含有较多Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+、Mg2+
【解析】选C。温度升高,Ca(OH)2的溶解度降低,pH减小,A项错;B项平衡左移的原因是增大了Cl-的浓度,通过平衡移动能减弱这种改变而不会抵消,故该项错;D项只通过加热煮沸不能除去由SO42-引起的硬度,故D项错误。
12.已知在25 ℃,101 kPa下,拆开1 mol C—H中的化学键要吸收415 kJ的能量,拆开1 mol C—C中的化学键要吸收331 kJ的能量,拆开1 mol O2中的O=O键要吸收
498 kJ的能量,形成水分子中的1 mol H—O键要放出465 kJ的能量,形成二氧化碳分子中的1 mol C=O键要放出798 kJ的能量(丙烷燃烧过程中不考虑其他能量转化)。则下列说法正确的是( )
A.丙烷完全燃烧的热化学方程式为C3H8+5O2====3CO2+4H2O ΔH=-2 036 kJ/ mol
B.C3H8(g)+ 5O2(g)====3CO2(g)+ 4H2O(g)
ΔH<-2 036 kJ/mol
C.丙烷完全燃烧的热化学方程式为:
C3H8(g)+5O2(g)====3CO2(g)+4H2O(g)
ΔH=2 036 kJ/mol
D.丙烷燃烧的能量变化可用下图表示
【解析】选D。C3H8分子中含有两个C-C键,8个C—H键,
C3H8在燃烧过程中所有的化学键均要发生断裂,1 mol
C3H8吸收的热量=2×331 kJ+8×415 kJ=3 982 kJ,
5 mol O2吸收的热量=5×498 kJ=2490 kJ,生成的
mol CO2和4 mol H2O放出的热量=3×2×798 kJ+4×2
×465 kJ=8 508 kJ,故1 mol C3H8完全燃烧生成CO2和
H2O(g)放出热量=8 508 kJ-6 472 kJ=2 036 kJ,故
火炬中丙烷完全燃烧的热化学方程式为:
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=
-2 036 kJ/ mol。选项A,没有注明物质的状态错误。
选项C中ΔH忽视“-”错误。选项B,因H2O(l)
H2O(g)吸收热量,故生成H2O(g)放出更少的热量,
ΔH值越小,放出热量越多,故有ΔH>-2 036 kJ/ mol。
选项D,因C3H8(g)完全燃烧是放热反应,反应物的总
能量大于生成物的总能量,正确。
二、非选择题(本题包括4小题,共52分)
13. (14分)(1)室温下,如果将0.1 mol NH4Cl和
0.05 mol NaOH全部溶于水,形成混合溶液(假设无损失),
①______和____两种粒子的物质的量之和等于
0.1 mol。
②______和____两种粒子的物质的量之和比OH-多
0.05 mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[Cl-]>[NH4+]>[OH-]>[H+]
C.[Cl-]>[H+]>[NH4+]>[OH-]
D.[NH4+]>[Cl-]>[OH-]>[H+]
①若溶液中只溶解了一种溶质,该溶质的名称是_____,上述离子浓度大小顺序关系中正确的是(选填序号)___________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________。
③若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前[HCl]_____[NH3·H2O](填“>”、“<”或“=”,下同),混合后溶液中[NH4+]与[Cl-]的关系:[NH4+]________[Cl-]。
【解析】(1)二者溶于水后,要先发生NH4++OH-
NH3·H2O的反应,由物料守恒知,n(Cl-)=0.1 mol,
n(NH4+)+n(NH3·H2O)=0.1 mol;
由电荷守恒知[Na+]+[NH4+]+[H+]=[Cl-]+
[OH-],因[Cl-]=2[Na+]=0.1 mol,所以[NH4+]+[H+]-[OH-]=0.05 mol。
(2)①水能电离出H+和OH-,现在还有NH4+和Cl-,而要求只有一种溶质,故其只能为NH4Cl,考虑到NH4+的水解,能得出[Cl-]>[NH4+]>[H+]>[OH-]。
②由[H+]>[NH4+]可知H+是一种大量存在的离子,所以应该有HCl,NH4+的提供者只能是NH4Cl了。
③等物质的量的稀盐酸与氨水混合后,溶质为NH4Cl,其水解后呈酸性,现在要求为中性,故NH3·H2O应稍多一些,由电中性知[NH4+]+[H+]=[Cl-]+[OH-],现在[H+]=[OH-],所以[NH4+]=[Cl-]
答案:(1)①NH3·H2O NH4+
②NH4+ 4H+
(2)①氯化铵 A ②NH4Cl和HCl ③< =
14.(16分)(2010·镇江高二检测)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验1判断Cl-的存在________(填“一定存在”、“一定不存在”或“不能确定”);根据实验
1~3判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+是否存在?___________,判断的理由是___________。
【解析】本题非常成功的地方是将传统的离子共存和无机化合物的推断巧妙嫁接,解本题的关键是要根据实验结果初步推断出物质的存在可能性,最后用数据检验。该混合物加足量NaOH溶液并加热产生气体,说明存在NH4+,由1.12 L氨气可知,NH4+的物质的量为0.05 mol,在第三步操作中,沉淀有两种,说明存在SO42-和CO32-,则该混合物中不存在Ba2+,同时也不存在Mg2+。
(1)由于未知溶液分三组分别做实验,Cl-和SO42-都可以与AgNO3溶液产生白色沉淀,所以无法确定Cl-的存在;第三步操作中第二次称量的是BaSO4固体的质量,
说明原溶液中有SO42-,根据离子共存规律一定没有Ba2+;根据已知的离子可知,第一次称量的固体中还有BaCO3,说明原溶液中还有CO32-,而Mg2+与CO32-不能共存,所以一定没有Mg2+。
(2)根据第三步操作称得固体的质量,可求得:
n(BaSO4)=2.33÷233=0.01(mol),
n(BaCO3)=(6.27 g-2.33 g)÷197 g· mol-1=
0.02 mol。所以n(SO42-)=0.01 mol,[SO42-]=0.01
÷0.1=0.1 (mol·L-1);n(CO32-)=0.02 mol,
[CO32-]=0.02 mol÷0.1 L=0.2 mol·L-1。
(3)利用第二步操作可求得n(NH4+)=0.05 mol,[NH4+]=0.5 mol·L-1。
根据电荷守恒规律:2×[CO32-]+2×[SO42-]=0.6 mol
·L-1,而1×[NH4+]=0.5 mol·L-1,
所以必然还有阳离子,已知的还剩K+。故一定有K+。
答案:(1)不能确定 Ba2+、Mg2+
(2)
(3)存在 溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质的量为0.05 mol,CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒,得K+一定存在
15.(9分)已知:在某温度下,存在可逆反应X(g)+Y(g)
2Z(g)。在该温度下,向容积为2 L的恒容密闭容器
中加入2 mol X和2 mol Y,在1 min时达到平衡,混合气
体中Z的体积分数[x(Z)]随时间(t)的变化曲线如图所
示,在2 min时再向此容器中加入2 mol Z,在3 min时反
应重新达到平衡至4 min。
求:
(1)该反应在前1 min内用X表示的平均速率为_____。
(2)该温度下的平衡常数为_____________。
(3)请在上图中将0~4 min的变化曲线图补充完整。(必须注明图中纵坐标的对应数值)
【解析】设第一次平衡时(即1 min时),有a mol的X转化为Z。
X(g)+Y(g) 2Z(g)
开始时:2 2 0
变化量:a a 2a
平衡时:2-a 2-a 2a
由于反应前后气体的分子数不变,所以加入2 mol Z重新达到平衡时,Z的体积分数与第一次平衡时相同,即为50%。
答案:(1)0.5 mol·L-1·min-1 (2)4
(3)见解析
16.(13分)(2010·长春高二检测)如图装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。
(1)试分析电源的正负极、CuSO4溶液的pH变化及CuSO4溶液中各离子浓度的变化情况。
(2)其中B装置为何要用U形管?
(3)若电源输出电子0.5 mol,求A中析出铜多少克,B中产生气体多少升?
【解析】此题是典型的电解装置,根据现象不难推断,
a、b为惰性电极,a附近溶液呈红色,即a附近溶液呈碱
性,析出H2,发生还原反应,是阴极,故电源X是负极,
Y是正极。在A装置中,铂极是阴极,铜极是阳极,阳极
是活性电极本身放电,阴极是Cu2+放电,电极反应为,
阳极:Cu Cu2++2e-(氧化反应),阴极:Cu2++2e-
Cu(还原反应),故A装置是典型的电镀装置,pH
无变化,各离子浓度也无变化。B用U形管是为了让H2和
Cl2分开,防止混合爆炸。电解方程式:
答案:(1)X是负极,Y是正极。pH无变化,各离子浓度也无变化。
(2)防止H2、Cl2接触爆炸。
(3)16 g,11.2 L
