10-11高中化学课时讲练通课件:阶段质量评估(一)(苏教版选修4)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:阶段质量评估(一)(苏教版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共62张PPT)
(专题1、2)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.(2010·合肥高二检测)下列说法,违反科学原理的是
( )
A.为了消除碘缺乏症,可以采用食盐加碘的方法
B.闪电时,空气中的N2发生的变化可称为氮的固定
C.干冰可用于人工降雨
D.在2SO2+O2 2SO3的反应中,使用催化剂可提高SO2的转化率
催化剂
△
【解析】选D。食盐中加入的碘元素被人体吸收后,可
参与甲状腺素的合成,从而消除碘缺乏症。氮的固定是
将游离态的氮(N2)转化为化合态氮的过程,闪电时发生
N2+O2 2NO的变化,属氮的固定。催化剂只能改变
达到平衡所需的时间,不能使化学平衡发生移动,不可
能提高反应物转化率。
放电
2.对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
【解析】选A。由题意知v正(O2)∶v逆(NO)=5∶4,达到平衡时,v正(NO)=v逆(NO),故A正确;生成NO和消耗NH3,都表示正反应速率,B错;扩大容器体积,各物质的浓度都减小,所以正、逆反应速率都减小,C错;在反应的任意状态总有v正(NH3)∶v正(H2O)=4∶6,即
3v正(NH3)=2v正(H2O),D不正确。
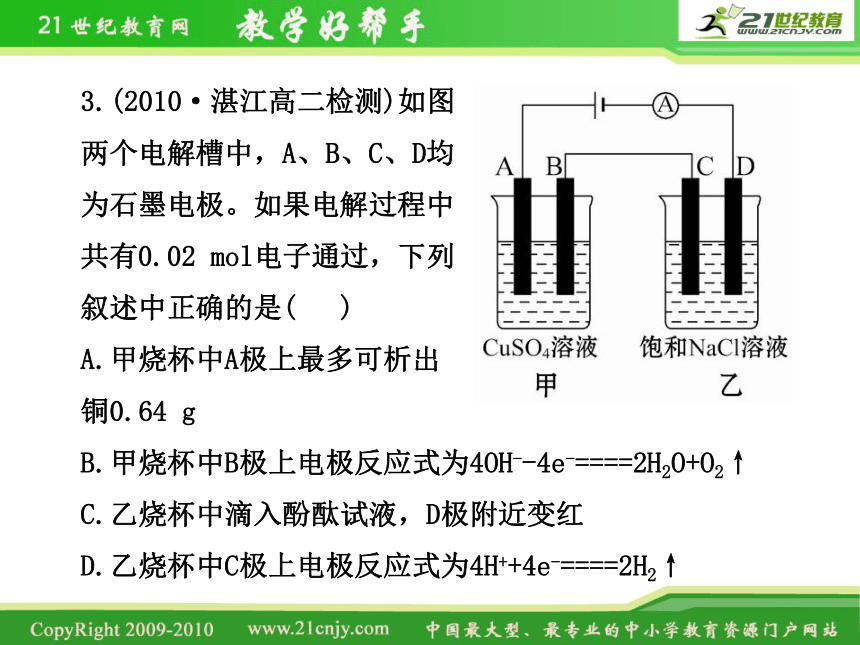
3.(2010·湛江高二检测)如图
两个电解槽中,A、B、C、D均
为石墨电极。如果电解过程中
共有0.02 mol电子通过,下列
叙述中正确的是( )
A.甲烧杯中A极上最多可析出
铜0.64 g
B.甲烧杯中B极上电极反应式为4OH--4e-====2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式为4H++4e-====2H2↑
【解析】选C。本题考查电解原理和计算。解题时应看清仪器的连接方式,判断准电极和电极反应。首先根据与电源正负极的连接判断出A、C为阳极,而B、D为阴极,甲电解池中,A极发生4OH--4e-====2H2O+O2↑,B极发生Cu2++2e-====Cu,而乙电解池中C极发生2Cl--2e-====Cl2↑,而D极发生2H++2e-====H2↑,从而破坏水的电离平衡产生大量OH-,使酚酞变红色。
4.对10 mL 1 mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl====CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.加入一定量的CaCl2固体
B.加入少量NaHSO4固体
C.加入15 mL 0.5 mol/L盐酸
D.加入5 mL NaCl水溶液
【解析】选B。该反应的离子方程式为CaCO3+2H+====Ca2++CO2↑+H2O,
A项,加入CaCl2固体,c(H+)不变,反应速率不变;
B项,NaHSO4====Na++H++SO42-,
使c(H+)增大,反应速率增大;
C项,加入低浓度盐酸,c(H+)减小,反应速率减小;
D项,相当于稀释,c(H+)减小,反应速率减小。
5.某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计。据此下列叙述正确的是( )
A.电流计指针不会发生偏转
B.铁钉会被腐蚀
C.碳棒作负极
D.铁钉表面有气体逸出
【解析】选B。该水果电池中,铁钉为负极,碳棒为正极,电流计指针会发生偏转,碳棒表面产生气泡,故选B。
6.下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s)
ΔH=-216 kJ·mol-1,
反应物总能量>生成物总能量
B.CaCO3(s)====CaO(s)+CO2(g)
ΔH=+178.5 kJ·mol-1,
反应物总能量>生成物总能量
C.101 kPa时,2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1,
H2的燃烧热为571.6 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l)
ΔH=-57.3 kJ·mol-1,
含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
【解析】选A。化学反应吸收热量还是放出热量,取决于反应物总能量和生成物总能量的相对大小,反应物总能量大于生成物总能量时反应放热,反应物总能量小于生成物总能量时反应吸热;某物质的燃烧热是指在101 kPa时,
1 mol该物质完全燃烧生成稳定的氧化物时所放出的热量;在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O时的反应热称为中和热,但浓硫酸稀释时要放出大量的热,所以D项中溶液混合后放出的热量大于57.3 kJ。
7.可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,混合气体平均式量不再改变
④保持其他条件不变时,体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6 mol/(L·min),逆反应速率v(NH3) = 0.4 mol/(L·min)
A.全部 B.只有①③④⑤
C.②③④⑤⑦ D.只有③⑤⑥⑦
【解析】选C。由题意可得,一个N≡N断裂的同时,一
定有3个H—H键断裂;一个N≡N键断裂的同时,就一定
有6个N—H键生成,而若同时有6个N—H键断裂,说明正
逆反应速率相等,是平衡状态;混合气体平均式量
,而m(总)是一个始终不变的量,其他条件
不变时,混合气体平均式量不再改变,说明n(总)不
再改变,那么,也就达到了平衡状态;由pV=nRT可知,
压强不变时,就说明物质的总量不再变化,也就达到了平衡状态;NH3%、N2%、H2%都不再改变也一定是平衡状态;恒温恒容时,气体的总质量始终不变,气体体积不变,其密度一定保持不变;正反应速率v(H2)=
0.6 mol/(L·min),逆反应速率v(NH3)=
0.4 mol/(L·min)也就是正逆反应速率相等的时候;所以选C。
8.(2010·福州高二检测)某温度下,可逆反应mA(g)+
nB(g) pC(g)的平衡常数为K,下列对K的说法正确的是( )
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
【解析】选A。A项,K值越大,表明反应正向进行的程
度越大,因此越有利于C的生成,反应的转化率越大;B
项,K只受温度的影响,与压强、浓度无关;C项,温度
越高,对于吸热反应,K值越大,对于放热反应,K值
越小;D项, 当m+n=p时,K不一定为1。
9.如图为电解饱和食盐水的简易装
置,下列有关说法正确的是( )
A.电解一段时间后,往蛋壳溶液中
滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
【解析】选D。由图可知,蛋壳表面的铁丝为阴极,发生反应:2H++2e-====H2↑,碳棒为阳极,发生反应:2Cl--2e-====Cl2↑,故往蛋壳溶液中滴加酚酞,溶液不会变红。铁丝为阴极,受到保护,附近H+发生还原反应,故选D。
10.(2010·石家庄高二检测)在A+B C(正反应是放热反应)的反应中,如图所示,能正确表示反应速率(纵坐标)与温度(横坐标)关系的是( )
【解析】选B。因为正反应是放热反应,升高温度,正、逆反应速率都增大,且平衡向吸热反应的方向移动,即向逆反应方向移动,所以v(逆)>v(正)。
11.(2010·湖州高二检测)对于Zn(s)+H2SO4(aq)====ZnSO4(aq)
+H2(g) ΔH<0的化学反应,下
列叙述不正确的是( )
A.反应过程中能量关系可用如图
表示
B.ΔH的值与反应方程式的化学计量数有关
C.若将该反应设计成原电池,则锌为负极
D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体为2 g
【解析】选D。此反应的ΔH<0,说明此反应是放热反应,因此反应物的总能量比生成物的总能量要高,故A选项正确;反应热与物质的量成正比,故B选项正确;在此反应中Zn失电子作还原剂,因此若构成原电池时应作原电池的负极,故C选项正确;32.5 g锌的物质的量为0.5 mol,因此在反应中生成0.5 mol H2,其质量为
1 g,故D选项错误。
12.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中,正确的是( )
A.燃料电池工作时,正极反应式为:
O2+2H2O+4e-====4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗112 mL O2(标准状况)时,b极周围会产生0.01 g H2
【解析】选B。本题考查原电池和电解池,由于以磷酸
为电解质,故电池的正极反应式为:O2+4H++4e-====
2H2O,A错;a电极与原电池正极相连,为电解池的阳
极,由于Br-还原性强于Cl-,因此Br-先放电,B对;电
解时,电子流动路径是:负极→阴极,阳极→正极,
电子不能从溶液中通过,C错;电池消耗112 mL O2(标
准状况)时,转移电子为 ,根
据电量守恒,b极产生氢气为0.01 mol,D错。
13.在t ℃下,某反应达到平衡,平衡常数
。恒容时,温度升高,NO的浓度减小。下列说法不正确的是( )
A.该反应的焓变为正值
B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小
D.该反应化学方程式为:
NO(g)+SO3(g) NO2(g)+SO2(g)
【解析】选C。由平衡常数表达式知反应方程式为:NO(g)+SO3(g) NO2(g)+SO2(g),温度升高时,c(NO)减小,知平衡右移,反应吸热,焓变为正值;压强增大时,c(NO2)增大,体系颜色加深;升高温度,正反应速率和逆反应速率都会增大。
14.(2010·厦门高二检测)H2和CO2在高温下发生反应:CO2(g)+H2(g) CO(g)+H2O(g)。如表是986 ℃时,在容积不变的密闭容器中进行反应的四组数据:
下列叙述中正确的是( )
①该温度下反应的平衡常数约为1.6 ②该反应的平衡常数与反应的起始浓度无关 ③增大CO2的起始浓度,可使CO2的转化率增大 ④从反应开始至达到平衡状态,混合气体的密度没有发生改变
A.②③ B.①②③
C.①②④ D.①③
【解析】选C。任取一组数据,根据平衡常数表达式可以得出该温度下反应的平衡常数约为1.6;对比第1、2组数据可知增大CO2的起始浓度,CO2的转化率降低;反应前后气体的质量和体积都没有发生变化,故混合气体密度不变。
15.T ℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,H2的体积分数与时间的关系如图(Ⅱ)所示。则下列结论正确的是( )
A.该反应的热化学方程式: N2(g)+ H2(g)====
NH3(g) ΔH=(a+b) kJ·mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)====
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
C.T1>T2,且正反应为吸热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
【解析】选B。由N2与H2生成NH3能量变化图可以看出
mol N2与 mol H2反应生成1 mol NH3(g)时放出能
量为(b-a) kJ,而生成1 mol NH3(l)时放出能量为
(c+b-a) kJ,故热化学方程式分别为 N2(g)+ H2(g)
====NH3(g)ΔH=-(b-a) kJ/mol
N2(g)+3H2(g)====2NH3(g) ΔH=2(a-c-b) kJ/mol;由
图像(Ⅱ)可以看出T1时先达平衡,故T1>T2,而高温时H2
的体积分数增多,故知正反应方向为放热反应;当升高
温度时,正逆反应速率均增大,但平衡左移,H2转化率
降低。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6小题,共55分)
16.(6分)有aA(g)+bB(g) cC(g)+dD(g)的平衡体系,在不同条件的反应混合物中A、B、C的体积分数与时间的关系如图所示。
(1)若图甲中m、n两曲线表示有无催化剂的情况,则表示_____无催化剂,______表示有催化剂。
(2)若图乙中两曲线表示不同温度下的情况,则T1
______T2(填“>”、“=”或“<”),正反应为____热反应。
(3)若丙中p1、p2两曲线表示不同压强下的情况,则p1______p2,且a+b______c+d(填“>”、“<”或“=”)。
【解析】(1)m线先达平衡,表示有催化剂,n线表示无催化剂。(2)T1线先达到平衡,故T1>T2,T1线时B的含量低,故正反应为吸热反应。(3)p2线先达到平衡,故p2>p1,p2时C的含量低,故正反应为气体体积增大的反应,即a+b答案:(1)n m (2)> 吸 (3)< <
17.(9分)新型高能钠硫电池以熔融的钠、硫为电极,以
钠离子导电的陶瓷为固体电解质。该电池放电时为原电
池,充电时为电解池,反应原理为:2Na+xS Na2Sx
(1)放电时S发生____反应,Na作____极。
(2)充电时Na所在电极与直流电源______极相连。
(3)充电时阳极反应为________;放电时负极反应为________。
(4)若此电池用作电源电解饱和NaCl溶液,当阳极产生
11.2 L(标准状况)气体时,消耗金属钠______g。
放电
充电
【解析】本题目已给出了总反应方程式:2Na+xS
Na2Sx,放电时,相当于原电池,充电时,相当于电解池,且充电时原电池负极与电源负极相连,原电池的正极与电源的正极相连。书写电极反应式时,应先根据化学方程式中元素化合价的变化来加以判断。
放电时,负极:2Na 2Na++2e-;
正极:xS+2e- Sx2-。
充电时,阳极:Sx2- xS+2e-;
阴极:2Na++2e- 2Na。
放电
充电
当用此电池电解饱和NaCl溶液时,阳极产生11.2 L气体
(Cl2),根据得失电子守恒:2Cl- Cl2↑+2e-知需失
去1 mol e-,则电池需转移1 mol e-。
转移2 mol e-时,需消耗46 g金属钠,转移1 mol e-,
需消耗23 g金属钠。
答案:(1)还原 负 (2)负 (3)Sx2- xS+2e-
2Na 2Na++2e- (4)23
18.(10分)到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ/mol,
E(H—H)=436 kJ/mol,E(Cl—Cl)=243 kJ/mol
则E(H—Cl)=_________;
(2)已知:
①Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ/mol;
②3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ/mol;
③Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ/mol。
请写出CO还原FeO的热化学方程式:_____________
___________________________________________;
(3)如图是N2和H2反应生成2 mol NH3过程中能量变化示意图,请计算每生成1 mol NH3放出热量为________。
【解析】(1)化学反应的过程为旧键断裂、新键形成的
过程。打破旧键需要吸收能量,而形成新键则要放出能
量,二者的差值即为化学反应的热效应(当然忽略以其
他形式损失的能量,如发光等)。即ΔH=
E(H—H)+E(Cl—Cl)-2E(H—Cl)=-185 kJ/mol,
代入数据即可求出E(H—Cl)=432 kJ/mol。
(2)本题考查盖斯定律的具体应用。可利用三个热化学
方程式间的加、减来完成。目标方程式为FeO(s)+CO(g)
====Fe(s)+CO2(g),故在运算中想法在方程式左边出现
FeO(s)+CO(g),右边出现Fe(s)+CO2(g),并消去目标方
程式中没有的物质,即用[①×3-(③×2+②)]÷6得到,对应的ΔH参与相应的计算可得热化学方程式如下:
FeO(s)+CO(g)====Fe(s)+CO2(g) ΔH=-11 kJ·mol-1。
(3)根据图示可知每生成2 mol NH3放出热量为92.2 kJ,
则生成1 mol NH3放出的热量为46.1 kJ。
答案:(1)432 kJ/mol
(2)FeO(s)+CO(g)====Fe(s)+CO2(g) ΔH=-11 kJ/mol
(3)46.1 kJ
19.(8分)(2009·全国卷Ⅰ)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为___________________;
③列式计算电极b上生成的气体在标准状况下的体积为________;
④电极c的质量变化是______________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液:__________;乙溶液:__________;
丙溶液:__________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
____________________________________________。
【解析】(1)①乙中c电极质量增加,则c处发生的反应
为:Cu2++2e-====Cu,即c处为阴极,由此可推出b为阳
极,a为阴极,M为负极,N为正极。丙中为K2SO4溶液,
相当于电解水,设电解的水的质量为x。由电解前后溶
质质量相等,有100 g×10.00%=(100 g-x)×10.47%,
得x=4.5 g,故为0.25 mol。由方程式2H2O
2H2↑+O2↑可知,电解2 mol H2O,转移4 mol电子,所
以整个反应中转移0.5 mol电子,而整个电路是串联
的,故每个烧杯中的电极上转移电子数是相等的。
电解
====
②甲中为NaOH溶液,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-====2H2O+O2↑。③转移0.5 mol电子,则生成O2为 ,标准状况下的体积为0.125 mol×22.4 L/mol=2.8 L。④Cu2++2e-====
Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2×64=
16(g)。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
答案:(1)①正 ②4OH--4e-====2H2O+O2↑
③2.8 L ④16
⑤pH增大 pH减小 pH几乎不变
(2)可以,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
20.(7分)(2010·烟台高二检测)如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线。
(1)氮气与氢气反应生成氨气的热化学反应方程式为_________________。
(2)b曲线表示的是__________________________。
(3)在同温同压下向密闭容器中通入1 mol N2(g)与
3 mol H2(g),达到平衡时放出的热量为Q1 kJ。Q1_____92.4 kJ(填“>”、“<”或“=”)。
(4)在同温同压下向密闭容器中通入0.5 mol N2(g)、1.5 mol H2(g)和1 mol NH3(g),达到平衡时放出的热量为Q2 kJ,则Q1______Q2(填“>”、“<”或“=”)。
【解析】根据图像反应物总能量与生成物总能量差为
92.4 kJ,反应物总能量高,生成物总能量低,说明反
应放热。a与b起始与最终能量没有变化,只有反应过
程中最高能量即活化能有变化,说明b曲线使用催化
剂。图像表示的是1 mol氮气与3 mol氢气完全反应生成
2 mol氨气放出92.4 kJ热量。在密闭容器中通入1 mol
氮气与3 mol氢气,该反应为可逆反应,不可能完全转
化为2 mol氨气,因此放出热量小于92.4 kJ。在相同条
件下通入0.5 mol N2、1.5 mol H2、1 mol NH3其平衡与
通入1 mol N2、3 mol H2为等效平衡,平衡时氨气量相等,已有1 mol NH3,这样反应生成NH3量少,所以放出的热量小。
答案:(1)N2(g)+3H2(g)====2NH3(g)
ΔH=-92.4 kJ·mol-1
(2)在使用催化剂条件下的反应
(3)< (4)>
21.(15分)向2 L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t0~15 s阶段n(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t3~t4阶段为使用催化剂。观察下图,回答以下问题:
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t2时引起平衡移动的条件是____________,
t5时引起平衡移动的条件是____________________。
(3)图乙中表示平衡混合物中,在这四个阶段中C的含量最高的一段时间是____________________________。
(4)该反应的化学方程式可以表示为:____________,正反应为______(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为____________。
【解析】(1)根据图甲v(C)=
=0.004 mol·L-1·s-1。
(2)分析图乙,t2时刻,v(正)突然增加,v(逆)逐渐增加,所以t2时刻增加了A 的量;t3~t4阶段使用了催化剂;由于四个阶段所改变的外界条件均不同,t4时刻改变的条件可能为压强或温度,改变温度时平衡一定会发生移动,而t4时刻平衡未发生移动,只是速率减小,所以t4时刻改变的条件是压强,且为降压;t5时刻正逆反应速率突然升高,改变条件为升温。
(3)图乙中t2~t3,t5~t6,v(正)>v(逆),其余时间段
v(正)=v(逆),所以C的含量最高的一段时间为t5~t6段。
(4)降压由于平衡不移动,所以此反应前后气体分子数
不变。由图甲可求出v(A)=
=0.006 mol·L-1·s-1,即 ,所以此反应的化
学方程式为3A(g) B(g)+2C(g);升高温度时,v(正)
>v(逆),平衡正向移动,所以正反应为吸热反应。
(5)由化学方程式可知,15 s时,B的物质的量增加了0.06 mol,所以开始时加入的B的物质的量为0.1 mol-0.06 mol=0.04 mol。
答案:(1)0.004 mol·L-1·s-1
(2)增加A的浓度 升高温度
(3)t5~t6 (4)3A(g) B(g)+2C(g) 吸热
(5)0.04 mol
(专题1、2)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.(2010·合肥高二检测)下列说法,违反科学原理的是
( )
A.为了消除碘缺乏症,可以采用食盐加碘的方法
B.闪电时,空气中的N2发生的变化可称为氮的固定
C.干冰可用于人工降雨
D.在2SO2+O2 2SO3的反应中,使用催化剂可提高SO2的转化率
催化剂
△
【解析】选D。食盐中加入的碘元素被人体吸收后,可
参与甲状腺素的合成,从而消除碘缺乏症。氮的固定是
将游离态的氮(N2)转化为化合态氮的过程,闪电时发生
N2+O2 2NO的变化,属氮的固定。催化剂只能改变
达到平衡所需的时间,不能使化学平衡发生移动,不可
能提高反应物转化率。
放电
2.对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
【解析】选A。由题意知v正(O2)∶v逆(NO)=5∶4,达到平衡时,v正(NO)=v逆(NO),故A正确;生成NO和消耗NH3,都表示正反应速率,B错;扩大容器体积,各物质的浓度都减小,所以正、逆反应速率都减小,C错;在反应的任意状态总有v正(NH3)∶v正(H2O)=4∶6,即
3v正(NH3)=2v正(H2O),D不正确。
3.(2010·湛江高二检测)如图
两个电解槽中,A、B、C、D均
为石墨电极。如果电解过程中
共有0.02 mol电子通过,下列
叙述中正确的是( )
A.甲烧杯中A极上最多可析出
铜0.64 g
B.甲烧杯中B极上电极反应式为4OH--4e-====2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式为4H++4e-====2H2↑
【解析】选C。本题考查电解原理和计算。解题时应看清仪器的连接方式,判断准电极和电极反应。首先根据与电源正负极的连接判断出A、C为阳极,而B、D为阴极,甲电解池中,A极发生4OH--4e-====2H2O+O2↑,B极发生Cu2++2e-====Cu,而乙电解池中C极发生2Cl--2e-====Cl2↑,而D极发生2H++2e-====H2↑,从而破坏水的电离平衡产生大量OH-,使酚酞变红色。
4.对10 mL 1 mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl====CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.加入一定量的CaCl2固体
B.加入少量NaHSO4固体
C.加入15 mL 0.5 mol/L盐酸
D.加入5 mL NaCl水溶液
【解析】选B。该反应的离子方程式为CaCO3+2H+====Ca2++CO2↑+H2O,
A项,加入CaCl2固体,c(H+)不变,反应速率不变;
B项,NaHSO4====Na++H++SO42-,
使c(H+)增大,反应速率增大;
C项,加入低浓度盐酸,c(H+)减小,反应速率减小;
D项,相当于稀释,c(H+)减小,反应速率减小。
5.某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计。据此下列叙述正确的是( )
A.电流计指针不会发生偏转
B.铁钉会被腐蚀
C.碳棒作负极
D.铁钉表面有气体逸出
【解析】选B。该水果电池中,铁钉为负极,碳棒为正极,电流计指针会发生偏转,碳棒表面产生气泡,故选B。
6.下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s)
ΔH=-216 kJ·mol-1,
反应物总能量>生成物总能量
B.CaCO3(s)====CaO(s)+CO2(g)
ΔH=+178.5 kJ·mol-1,
反应物总能量>生成物总能量
C.101 kPa时,2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1,
H2的燃烧热为571.6 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l)
ΔH=-57.3 kJ·mol-1,
含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
【解析】选A。化学反应吸收热量还是放出热量,取决于反应物总能量和生成物总能量的相对大小,反应物总能量大于生成物总能量时反应放热,反应物总能量小于生成物总能量时反应吸热;某物质的燃烧热是指在101 kPa时,
1 mol该物质完全燃烧生成稳定的氧化物时所放出的热量;在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O时的反应热称为中和热,但浓硫酸稀释时要放出大量的热,所以D项中溶液混合后放出的热量大于57.3 kJ。
7.可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,混合气体平均式量不再改变
④保持其他条件不变时,体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6 mol/(L·min),逆反应速率v(NH3) = 0.4 mol/(L·min)
A.全部 B.只有①③④⑤
C.②③④⑤⑦ D.只有③⑤⑥⑦
【解析】选C。由题意可得,一个N≡N断裂的同时,一
定有3个H—H键断裂;一个N≡N键断裂的同时,就一定
有6个N—H键生成,而若同时有6个N—H键断裂,说明正
逆反应速率相等,是平衡状态;混合气体平均式量
,而m(总)是一个始终不变的量,其他条件
不变时,混合气体平均式量不再改变,说明n(总)不
再改变,那么,也就达到了平衡状态;由pV=nRT可知,
压强不变时,就说明物质的总量不再变化,也就达到了平衡状态;NH3%、N2%、H2%都不再改变也一定是平衡状态;恒温恒容时,气体的总质量始终不变,气体体积不变,其密度一定保持不变;正反应速率v(H2)=
0.6 mol/(L·min),逆反应速率v(NH3)=
0.4 mol/(L·min)也就是正逆反应速率相等的时候;所以选C。
8.(2010·福州高二检测)某温度下,可逆反应mA(g)+
nB(g) pC(g)的平衡常数为K,下列对K的说法正确的是( )
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
【解析】选A。A项,K值越大,表明反应正向进行的程
度越大,因此越有利于C的生成,反应的转化率越大;B
项,K只受温度的影响,与压强、浓度无关;C项,温度
越高,对于吸热反应,K值越大,对于放热反应,K值
越小;D项, 当m+n=p时,K不一定为1。
9.如图为电解饱和食盐水的简易装
置,下列有关说法正确的是( )
A.电解一段时间后,往蛋壳溶液中
滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
【解析】选D。由图可知,蛋壳表面的铁丝为阴极,发生反应:2H++2e-====H2↑,碳棒为阳极,发生反应:2Cl--2e-====Cl2↑,故往蛋壳溶液中滴加酚酞,溶液不会变红。铁丝为阴极,受到保护,附近H+发生还原反应,故选D。
10.(2010·石家庄高二检测)在A+B C(正反应是放热反应)的反应中,如图所示,能正确表示反应速率(纵坐标)与温度(横坐标)关系的是( )
【解析】选B。因为正反应是放热反应,升高温度,正、逆反应速率都增大,且平衡向吸热反应的方向移动,即向逆反应方向移动,所以v(逆)>v(正)。
11.(2010·湖州高二检测)对于Zn(s)+H2SO4(aq)====ZnSO4(aq)
+H2(g) ΔH<0的化学反应,下
列叙述不正确的是( )
A.反应过程中能量关系可用如图
表示
B.ΔH的值与反应方程式的化学计量数有关
C.若将该反应设计成原电池,则锌为负极
D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体为2 g
【解析】选D。此反应的ΔH<0,说明此反应是放热反应,因此反应物的总能量比生成物的总能量要高,故A选项正确;反应热与物质的量成正比,故B选项正确;在此反应中Zn失电子作还原剂,因此若构成原电池时应作原电池的负极,故C选项正确;32.5 g锌的物质的量为0.5 mol,因此在反应中生成0.5 mol H2,其质量为
1 g,故D选项错误。
12.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中,正确的是( )
A.燃料电池工作时,正极反应式为:
O2+2H2O+4e-====4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗112 mL O2(标准状况)时,b极周围会产生0.01 g H2
【解析】选B。本题考查原电池和电解池,由于以磷酸
为电解质,故电池的正极反应式为:O2+4H++4e-====
2H2O,A错;a电极与原电池正极相连,为电解池的阳
极,由于Br-还原性强于Cl-,因此Br-先放电,B对;电
解时,电子流动路径是:负极→阴极,阳极→正极,
电子不能从溶液中通过,C错;电池消耗112 mL O2(标
准状况)时,转移电子为 ,根
据电量守恒,b极产生氢气为0.01 mol,D错。
13.在t ℃下,某反应达到平衡,平衡常数
。恒容时,温度升高,NO的浓度减小。下列说法不正确的是( )
A.该反应的焓变为正值
B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小
D.该反应化学方程式为:
NO(g)+SO3(g) NO2(g)+SO2(g)
【解析】选C。由平衡常数表达式知反应方程式为:NO(g)+SO3(g) NO2(g)+SO2(g),温度升高时,c(NO)减小,知平衡右移,反应吸热,焓变为正值;压强增大时,c(NO2)增大,体系颜色加深;升高温度,正反应速率和逆反应速率都会增大。
14.(2010·厦门高二检测)H2和CO2在高温下发生反应:CO2(g)+H2(g) CO(g)+H2O(g)。如表是986 ℃时,在容积不变的密闭容器中进行反应的四组数据:
下列叙述中正确的是( )
①该温度下反应的平衡常数约为1.6 ②该反应的平衡常数与反应的起始浓度无关 ③增大CO2的起始浓度,可使CO2的转化率增大 ④从反应开始至达到平衡状态,混合气体的密度没有发生改变
A.②③ B.①②③
C.①②④ D.①③
【解析】选C。任取一组数据,根据平衡常数表达式可以得出该温度下反应的平衡常数约为1.6;对比第1、2组数据可知增大CO2的起始浓度,CO2的转化率降低;反应前后气体的质量和体积都没有发生变化,故混合气体密度不变。
15.T ℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,H2的体积分数与时间的关系如图(Ⅱ)所示。则下列结论正确的是( )
A.该反应的热化学方程式: N2(g)+ H2(g)====
NH3(g) ΔH=(a+b) kJ·mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)====
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
C.T1>T2,且正反应为吸热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
【解析】选B。由N2与H2生成NH3能量变化图可以看出
mol N2与 mol H2反应生成1 mol NH3(g)时放出能
量为(b-a) kJ,而生成1 mol NH3(l)时放出能量为
(c+b-a) kJ,故热化学方程式分别为 N2(g)+ H2(g)
====NH3(g)ΔH=-(b-a) kJ/mol
N2(g)+3H2(g)====2NH3(g) ΔH=2(a-c-b) kJ/mol;由
图像(Ⅱ)可以看出T1时先达平衡,故T1>T2,而高温时H2
的体积分数增多,故知正反应方向为放热反应;当升高
温度时,正逆反应速率均增大,但平衡左移,H2转化率
降低。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6小题,共55分)
16.(6分)有aA(g)+bB(g) cC(g)+dD(g)的平衡体系,在不同条件的反应混合物中A、B、C的体积分数与时间的关系如图所示。
(1)若图甲中m、n两曲线表示有无催化剂的情况,则表示_____无催化剂,______表示有催化剂。
(2)若图乙中两曲线表示不同温度下的情况,则T1
______T2(填“>”、“=”或“<”),正反应为____热反应。
(3)若丙中p1、p2两曲线表示不同压强下的情况,则p1______p2,且a+b______c+d(填“>”、“<”或“=”)。
【解析】(1)m线先达平衡,表示有催化剂,n线表示无催化剂。(2)T1线先达到平衡,故T1>T2,T1线时B的含量低,故正反应为吸热反应。(3)p2线先达到平衡,故p2>p1,p2时C的含量低,故正反应为气体体积增大的反应,即a+b
17.(9分)新型高能钠硫电池以熔融的钠、硫为电极,以
钠离子导电的陶瓷为固体电解质。该电池放电时为原电
池,充电时为电解池,反应原理为:2Na+xS Na2Sx
(1)放电时S发生____反应,Na作____极。
(2)充电时Na所在电极与直流电源______极相连。
(3)充电时阳极反应为________;放电时负极反应为________。
(4)若此电池用作电源电解饱和NaCl溶液,当阳极产生
11.2 L(标准状况)气体时,消耗金属钠______g。
放电
充电
【解析】本题目已给出了总反应方程式:2Na+xS
Na2Sx,放电时,相当于原电池,充电时,相当于电解池,且充电时原电池负极与电源负极相连,原电池的正极与电源的正极相连。书写电极反应式时,应先根据化学方程式中元素化合价的变化来加以判断。
放电时,负极:2Na 2Na++2e-;
正极:xS+2e- Sx2-。
充电时,阳极:Sx2- xS+2e-;
阴极:2Na++2e- 2Na。
放电
充电
当用此电池电解饱和NaCl溶液时,阳极产生11.2 L气体
(Cl2),根据得失电子守恒:2Cl- Cl2↑+2e-知需失
去1 mol e-,则电池需转移1 mol e-。
转移2 mol e-时,需消耗46 g金属钠,转移1 mol e-,
需消耗23 g金属钠。
答案:(1)还原 负 (2)负 (3)Sx2- xS+2e-
2Na 2Na++2e- (4)23
18.(10分)到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ/mol,
E(H—H)=436 kJ/mol,E(Cl—Cl)=243 kJ/mol
则E(H—Cl)=_________;
(2)已知:
①Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ/mol;
②3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ/mol;
③Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ/mol。
请写出CO还原FeO的热化学方程式:_____________
___________________________________________;
(3)如图是N2和H2反应生成2 mol NH3过程中能量变化示意图,请计算每生成1 mol NH3放出热量为________。
【解析】(1)化学反应的过程为旧键断裂、新键形成的
过程。打破旧键需要吸收能量,而形成新键则要放出能
量,二者的差值即为化学反应的热效应(当然忽略以其
他形式损失的能量,如发光等)。即ΔH=
E(H—H)+E(Cl—Cl)-2E(H—Cl)=-185 kJ/mol,
代入数据即可求出E(H—Cl)=432 kJ/mol。
(2)本题考查盖斯定律的具体应用。可利用三个热化学
方程式间的加、减来完成。目标方程式为FeO(s)+CO(g)
====Fe(s)+CO2(g),故在运算中想法在方程式左边出现
FeO(s)+CO(g),右边出现Fe(s)+CO2(g),并消去目标方
程式中没有的物质,即用[①×3-(③×2+②)]÷6得到,对应的ΔH参与相应的计算可得热化学方程式如下:
FeO(s)+CO(g)====Fe(s)+CO2(g) ΔH=-11 kJ·mol-1。
(3)根据图示可知每生成2 mol NH3放出热量为92.2 kJ,
则生成1 mol NH3放出的热量为46.1 kJ。
答案:(1)432 kJ/mol
(2)FeO(s)+CO(g)====Fe(s)+CO2(g) ΔH=-11 kJ/mol
(3)46.1 kJ
19.(8分)(2009·全国卷Ⅰ)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为___________________;
③列式计算电极b上生成的气体在标准状况下的体积为________;
④电极c的质量变化是______________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液:__________;乙溶液:__________;
丙溶液:__________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
____________________________________________。
【解析】(1)①乙中c电极质量增加,则c处发生的反应
为:Cu2++2e-====Cu,即c处为阴极,由此可推出b为阳
极,a为阴极,M为负极,N为正极。丙中为K2SO4溶液,
相当于电解水,设电解的水的质量为x。由电解前后溶
质质量相等,有100 g×10.00%=(100 g-x)×10.47%,
得x=4.5 g,故为0.25 mol。由方程式2H2O
2H2↑+O2↑可知,电解2 mol H2O,转移4 mol电子,所
以整个反应中转移0.5 mol电子,而整个电路是串联
的,故每个烧杯中的电极上转移电子数是相等的。
电解
====
②甲中为NaOH溶液,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-====2H2O+O2↑。③转移0.5 mol电子,则生成O2为 ,标准状况下的体积为0.125 mol×22.4 L/mol=2.8 L。④Cu2++2e-====
Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2×64=
16(g)。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
答案:(1)①正 ②4OH--4e-====2H2O+O2↑
③2.8 L ④16
⑤pH增大 pH减小 pH几乎不变
(2)可以,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
20.(7分)(2010·烟台高二检测)如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线。
(1)氮气与氢气反应生成氨气的热化学反应方程式为_________________。
(2)b曲线表示的是__________________________。
(3)在同温同压下向密闭容器中通入1 mol N2(g)与
3 mol H2(g),达到平衡时放出的热量为Q1 kJ。Q1_____92.4 kJ(填“>”、“<”或“=”)。
(4)在同温同压下向密闭容器中通入0.5 mol N2(g)、1.5 mol H2(g)和1 mol NH3(g),达到平衡时放出的热量为Q2 kJ,则Q1______Q2(填“>”、“<”或“=”)。
【解析】根据图像反应物总能量与生成物总能量差为
92.4 kJ,反应物总能量高,生成物总能量低,说明反
应放热。a与b起始与最终能量没有变化,只有反应过
程中最高能量即活化能有变化,说明b曲线使用催化
剂。图像表示的是1 mol氮气与3 mol氢气完全反应生成
2 mol氨气放出92.4 kJ热量。在密闭容器中通入1 mol
氮气与3 mol氢气,该反应为可逆反应,不可能完全转
化为2 mol氨气,因此放出热量小于92.4 kJ。在相同条
件下通入0.5 mol N2、1.5 mol H2、1 mol NH3其平衡与
通入1 mol N2、3 mol H2为等效平衡,平衡时氨气量相等,已有1 mol NH3,这样反应生成NH3量少,所以放出的热量小。
答案:(1)N2(g)+3H2(g)====2NH3(g)
ΔH=-92.4 kJ·mol-1
(2)在使用催化剂条件下的反应
(3)< (4)>
21.(15分)向2 L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t0~15 s阶段n(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t3~t4阶段为使用催化剂。观察下图,回答以下问题:
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t2时引起平衡移动的条件是____________,
t5时引起平衡移动的条件是____________________。
(3)图乙中表示平衡混合物中,在这四个阶段中C的含量最高的一段时间是____________________________。
(4)该反应的化学方程式可以表示为:____________,正反应为______(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为____________。
【解析】(1)根据图甲v(C)=
=0.004 mol·L-1·s-1。
(2)分析图乙,t2时刻,v(正)突然增加,v(逆)逐渐增加,所以t2时刻增加了A 的量;t3~t4阶段使用了催化剂;由于四个阶段所改变的外界条件均不同,t4时刻改变的条件可能为压强或温度,改变温度时平衡一定会发生移动,而t4时刻平衡未发生移动,只是速率减小,所以t4时刻改变的条件是压强,且为降压;t5时刻正逆反应速率突然升高,改变条件为升温。
(3)图乙中t2~t3,t5~t6,v(正)>v(逆),其余时间段
v(正)=v(逆),所以C的含量最高的一段时间为t5~t6段。
(4)降压由于平衡不移动,所以此反应前后气体分子数
不变。由图甲可求出v(A)=
=0.006 mol·L-1·s-1,即 ,所以此反应的化
学方程式为3A(g) B(g)+2C(g);升高温度时,v(正)
>v(逆),平衡正向移动,所以正反应为吸热反应。
(5)由化学方程式可知,15 s时,B的物质的量增加了0.06 mol,所以开始时加入的B的物质的量为0.1 mol-0.06 mol=0.04 mol。
答案:(1)0.004 mol·L-1·s-1
(2)增加A的浓度 升高温度
(3)t5~t6 (4)3A(g) B(g)+2C(g) 吸热
(5)0.04 mol
