2011年10月海南省中学化学课堂教学评比:白沙中学黄燕翔《醇》(第二课时)教学设计
文档属性
| 名称 | 2011年10月海南省中学化学课堂教学评比:白沙中学黄燕翔《醇》(第二课时)教学设计 |  | |
| 格式 | rar | ||
| 文件大小 | 76.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 19:22:38 | ||
图片预览




文档简介
(共16张PPT)
醇类(第二课时)
——乙醇的化学性质
白沙中学 黄燕翔
一、乙醇的分子结构
结构简式:
官能团结构特点:
官能团:
CH3CH2—OH或C2H5—OH
—OH,称为羟基
C—O键、O—H键易发生断裂
二、乙醇的化学性质
1、与活泼金属的反应
反应机理:
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
醇类反应的通式:
钠把—OH上的H置换出来
2ROH+2Na → 2RONa+H2↑
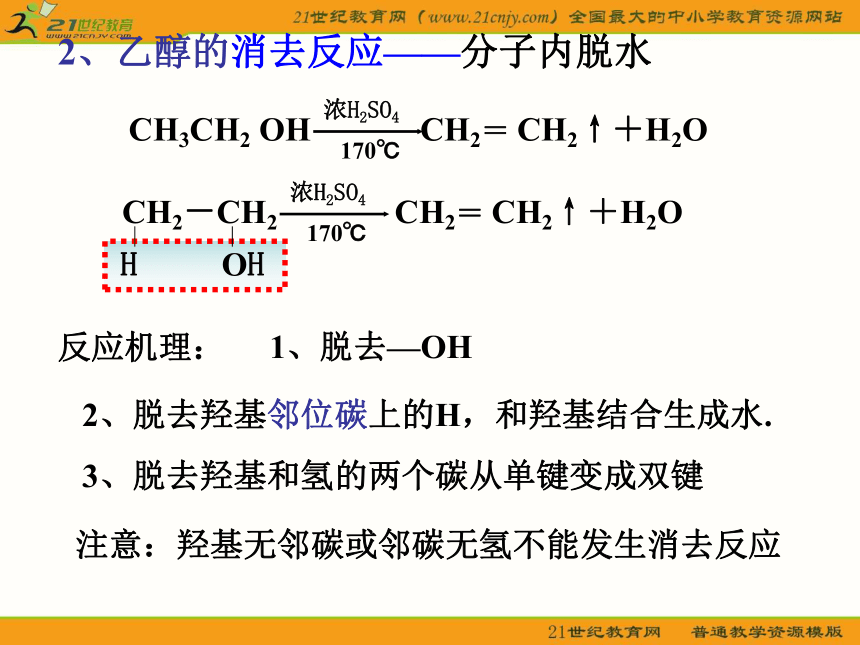
CH2-CH2 CH2= CH2↑+H2O
浓H2SO4
H OH
170℃
2、乙醇的消去反应——分子内脱水
反应机理:
2、脱去羟基邻位碳上的H,和羟基结合生成水.
3、脱去羟基和氢的两个碳从单键变成双键
1、脱去—OH
CH3CH2 OH CH2= CH2↑+H2O
浓H2SO4
170℃
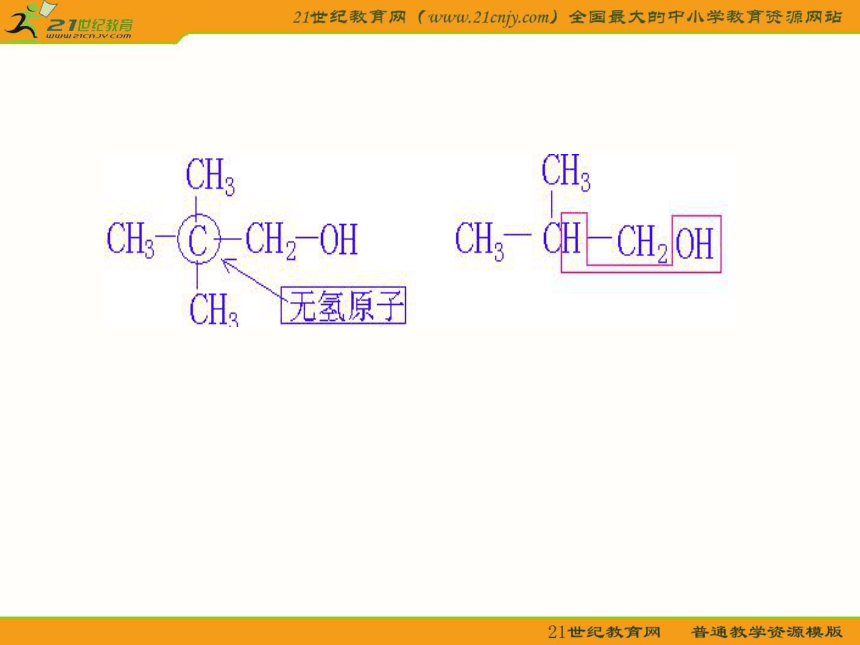
注意:羟基无邻碳或邻碳无氢不能发生消去反应
3、乙醇分子间脱水
注意:
①醇分子间脱水得到醚,可以是相同的醇也可以是不相同的醇。
②170℃是分子内脱水, 140℃是分子间脱水
——取代反应
C2H5OH+HO-C2H5 C2H5-O-C2H5+H2O
140℃
浓H2SO4
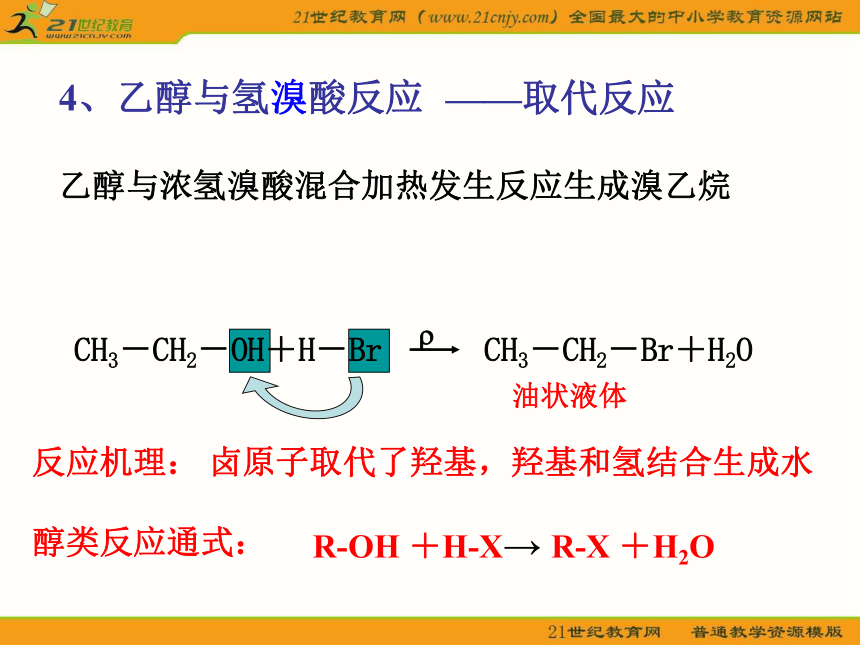
4、乙醇与氢溴酸反应
CH3-CH2-OH+H-Br CH3-CH2-Br+H2O
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应机理:
醇类反应通式:
卤原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
——取代反应
5、乙醇的氧化反应
(1) 燃烧
CH3CH2OH+3O2 2 CO2+3 H2O
点燃
(2) 催化氧化
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu/Ag
(脱去两个氢)
2CH3-CH-O + O2 2CH3-C-H+2H2O
Cu/Ag
H H
O
5、乙醇的氧化反应
(2) 催化氧化
乙醛
反应机理:
1、脱去羟基上的氢
3、碳氧从单键变成双键
2、脱去与羟基相连碳上的一个氢,氢与氧结合生成水
注意:与羟基相连的碳上无氢不能发生催化氧化
是否酒后驾车的判断方法
5、乙醇的氧化反应
(3)被强氧化剂氧化
如酸性高锰酸钾或酸性重铬酸钾
乙醇在人体内的转化:
C2H5OH→ CH3CHO → CH3COOH →CO2和H2O
饮酒对人体一定有害吗?
少量饮酒,能增加唾液、胃液分泌,帮助消化;能扩张血管、舒筋活血、祛风散寒、消除疲劳;还能延缓动脉硬化,预防部分心血管病。
过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力。
长期过量饮酒,会使人发胖,还会损伤肝脏;血液中高浓度的乙醛还能致癌,并容易导致心血管病急性发作。
有机物的氧化、还原反应
氧化反应:
还原反应:
加氧、脱氢
加氢、脱氧
H H
| |
H— C — C — O — H
| |
H H
①处断裂——与活泼金属发生置换反应,放出H2
①
③
④
②
①③处断裂——脱氢氧化,生成C=O双键(醛或酮)
②④处断裂——消去反应,生成C=C双键(烯烃)
②处断裂——与HX发生取代反应,生成卤代烃
小结
乙醇结构和化学性质的关系:
几种常见有机物之间的相互转换
CH2=CH2 CH3CH2OH CH3CHO CH3COOH
CH3CH2Br
醇类(第二课时)
——乙醇的化学性质
白沙中学 黄燕翔
一、乙醇的分子结构
结构简式:
官能团结构特点:
官能团:
CH3CH2—OH或C2H5—OH
—OH,称为羟基
C—O键、O—H键易发生断裂
二、乙醇的化学性质
1、与活泼金属的反应
反应机理:
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
醇类反应的通式:
钠把—OH上的H置换出来
2ROH+2Na → 2RONa+H2↑
CH2-CH2 CH2= CH2↑+H2O
浓H2SO4
H OH
170℃
2、乙醇的消去反应——分子内脱水
反应机理:
2、脱去羟基邻位碳上的H,和羟基结合生成水.
3、脱去羟基和氢的两个碳从单键变成双键
1、脱去—OH
CH3CH2 OH CH2= CH2↑+H2O
浓H2SO4
170℃
注意:羟基无邻碳或邻碳无氢不能发生消去反应
3、乙醇分子间脱水
注意:
①醇分子间脱水得到醚,可以是相同的醇也可以是不相同的醇。
②170℃是分子内脱水, 140℃是分子间脱水
——取代反应
C2H5OH+HO-C2H5 C2H5-O-C2H5+H2O
140℃
浓H2SO4
4、乙醇与氢溴酸反应
CH3-CH2-OH+H-Br CH3-CH2-Br+H2O
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应机理:
醇类反应通式:
卤原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
——取代反应
5、乙醇的氧化反应
(1) 燃烧
CH3CH2OH+3O2 2 CO2+3 H2O
点燃
(2) 催化氧化
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu/Ag
(脱去两个氢)
2CH3-CH-O + O2 2CH3-C-H+2H2O
Cu/Ag
H H
O
5、乙醇的氧化反应
(2) 催化氧化
乙醛
反应机理:
1、脱去羟基上的氢
3、碳氧从单键变成双键
2、脱去与羟基相连碳上的一个氢,氢与氧结合生成水
注意:与羟基相连的碳上无氢不能发生催化氧化
是否酒后驾车的判断方法
5、乙醇的氧化反应
(3)被强氧化剂氧化
如酸性高锰酸钾或酸性重铬酸钾
乙醇在人体内的转化:
C2H5OH→ CH3CHO → CH3COOH →CO2和H2O
饮酒对人体一定有害吗?
少量饮酒,能增加唾液、胃液分泌,帮助消化;能扩张血管、舒筋活血、祛风散寒、消除疲劳;还能延缓动脉硬化,预防部分心血管病。
过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力。
长期过量饮酒,会使人发胖,还会损伤肝脏;血液中高浓度的乙醛还能致癌,并容易导致心血管病急性发作。
有机物的氧化、还原反应
氧化反应:
还原反应:
加氧、脱氢
加氢、脱氧
H H
| |
H— C — C — O — H
| |
H H
①处断裂——与活泼金属发生置换反应,放出H2
①
③
④
②
①③处断裂——脱氢氧化,生成C=O双键(醛或酮)
②④处断裂——消去反应,生成C=C双键(烯烃)
②处断裂——与HX发生取代反应,生成卤代烃
小结
乙醇结构和化学性质的关系:
几种常见有机物之间的相互转换
CH2=CH2 CH3CH2OH CH3CHO CH3COOH
CH3CH2Br
