2011年10月海南省中学化学课堂教学评比:昌江矿区中学段华清选修四《原电池》课件
文档属性
| 名称 | 2011年10月海南省中学化学课堂教学评比:昌江矿区中学段华清选修四《原电池》课件 |  | |
| 格式 | rar | ||
| 文件大小 | 296.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 19:22:38 | ||
图片预览






文档简介
(共20张PPT)
选修4 第四章 电化学基础
第一节 原电池
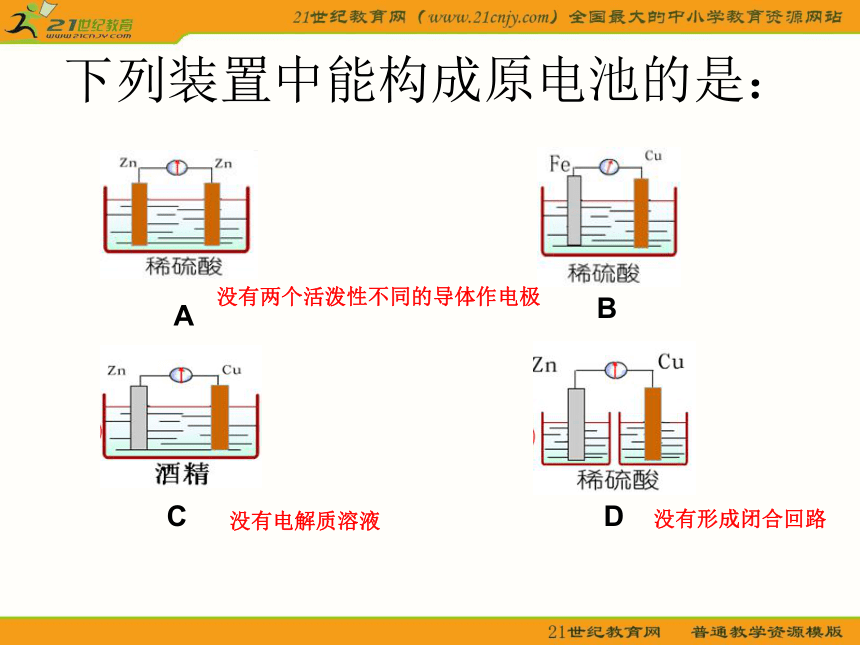
下列装置中能构成原电池的是:
A
B
C
D
没有两个活泼性不同的导体作电极
没有电解质溶液
没有形成闭合回路
1.能自发进行氧化还原反应
2.两个活泼性不同的导体作电极
3.有电解质溶液
4.形成闭合回路
原电池的构成条件:
实验探究㈠
请根据反应:Zn + CuSO4 = ZnSO4 + Cu
设计一个原电池。
正极 负极 装置图
电解质溶液
电极材料
电极反应
预测实验现象
锌片
Zn-2e-=Zn2+
铜片
Cu2++2e-=Cu
电流表
锌片腐蚀,不断溶解
铜片上有红色物质析出
电流表指针发生偏转
实际实验现象
锌片被红色物质覆盖
电流表读数不断减小
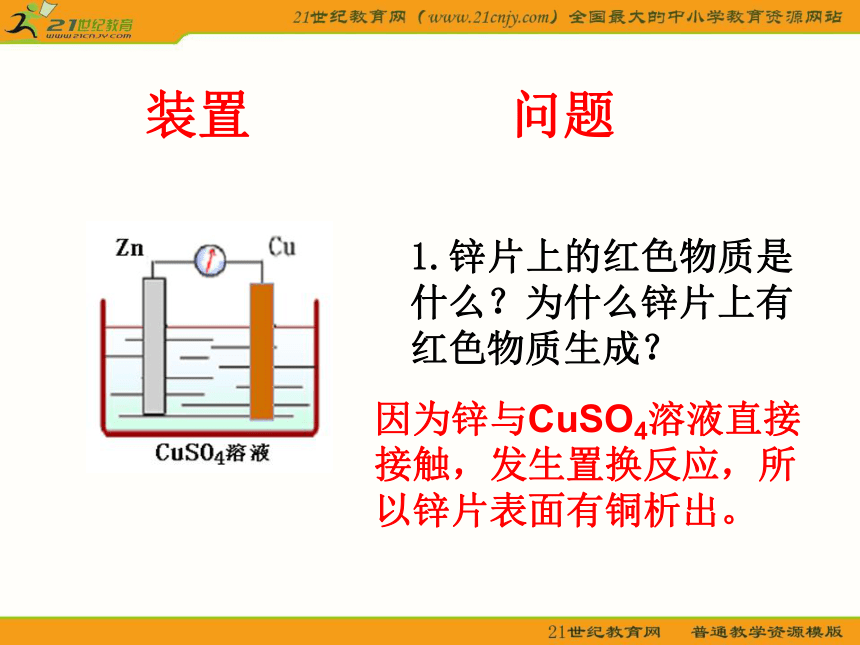
装置
问题
1.锌片上的红色物质是什么?为什么锌片上有红色物质生成?
因为锌与CuSO4溶液直接接触,发生置换反应,所以锌片表面有铜析出。
装置
问题
2.为什么电流表读数不断减小?
因为铜在锌表面析出后,与CuSO4溶液一起形成
了原电池,产生的电流并没有经过电流表,所以电
流表的读数不断减小。当锌片表面完全被铜覆盖后,相当于两个电极都是铜,已不能发生原电池反应,所以最后没有电流产生。
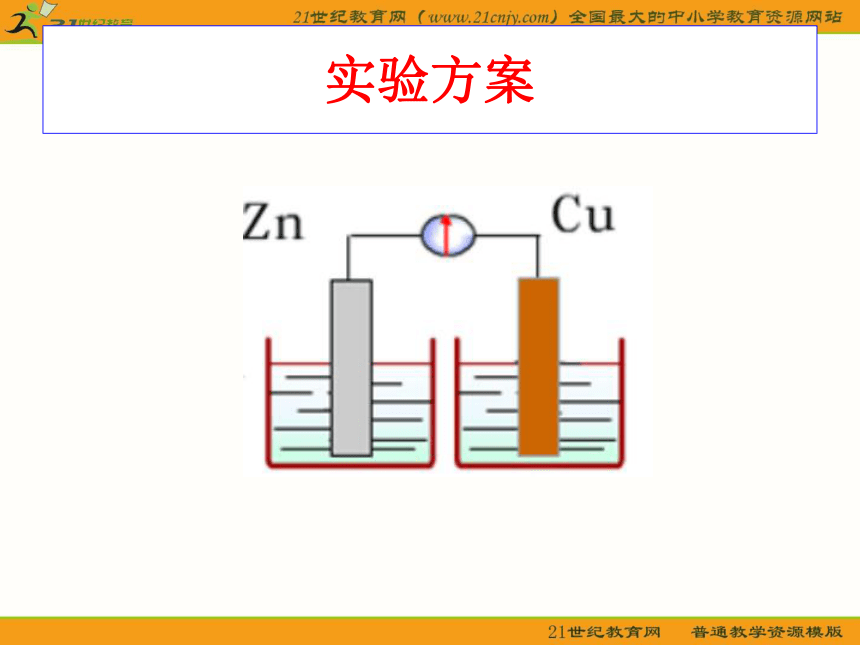
小组交流讨论
如何才能获得稳定的电流?
实验方案
实验探究㈡
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个能产生持续、稳定电流的原电池,并进行实验。
实验装置构成及实验现象
正极 负极 装置图
电极材料
电解质溶液
连通两烧杯溶液的材料
电流表读数是否稳定
1.外电路中电子从锌片→铜片
原电池的工作原理
e- → e- →
←Cl-
K+→
2.内电路中
阴离子→锌片
阳离子→铜片
电极反应式书写
写出两极反应式及总反应式:
盐桥的作用
1.勾通内电路
2.平衡电荷
电池大PK
比
南孚
其他品牌
南孚电池为什么这么牛?
原因:南孚电池有“聚能环”,装置设计合理。
1、装置设计的合理性
2、组成原电池的反应物的氧化还原能力。
影响原电池输出电能能力的因素:
本堂小结
⒈原电池的功能:
⒉原电池的工作原理:
⒊原电池输出电能的能力:
本堂小结
⒈原电池的功能:将化学能转化为电能
⒉原电池的工作原理:
①用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,通过阴阳离子的定向移动而形成内电路。
⒊原电池输出电能的能力,取决于
①装置设计的合理性;
②组成原电池的反应物的氧化还原能力。
根据反应:Cu+2AgNO3=Cu(NO3)2+2Ag
设计一个带盐桥的原电池。
⑴画出此原电池的装置简图;
⑵注明原电池的正负极;
⑶注明外电路中电子的流向;
⑷写出两个电极上的电极反应式。
练 习
选修4 第四章 电化学基础
第一节 原电池
下列装置中能构成原电池的是:
A
B
C
D
没有两个活泼性不同的导体作电极
没有电解质溶液
没有形成闭合回路
1.能自发进行氧化还原反应
2.两个活泼性不同的导体作电极
3.有电解质溶液
4.形成闭合回路
原电池的构成条件:
实验探究㈠
请根据反应:Zn + CuSO4 = ZnSO4 + Cu
设计一个原电池。
正极 负极 装置图
电解质溶液
电极材料
电极反应
预测实验现象
锌片
Zn-2e-=Zn2+
铜片
Cu2++2e-=Cu
电流表
锌片腐蚀,不断溶解
铜片上有红色物质析出
电流表指针发生偏转
实际实验现象
锌片被红色物质覆盖
电流表读数不断减小
装置
问题
1.锌片上的红色物质是什么?为什么锌片上有红色物质生成?
因为锌与CuSO4溶液直接接触,发生置换反应,所以锌片表面有铜析出。
装置
问题
2.为什么电流表读数不断减小?
因为铜在锌表面析出后,与CuSO4溶液一起形成
了原电池,产生的电流并没有经过电流表,所以电
流表的读数不断减小。当锌片表面完全被铜覆盖后,相当于两个电极都是铜,已不能发生原电池反应,所以最后没有电流产生。
小组交流讨论
如何才能获得稳定的电流?
实验方案
实验探究㈡
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个能产生持续、稳定电流的原电池,并进行实验。
实验装置构成及实验现象
正极 负极 装置图
电极材料
电解质溶液
连通两烧杯溶液的材料
电流表读数是否稳定
1.外电路中电子从锌片→铜片
原电池的工作原理
e- → e- →
←Cl-
K+→
2.内电路中
阴离子→锌片
阳离子→铜片
电极反应式书写
写出两极反应式及总反应式:
盐桥的作用
1.勾通内电路
2.平衡电荷
电池大PK
比
南孚
其他品牌
南孚电池为什么这么牛?
原因:南孚电池有“聚能环”,装置设计合理。
1、装置设计的合理性
2、组成原电池的反应物的氧化还原能力。
影响原电池输出电能能力的因素:
本堂小结
⒈原电池的功能:
⒉原电池的工作原理:
⒊原电池输出电能的能力:
本堂小结
⒈原电池的功能:将化学能转化为电能
⒉原电池的工作原理:
①用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,通过阴阳离子的定向移动而形成内电路。
⒊原电池输出电能的能力,取决于
①装置设计的合理性;
②组成原电池的反应物的氧化还原能力。
根据反应:Cu+2AgNO3=Cu(NO3)2+2Ag
设计一个带盐桥的原电池。
⑴画出此原电池的装置简图;
⑵注明原电池的正负极;
⑶注明外电路中电子的流向;
⑷写出两个电极上的电极反应式。
练 习
