2011年10月海南省中学化学课堂教学评比:海师附中张勋《原子结构》课件
文档属性
| 名称 | 2011年10月海南省中学化学课堂教学评比:海师附中张勋《原子结构》课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
选修-3 第一章
第一节 原子结构
海师附中 张勋
根据构造原理写出1~36号元素原子的电子排布式;
1.知识与能力
教学目标
2.过程与方法
利用图、表等资料,借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。 鼓励与他人进行交流和讨 论,逐步形成良好的学习习惯和学习方法。
3.情感态度与价值观
从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
大千世界无所不有
导入新课
一 原子的诞生
二 能层与能级
三 构造原理与电子排布式
第一课时
1. 化学变化中最小的微粒是什么?
2. 原子能否再分呢?原子如何构成?
3. 原子核的构成如何?
宇宙大爆炸促使氢、氦原子合成其它原子!
一、原子的诞生
原子结构理论模型发展史:
1805年 道尔顿的原子模型
——微小的、不可再分的实心球体。
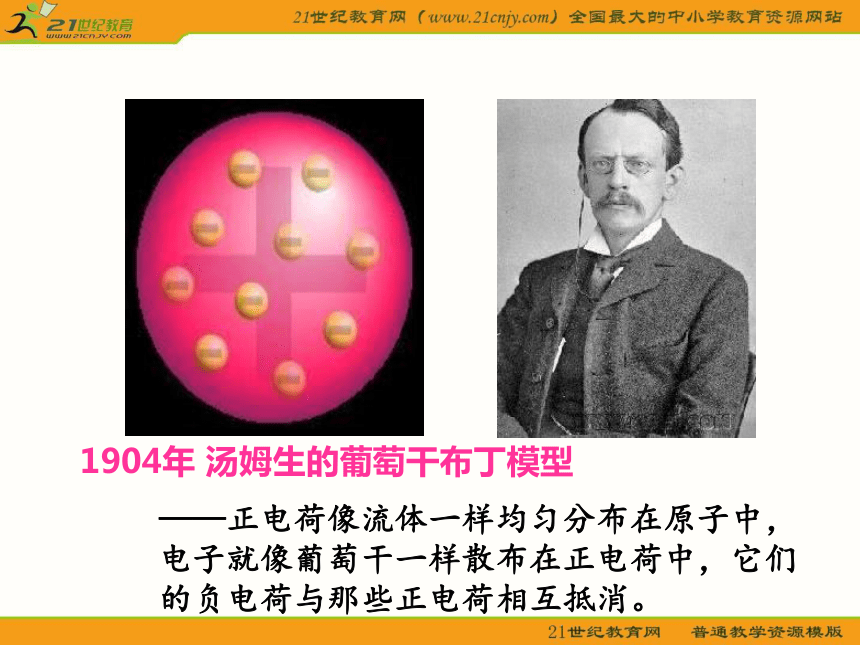
1904年 汤姆生的葡萄干布丁模型
——正电荷像流体一样均匀分布在原子中,电子就像葡萄干一样散布在正电荷中,它们的负电荷与那些正电荷相互抵消。
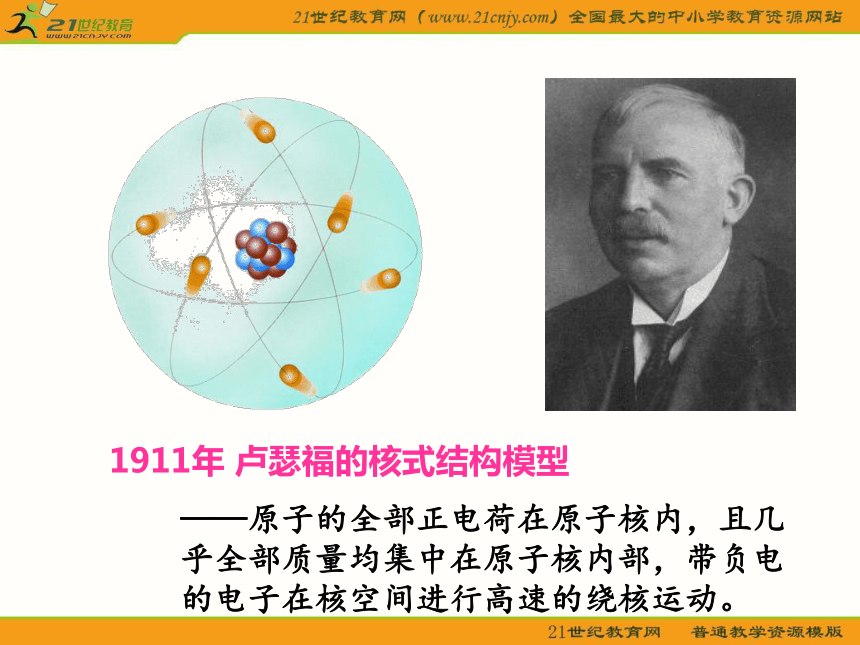
1911年 卢瑟福的核式结构模型
——原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部,带负电的电子在核空间进行高速的绕核运动。
二 能层与能级
能层是将核外电子按电子能量差异分成的
能层 一 二 三 四 五 六 七 、、、
符号 K L M N O P Q 、、、
容纳最多电子数 2 8 18 32 50 、、、 、、、 、、、
每一能层容纳最多电子数
小结:每一能层能容纳的最多电子数为2n2(n为能层 序数)。
能级与最多容纳电子数
在同一能层中,能量也可能不同,又可以把它们分为不同能级
一 二 三 四 五
“4f8”的含义:
表示第4能层f能级上排布8个电子
1、每一个能层所包含能级的个数与能层的
序数有什么样的关系?
2、每一个能层所包含能级从哪个能级开始
的?依次是什么能级?
3、s、p、d、f… 能级所容纳最多电子数分别是
多少?
4、 “4f 8”的含义是什么?
问题思考:
小结
1、每一能层中所含能级个数与能层序数n相等
2、每一能层中的能级都从S能级开始依次ns、np、
nd、nf…
3、同一能层中Ens<Enp<End<Enf
4、s、p、d、f…各能级最多可容纳的电子数依次为
1、3、5、7…的二倍
5、不同能层中符号相同的能级最多容纳的电子数相同
(1)各电子层最多能容纳2n2个电子。
即:电子层序号 1 2 3 4 5 6 7
代表符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(2)最外层电子数目不超过8个(K层为最外层时
不超过2个);次外层电子数最多不超过18
个;倒数第三层不超过32个。
原子核外电子排布规律:
(3)核外电子总是尽先排满能量最低、离核最近
的电子层,然后才由里往外,依次排在能量
较高电子层。而失电子总是先失最外层电子。
注意:
以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。
课堂练习
根据核外电子排布规律,写出16S 、18Ar 、19K、26Fe的原子结构示意图
答案:
+16
2
8
6
16S
+18
2
8
8
18Ar
+19
1
2
8
8
19K
+26
2
2
8
14
26Fe
三 构造原理与电子排布式
随着原子核数的增加,绝大多数元素的核外电子的排布将遵循右图的排布顺序,称为构造原理。
部分元素原子的电子排布式
按照构造原理,写出16S、26Fe的电子排布式,并预测它们的化合价。
答案: 16S:1s22s22p63s23p4 ,可能的化合价为+6价、+4价、-2价等。
26Fe:1s22s22p63s23p63d64s2
可能的化合价为+2价
课堂练习
选修-3 第一章
第一节 原子结构
海师附中 张勋
根据构造原理写出1~36号元素原子的电子排布式;
1.知识与能力
教学目标
2.过程与方法
利用图、表等资料,借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。 鼓励与他人进行交流和讨 论,逐步形成良好的学习习惯和学习方法。
3.情感态度与价值观
从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
大千世界无所不有
导入新课
一 原子的诞生
二 能层与能级
三 构造原理与电子排布式
第一课时
1. 化学变化中最小的微粒是什么?
2. 原子能否再分呢?原子如何构成?
3. 原子核的构成如何?
宇宙大爆炸促使氢、氦原子合成其它原子!
一、原子的诞生
原子结构理论模型发展史:
1805年 道尔顿的原子模型
——微小的、不可再分的实心球体。
1904年 汤姆生的葡萄干布丁模型
——正电荷像流体一样均匀分布在原子中,电子就像葡萄干一样散布在正电荷中,它们的负电荷与那些正电荷相互抵消。
1911年 卢瑟福的核式结构模型
——原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部,带负电的电子在核空间进行高速的绕核运动。
二 能层与能级
能层是将核外电子按电子能量差异分成的
能层 一 二 三 四 五 六 七 、、、
符号 K L M N O P Q 、、、
容纳最多电子数 2 8 18 32 50 、、、 、、、 、、、
每一能层容纳最多电子数
小结:每一能层能容纳的最多电子数为2n2(n为能层 序数)。
能级与最多容纳电子数
在同一能层中,能量也可能不同,又可以把它们分为不同能级
一 二 三 四 五
“4f8”的含义:
表示第4能层f能级上排布8个电子
1、每一个能层所包含能级的个数与能层的
序数有什么样的关系?
2、每一个能层所包含能级从哪个能级开始
的?依次是什么能级?
3、s、p、d、f… 能级所容纳最多电子数分别是
多少?
4、 “4f 8”的含义是什么?
问题思考:
小结
1、每一能层中所含能级个数与能层序数n相等
2、每一能层中的能级都从S能级开始依次ns、np、
nd、nf…
3、同一能层中Ens<Enp<End<Enf
4、s、p、d、f…各能级最多可容纳的电子数依次为
1、3、5、7…的二倍
5、不同能层中符号相同的能级最多容纳的电子数相同
(1)各电子层最多能容纳2n2个电子。
即:电子层序号 1 2 3 4 5 6 7
代表符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(2)最外层电子数目不超过8个(K层为最外层时
不超过2个);次外层电子数最多不超过18
个;倒数第三层不超过32个。
原子核外电子排布规律:
(3)核外电子总是尽先排满能量最低、离核最近
的电子层,然后才由里往外,依次排在能量
较高电子层。而失电子总是先失最外层电子。
注意:
以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。
课堂练习
根据核外电子排布规律,写出16S 、18Ar 、19K、26Fe的原子结构示意图
答案:
+16
2
8
6
16S
+18
2
8
8
18Ar
+19
1
2
8
8
19K
+26
2
2
8
14
26Fe
三 构造原理与电子排布式
随着原子核数的增加,绝大多数元素的核外电子的排布将遵循右图的排布顺序,称为构造原理。
部分元素原子的电子排布式
按照构造原理,写出16S、26Fe的电子排布式,并预测它们的化合价。
答案: 16S:1s22s22p63s23p4 ,可能的化合价为+6价、+4价、-2价等。
26Fe:1s22s22p63s23p63d64s2
可能的化合价为+2价
课堂练习
