2011版初中化学新课标金榜学案配套课件:单元评价检测二(鲁教版九年级全一册)(五四制)
文档属性
| 名称 | 2011版初中化学新课标金榜学案配套课件:单元评价检测二(鲁教版九年级全一册)(五四制) |  | |
| 格式 | rar | ||
| 文件大小 | 449.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 19:40:29 | ||
图片预览











文档简介
(共44张PPT)
第二单元 海水中的化学
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 O-16
Na-23 Cl-35.5
一、选择题(本题包括10个小题,
每小题3分,共30分)
1.下列过程发生化学变化的是( )
①海水晒盐 ②海水制碱
③海水淡化 ④海水制镁
A.全部 B.只有②
C.只有②④ D.②③④
【解析】选C。海水制碱产生了新物质碳酸钠,海水制镁产生了新物质镁。
2.鱼胆弄破后会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水的物质,使鱼肉变苦,要清除这种苦味,可用下列何种溶液冲洗最为适宜( )
A.食盐水 B.醋酸
C.纯碱溶液 D.烧碱溶液
【解析】选C。由题意可知,要清除这种苦味,应该加入一种碱性物质,食盐水显中性,A错误;醋酸显酸性,B错误;纯碱溶液显碱性,C正确;烧碱溶液虽然显碱性,但具有很强的腐蚀性,不符合题意,本题应选C。
3.下列各组物质的名称、俗称、化学式表示同一种物质的是( )
A.氢氧化钠、纯碱、Na2CO3
B.消石灰、生石灰、Ca(OH)2
C.碳酸钠、苏打、Na2CO3
D.硫酸铜晶体、胆矾、CuSO4
【解析】选C。A中俗称应为烧碱,化学式应为NaOH;B中俗称应为消石灰,名称应为氢氧化钙;D中化学式应为CuSO4·5H2O;C正确。
4.在20 ℃时,往50 g硝酸钾溶液中加入5 g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶解,稍加热后,晶体全部溶解,下列说法正确的是( )
A.搅拌后加热前一定是饱和溶液
B.搅拌后加热前一定是不饱和溶液
C.加热后一定是饱和溶液
D.加热后一定是不饱和溶液
【解析】选A。搅拌后加热前由于溶液中含有未溶解的晶体,因此是饱和溶液;加热后晶体全部溶解,不能表明能否再溶解溶质晶体,故加热后所形成的溶液无法确定是否饱和。
5.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是( )
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
【解析】选B。NaOH能与CO2反应,但无明显现象,NaOH与Na2CO3溶液不反应,A不符合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不符合题意。
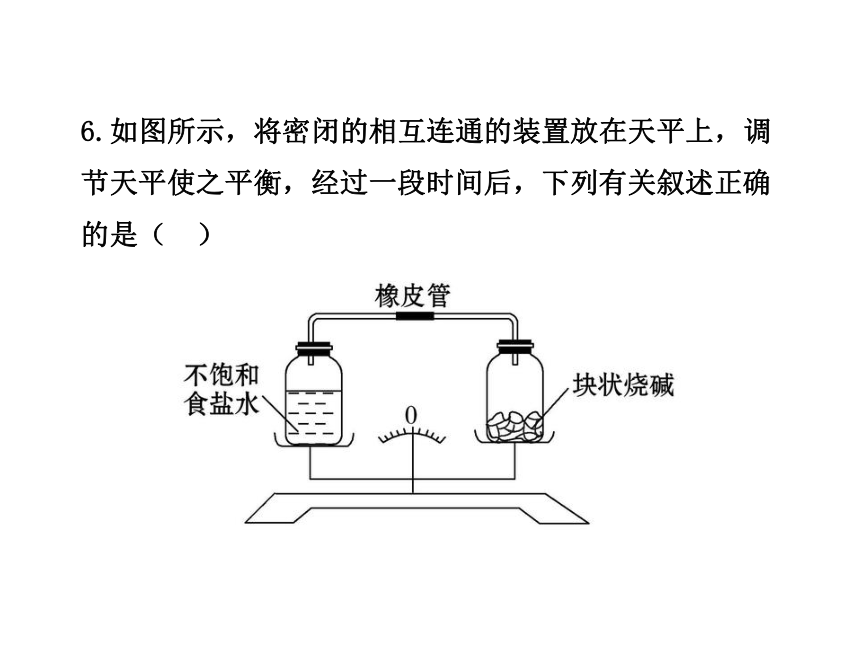
6.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡,经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀
B.指针偏右,食盐溶液一定饱和
C.指针偏左,食盐溶液一定变浓
D.指针偏右,食盐溶液一定变浓
【解析】选D。块状烧碱能吸收水分,故水分会通过连通器从左盘跑向右盘,指针一定是偏右,但烧碱吸收水的能力是有限的,左盘的食盐水不一定变饱和,但肯定变浓。
7.滴有酚酞的氢氧化钙溶液与下列物质恰好完全反应后仍显红色的是( )
A.稀硫酸 B.氯化铜溶液
C.碳酸钾溶液 D.二氧化碳
【解析】选C。氢氧化钙溶液分别与稀硫酸、氯化铜溶液、二氧化碳恰好完全反应时,溶液均为中性,因此溶液应显无色,氢氧化钙溶液与碳酸钾溶液恰好完全反应时,由于生成了氢氧化钾,因此溶液显碱性,酚酞遇碱变红,所以溶液仍显红色。故选C。
8.(2009·眉山中考)只用水不能区分各组物质(物质均为固体)的是( )
A.生石灰、氯化钠
B.碳酸钙、氢氧化钠
C.苏打、小苏打
D.硝酸钾、硝酸铵
【解析】选C。A中生石灰溶于水时放出大量热,而氯化钠溶解时溶液温度无明显变化;B中碳酸钙不溶于水,而氢氧化钠能溶于水,且溶解时放热;C中苏打(碳酸钠)和小苏打(碳酸氢钠)均能溶于水,且均形成无色溶液;D中两种物质也均能溶解于水,但硝酸铵溶解时溶液的温度显著降低。故A、B、D中的物质只用水就可以区分,C中的两种物质只用水则不能区分。
9.若用一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是( )
A.氯化钡溶液 B.紫色石蕊试液
C.碳酸钠溶液 D.酚酞试液
【解析】选C。氯化钡溶液与NaOH、Ca(OH)2溶液均不反应,不能将它们区分开,A错误;NaOH、Ca(OH)2溶液均显碱性,用紫色石蕊试液不能将它们区分开,B错误;碳酸钠溶液与NaOH溶液不反应,与Ca(OH)2溶液反应生成白色沉淀,与稀H2SO4反应生成气体,因此用碳酸钠溶液可将这三种物质鉴别开来,C正确;NaOH、Ca(OH)2溶液均显碱性,用酚酞试液不能将它们区分开,D错误,故选C。
10.往盐酸和氯化钙的混合溶液中逐渐加入足量的碳酸钠溶液,出现的现象是( )
A.只有气泡产生
B.先出现气泡,随后出现白色沉淀
C.先出现沉淀后出现气泡
D.只产生白色沉淀
【解析】选B。碳酸钠溶液不会先与氯化钙溶液反应生成沉淀,因盐酸的存在,碳酸钙沉淀不会形成;反应过程是Na2CO3先和稀盐酸反应产生CO2气体,再与CaCl2反应生成CaCO3白色沉淀,故应为B。
二、理解与应用(本题包括4个小题,共32分)
11.(6分)如果以碳酸钙、碳酸钠、水为原料制取氢氧化钠,可设计如下反应过程:
请写出有关反应的化学方程式
①__________________________________________;
②__________________________________________;
③__________________________________________。
【解析】本题难度较低,关键是掌握好化学方程式的配平、反应条件等内容。
答案:①CaCO3 高温 CaO+CO2↑
②CaO+H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
====
12.(8分)下列数据是硝酸钾固体在不同温度时的溶解度。
(1)硝酸钾溶液中的溶剂是_______;
(2)20 ℃时,向100 g水中加入31.6 g硝酸钾,充分溶解后得到____(填“饱和”或“不饱和”)溶液。
(3)20 ℃时,向100 g水中加入40 g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是______。
(4)如图所示,小烧杯中盛放的是上述(2)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是______(填字母)。
A.冰 B.浓硫酸
C.硝酸铵 D.干冰
E.氢氧化钠 F.氧化钙
【解析】由表中信息知,硝酸钾的溶解度随温度升高而增大,且20℃时,硝酸钾的溶解度为31.6 g,故此时向100 g 水中加入31.6 g硝酸钾,充分溶解后能得到饱和溶液,加入40 g硝酸钾不会全部溶解,可加入溶剂或升高温度;(4)小烧杯中盛的是硝酸钾的饱和溶液,若要析出晶体,可降低温度,能使环境温度降低的有冰、
硝酸铵、干冰等。
答案:(1)水(H2O) (2)饱和
(3)加水(或升高温度) (4)A、C、D
13.(6分)(2009·平原中考)我国青海湖地区素有“夏天晒盐,冬天捞碱”之说,其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。小王同学以捞出的碱作为样品,并用以下一套装置对样品进行分析,根据量筒中收集到的液体的体积(相当于二氧化碳的体积)来计算样品中碳酸钠的含量。(已知:HCl+NaHCO3====
NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)
(1)在A和B 两套装置中,哪一套装置更合理______(选填“A”或“B”)。
(2)准确读取量筒内液体体积的方法是_______。
(3)锥形瓶中原有的空气对实验结果是否有明显影响?___________(填“有”或“没有”)。
(4)若实验中用的盐酸是浓盐酸,则测得的样品中碳酸钠的含量与实际值相比会______(填“偏大”、“偏小”或“不变”)。
【解析】比较A、B两套装置,其差别在于两套装置中使用的漏斗不同,A中的分液漏斗可以通过活塞控制加入液体的量,来控制反应速率,而B中的长颈漏斗则不能,故A更合理;要准确读出量筒内液体的体积,需注意两点:一是需要将玻璃管拿出,二是需要将量筒放平稳,在此基础上按照正确的读数方法读出液体的体积;若实验中用浓盐酸,则制得的二氧化碳中混有的氯化氢气体能与碳酸氢钠溶液反应生成二氧化碳,从而增加了二氧化碳的量,使测得的结果偏大。
答案: (1)A
(2)取出导管,量筒平放,读数时视线与溶液凹液面的最低处相切
(3)没有 (4)偏大
14.(12分)(2009·达州中考)有A、B、C、D四种物质,如图所示,A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A。D与A、B、C均能发生反应,D与C发生中和反应,D与A反
应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀。
(1)请根据已知条件推断四种物质的化学式:
A______;B______;C_______;D_______。
(2)请写出下列反应的化学方程式:
C溶液中通入CO2,溶液变浑浊____________________
D与A反应_____________________________________。
【解析】由在C溶液中通入CO2,溶液变浑浊知C溶液为Ca(OH)2溶液;由D与C发生中和反应知D为酸,由D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀知D为盐酸;由B和水作用生成Ca(OH)2知B为CaO;由A高温生成CaO知A为CaCO3,也可由C溶液中通入CO2生成白色沉淀A推知A为CaCO3。
答案:(1)CaCO3 CaO Ca(OH)2 HCl
(2)Ca(OH)2+CO2====CaCO3↓+H2O
2HCl+CaCO3====CaCl2+CO2↑+H2O
三、实验与探究(本题包括2个小题,共20分)
15.(8分)为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:方案一:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液。方案二:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液。
请回答:
(1)该同学设计的两个方案有一个是正确的,该方案是____;另一个方案是不正确的,原因是_____。
(2)请你再设计一个实验,区别上述两种溶液:
实验操作:__________________;
实验现象:__________________。
【解析】区别NaOH和Na2CO3两种无色溶液,所进行的操作必须使产生的现象不同,方案一中,酚酞试液遇碱变红色,而NaOH和Na2CO3两种无色溶液都呈碱性,故方案一不正确;区别这两种溶液必须利用它们性质的不同。
答案:(1)方案二 因为NaOH和Na2CO3两种无色溶液都呈碱性,都能使酚酞试液变红色 (2)分别取少量溶液于试管中,各加入少量盐酸 有气体生成的是Na2CO3溶液(答案合理即可)
16.(12分)硬水中含有较多的可溶性钙、镁化合物,其钙的化合物为Ca(HCO3)2,受热易分解,对其加热生成大量的气体,还有一种难溶性的盐,该盐是水垢的主要成分之一。
(1)【提出问题】探究Ca(HCO3)2受热分解的另外两种生成物。
(2)【猜想】①小刚认为生成物中的气体可能是二氧化碳。②你认为生成物中固体可能是_______。
(3)【设计实验方案】请你设计出简单的实验方案,来验证上述猜想是否正确。
验证猜想①的方案________________;
验证猜想②的方案________________。
(4)【现象与结论】如果小刚的猜想正确,现象应该是______;如果你的猜想正确,现象应该是______。
(5)写出Ca(HCO3)2受热分解的化学方程式______。
【解析】由Ca(HCO3)2的组成知,加热分解产物中肯定有钙元素,原子团一般不变,故不溶性盐为CaCO3,验证物质时应考虑物质具有的性质。
答案:(2)碳酸钙 (3)将生成的气体通入澄清石灰水向固体中加入稀盐酸,然后将生成的气体通入澄清石灰水 (4)澄清石灰水变浑浊 有气体生成,澄清石灰水变浑浊
(5)Ca(HCO3)2 △ CaCO3↓+CO2↑+H2O
====
四、分析与计算(本题包括2个小题,共18分)
17.(8分)现有13.7 g由Na2CO3与NaHCO3组成的混合物,其中Na2CO3有5.3 g,请计算
(1)混合物中碳元素与氧元素的质量比为_____;
(2)混合物中钠元素的质量分数约为_________。(精确至0.1%)
【解析】(1)在Na2CO3或NaHCO3中,碳原子与氧原子的个数比都是1∶3,故混合物中碳元素与氧元素的质量比为12︰(16×3)=1∶4;
(2)5.3 g Na2CO3中钠元素的质量为:5.3 g×[(23×2)/(23×2+12+16×3)]×100%=2.3 g;
NaHCO3中钠元素的质量为(13.7 g-5.3 g)×23/(23+1+12+16×3)×100%=2.3 g,故混合物中钠
元素的质量分数为(2.3+2.3)g/13.7 g×100%
≈33.6%。
答案:(1)1∶4 (2)33.6%
18.(10分)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4 g Na2CO3和NaCl组成的固体混合物。向其中逐渐滴加溶质质量分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填“>”、“=”或“<”)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
【解析】(1)在Na2CO3和NaCl的固体混合物中,稀盐酸只和Na2CO3反应,且生成CO2气体,从题中图可以看出,当滴入稀盐酸73 g时,放出CO2达到最大量,继续滴加稀盐酸,CO2不再增多,说明Na2CO3已反应完,稀盐酸已过量,此时溶液显酸性,pH<7。
(2)设反应生成的NaCl的质量为x,参加反应的Na2CO3的质量为y,生成CO2的质量为z。
Na2CO3+2HCl ==== 2NaCl+H2O+CO2↑
106 73 117 44
y 73 g×10% x z
答案:(1)< (2)24.2%
第二单元 海水中的化学
(45分钟 100分)
可能用到的相对原子质量:H-1 C-12 O-16
Na-23 Cl-35.5
一、选择题(本题包括10个小题,
每小题3分,共30分)
1.下列过程发生化学变化的是( )
①海水晒盐 ②海水制碱
③海水淡化 ④海水制镁
A.全部 B.只有②
C.只有②④ D.②③④
【解析】选C。海水制碱产生了新物质碳酸钠,海水制镁产生了新物质镁。
2.鱼胆弄破后会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水的物质,使鱼肉变苦,要清除这种苦味,可用下列何种溶液冲洗最为适宜( )
A.食盐水 B.醋酸
C.纯碱溶液 D.烧碱溶液
【解析】选C。由题意可知,要清除这种苦味,应该加入一种碱性物质,食盐水显中性,A错误;醋酸显酸性,B错误;纯碱溶液显碱性,C正确;烧碱溶液虽然显碱性,但具有很强的腐蚀性,不符合题意,本题应选C。
3.下列各组物质的名称、俗称、化学式表示同一种物质的是( )
A.氢氧化钠、纯碱、Na2CO3
B.消石灰、生石灰、Ca(OH)2
C.碳酸钠、苏打、Na2CO3
D.硫酸铜晶体、胆矾、CuSO4
【解析】选C。A中俗称应为烧碱,化学式应为NaOH;B中俗称应为消石灰,名称应为氢氧化钙;D中化学式应为CuSO4·5H2O;C正确。
4.在20 ℃时,往50 g硝酸钾溶液中加入5 g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶解,稍加热后,晶体全部溶解,下列说法正确的是( )
A.搅拌后加热前一定是饱和溶液
B.搅拌后加热前一定是不饱和溶液
C.加热后一定是饱和溶液
D.加热后一定是不饱和溶液
【解析】选A。搅拌后加热前由于溶液中含有未溶解的晶体,因此是饱和溶液;加热后晶体全部溶解,不能表明能否再溶解溶质晶体,故加热后所形成的溶液无法确定是否饱和。
5.下列物质中,与CO2、CuCl2溶液、Na2CO3溶液都能发生反应,且都有明显现象的是( )
A.NaOH B.Ca(OH)2 C.H2SO4 D.HCl
【解析】选B。NaOH能与CO2反应,但无明显现象,NaOH与Na2CO3溶液不反应,A不符合题意;CO2能与Ca(OH)2的水溶液反应且能使其变浑浊,Ca(OH)2的水溶液能与CuCl2溶液反应产生蓝色沉淀,Ca(OH)2的水溶液能与Na2CO3溶液反应产生白色沉淀,所以B正确;H2SO4、HCl、与CO2、CuCl2溶液均不反应,C、D均不符合题意。
6.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡,经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀
B.指针偏右,食盐溶液一定饱和
C.指针偏左,食盐溶液一定变浓
D.指针偏右,食盐溶液一定变浓
【解析】选D。块状烧碱能吸收水分,故水分会通过连通器从左盘跑向右盘,指针一定是偏右,但烧碱吸收水的能力是有限的,左盘的食盐水不一定变饱和,但肯定变浓。
7.滴有酚酞的氢氧化钙溶液与下列物质恰好完全反应后仍显红色的是( )
A.稀硫酸 B.氯化铜溶液
C.碳酸钾溶液 D.二氧化碳
【解析】选C。氢氧化钙溶液分别与稀硫酸、氯化铜溶液、二氧化碳恰好完全反应时,溶液均为中性,因此溶液应显无色,氢氧化钙溶液与碳酸钾溶液恰好完全反应时,由于生成了氢氧化钾,因此溶液显碱性,酚酞遇碱变红,所以溶液仍显红色。故选C。
8.(2009·眉山中考)只用水不能区分各组物质(物质均为固体)的是( )
A.生石灰、氯化钠
B.碳酸钙、氢氧化钠
C.苏打、小苏打
D.硝酸钾、硝酸铵
【解析】选C。A中生石灰溶于水时放出大量热,而氯化钠溶解时溶液温度无明显变化;B中碳酸钙不溶于水,而氢氧化钠能溶于水,且溶解时放热;C中苏打(碳酸钠)和小苏打(碳酸氢钠)均能溶于水,且均形成无色溶液;D中两种物质也均能溶解于水,但硝酸铵溶解时溶液的温度显著降低。故A、B、D中的物质只用水就可以区分,C中的两种物质只用水则不能区分。
9.若用一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是( )
A.氯化钡溶液 B.紫色石蕊试液
C.碳酸钠溶液 D.酚酞试液
【解析】选C。氯化钡溶液与NaOH、Ca(OH)2溶液均不反应,不能将它们区分开,A错误;NaOH、Ca(OH)2溶液均显碱性,用紫色石蕊试液不能将它们区分开,B错误;碳酸钠溶液与NaOH溶液不反应,与Ca(OH)2溶液反应生成白色沉淀,与稀H2SO4反应生成气体,因此用碳酸钠溶液可将这三种物质鉴别开来,C正确;NaOH、Ca(OH)2溶液均显碱性,用酚酞试液不能将它们区分开,D错误,故选C。
10.往盐酸和氯化钙的混合溶液中逐渐加入足量的碳酸钠溶液,出现的现象是( )
A.只有气泡产生
B.先出现气泡,随后出现白色沉淀
C.先出现沉淀后出现气泡
D.只产生白色沉淀
【解析】选B。碳酸钠溶液不会先与氯化钙溶液反应生成沉淀,因盐酸的存在,碳酸钙沉淀不会形成;反应过程是Na2CO3先和稀盐酸反应产生CO2气体,再与CaCl2反应生成CaCO3白色沉淀,故应为B。
二、理解与应用(本题包括4个小题,共32分)
11.(6分)如果以碳酸钙、碳酸钠、水为原料制取氢氧化钠,可设计如下反应过程:
请写出有关反应的化学方程式
①__________________________________________;
②__________________________________________;
③__________________________________________。
【解析】本题难度较低,关键是掌握好化学方程式的配平、反应条件等内容。
答案:①CaCO3 高温 CaO+CO2↑
②CaO+H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
====
12.(8分)下列数据是硝酸钾固体在不同温度时的溶解度。
(1)硝酸钾溶液中的溶剂是_______;
(2)20 ℃时,向100 g水中加入31.6 g硝酸钾,充分溶解后得到____(填“饱和”或“不饱和”)溶液。
(3)20 ℃时,向100 g水中加入40 g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是______。
(4)如图所示,小烧杯中盛放的是上述(2)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是______(填字母)。
A.冰 B.浓硫酸
C.硝酸铵 D.干冰
E.氢氧化钠 F.氧化钙
【解析】由表中信息知,硝酸钾的溶解度随温度升高而增大,且20℃时,硝酸钾的溶解度为31.6 g,故此时向100 g 水中加入31.6 g硝酸钾,充分溶解后能得到饱和溶液,加入40 g硝酸钾不会全部溶解,可加入溶剂或升高温度;(4)小烧杯中盛的是硝酸钾的饱和溶液,若要析出晶体,可降低温度,能使环境温度降低的有冰、
硝酸铵、干冰等。
答案:(1)水(H2O) (2)饱和
(3)加水(或升高温度) (4)A、C、D
13.(6分)(2009·平原中考)我国青海湖地区素有“夏天晒盐,冬天捞碱”之说,其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。小王同学以捞出的碱作为样品,并用以下一套装置对样品进行分析,根据量筒中收集到的液体的体积(相当于二氧化碳的体积)来计算样品中碳酸钠的含量。(已知:HCl+NaHCO3====
NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)
(1)在A和B 两套装置中,哪一套装置更合理______(选填“A”或“B”)。
(2)准确读取量筒内液体体积的方法是_______。
(3)锥形瓶中原有的空气对实验结果是否有明显影响?___________(填“有”或“没有”)。
(4)若实验中用的盐酸是浓盐酸,则测得的样品中碳酸钠的含量与实际值相比会______(填“偏大”、“偏小”或“不变”)。
【解析】比较A、B两套装置,其差别在于两套装置中使用的漏斗不同,A中的分液漏斗可以通过活塞控制加入液体的量,来控制反应速率,而B中的长颈漏斗则不能,故A更合理;要准确读出量筒内液体的体积,需注意两点:一是需要将玻璃管拿出,二是需要将量筒放平稳,在此基础上按照正确的读数方法读出液体的体积;若实验中用浓盐酸,则制得的二氧化碳中混有的氯化氢气体能与碳酸氢钠溶液反应生成二氧化碳,从而增加了二氧化碳的量,使测得的结果偏大。
答案: (1)A
(2)取出导管,量筒平放,读数时视线与溶液凹液面的最低处相切
(3)没有 (4)偏大
14.(12分)(2009·达州中考)有A、B、C、D四种物质,如图所示,A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A。D与A、B、C均能发生反应,D与C发生中和反应,D与A反
应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀。
(1)请根据已知条件推断四种物质的化学式:
A______;B______;C_______;D_______。
(2)请写出下列反应的化学方程式:
C溶液中通入CO2,溶液变浑浊____________________
D与A反应_____________________________________。
【解析】由在C溶液中通入CO2,溶液变浑浊知C溶液为Ca(OH)2溶液;由D与C发生中和反应知D为酸,由D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀知D为盐酸;由B和水作用生成Ca(OH)2知B为CaO;由A高温生成CaO知A为CaCO3,也可由C溶液中通入CO2生成白色沉淀A推知A为CaCO3。
答案:(1)CaCO3 CaO Ca(OH)2 HCl
(2)Ca(OH)2+CO2====CaCO3↓+H2O
2HCl+CaCO3====CaCl2+CO2↑+H2O
三、实验与探究(本题包括2个小题,共20分)
15.(8分)为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:方案一:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液。方案二:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液。
请回答:
(1)该同学设计的两个方案有一个是正确的,该方案是____;另一个方案是不正确的,原因是_____。
(2)请你再设计一个实验,区别上述两种溶液:
实验操作:__________________;
实验现象:__________________。
【解析】区别NaOH和Na2CO3两种无色溶液,所进行的操作必须使产生的现象不同,方案一中,酚酞试液遇碱变红色,而NaOH和Na2CO3两种无色溶液都呈碱性,故方案一不正确;区别这两种溶液必须利用它们性质的不同。
答案:(1)方案二 因为NaOH和Na2CO3两种无色溶液都呈碱性,都能使酚酞试液变红色 (2)分别取少量溶液于试管中,各加入少量盐酸 有气体生成的是Na2CO3溶液(答案合理即可)
16.(12分)硬水中含有较多的可溶性钙、镁化合物,其钙的化合物为Ca(HCO3)2,受热易分解,对其加热生成大量的气体,还有一种难溶性的盐,该盐是水垢的主要成分之一。
(1)【提出问题】探究Ca(HCO3)2受热分解的另外两种生成物。
(2)【猜想】①小刚认为生成物中的气体可能是二氧化碳。②你认为生成物中固体可能是_______。
(3)【设计实验方案】请你设计出简单的实验方案,来验证上述猜想是否正确。
验证猜想①的方案________________;
验证猜想②的方案________________。
(4)【现象与结论】如果小刚的猜想正确,现象应该是______;如果你的猜想正确,现象应该是______。
(5)写出Ca(HCO3)2受热分解的化学方程式______。
【解析】由Ca(HCO3)2的组成知,加热分解产物中肯定有钙元素,原子团一般不变,故不溶性盐为CaCO3,验证物质时应考虑物质具有的性质。
答案:(2)碳酸钙 (3)将生成的气体通入澄清石灰水向固体中加入稀盐酸,然后将生成的气体通入澄清石灰水 (4)澄清石灰水变浑浊 有气体生成,澄清石灰水变浑浊
(5)Ca(HCO3)2 △ CaCO3↓+CO2↑+H2O
====
四、分析与计算(本题包括2个小题,共18分)
17.(8分)现有13.7 g由Na2CO3与NaHCO3组成的混合物,其中Na2CO3有5.3 g,请计算
(1)混合物中碳元素与氧元素的质量比为_____;
(2)混合物中钠元素的质量分数约为_________。(精确至0.1%)
【解析】(1)在Na2CO3或NaHCO3中,碳原子与氧原子的个数比都是1∶3,故混合物中碳元素与氧元素的质量比为12︰(16×3)=1∶4;
(2)5.3 g Na2CO3中钠元素的质量为:5.3 g×[(23×2)/(23×2+12+16×3)]×100%=2.3 g;
NaHCO3中钠元素的质量为(13.7 g-5.3 g)×23/(23+1+12+16×3)×100%=2.3 g,故混合物中钠
元素的质量分数为(2.3+2.3)g/13.7 g×100%
≈33.6%。
答案:(1)1∶4 (2)33.6%
18.(10分)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4 g Na2CO3和NaCl组成的固体混合物。向其中逐渐滴加溶质质量分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填“>”、“=”或“<”)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
【解析】(1)在Na2CO3和NaCl的固体混合物中,稀盐酸只和Na2CO3反应,且生成CO2气体,从题中图可以看出,当滴入稀盐酸73 g时,放出CO2达到最大量,继续滴加稀盐酸,CO2不再增多,说明Na2CO3已反应完,稀盐酸已过量,此时溶液显酸性,pH<7。
(2)设反应生成的NaCl的质量为x,参加反应的Na2CO3的质量为y,生成CO2的质量为z。
Na2CO3+2HCl ==== 2NaCl+H2O+CO2↑
106 73 117 44
y 73 g×10% x z
答案:(1)< (2)24.2%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
