2011版初中化学新课标金榜学案配套课件:单元评价检测三(鲁教版九年级全一册)(五四制)
文档属性
| 名称 | 2011版初中化学新课标金榜学案配套课件:单元评价检测三(鲁教版九年级全一册)(五四制) |

|
|
| 格式 | rar | ||
| 文件大小 | 759.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-04 00:00:00 | ||
图片预览











文档简介
(共47张PPT)
第三单元 金属
(45分钟 100分)
可能用到的相对原子质量:H-1 O-16 S-32
Fe-56 Cu-64 Zn-65
一、选择题(本题包括10个小题,
每小题3分,共30分)
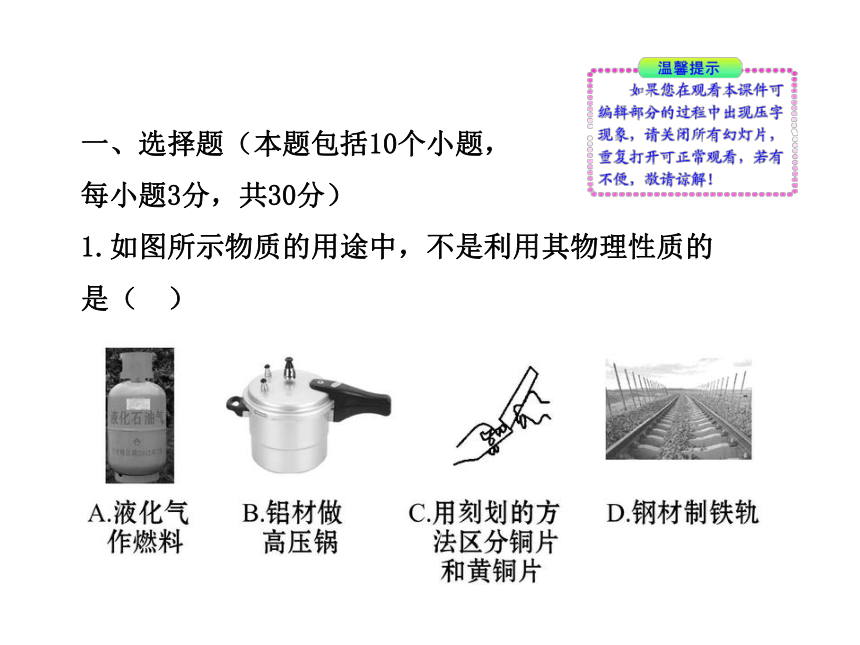
1.如图所示物质的用途中,不是利用其物理性质的
是( )
【解析】选A。A用液化气作燃料是利用了其可燃性,利用的是液化气的化学性质;B利用了铝的优良导热性,属于铝的物理性质;C利用了纯金属和合金在硬度上的不同进行区分,而硬度属于物质的物理性质;D利用了钢材的韧性和硬度这两方面的物理性质。
2.(2009·天水中考)有X、Y、Z三种金属,把X和Y放入稀盐酸中,X溶解Y不溶解;把Y和Z分别放入AgNO3溶液中,Y表面有银析出而Z没有变化,则X、Y、Z的金属活动性顺序是( )
A.X>Y>Z B.X>Z>Y
C.Z>Y>X D.Z>X>Y
【解析】选A。由X溶解于稀盐酸中,而Y不溶解,说明金属活动性顺序中,X排在H的前面,而Y排在H的后面,即金属活动性顺序为X>Y;由Y能置换出银而Z不能置换出银,说明金属活动性顺序为Y>Ag>Z,故金属活动性顺序为X>Y>Z。
3.下列家庭生活中的做法不能防止菜刀生锈的是( )
A.菜刀使用完后,用水洗净,并擦干
B.久置不用时菜刀表面涂一层植物油
C.把菜刀存放在潮湿的地方
D.用不锈钢菜刀取代普通菜刀
【解析】选C。菜刀放在潮湿的空气中易生锈,因此用后应及时洗净擦干。若久置不用,可在表面涂一层食用油。
4.利用铝合金而不用纯铝制作钥匙,主要是利用铝合金的哪种性质( )
A.熔点低 B.密度小
C.硬度大 D.无磁性
【解析】选C。合金比组成它的纯金属硬度大。由于纯铝硬度较小,在使用中易变形,因此使用硬度较大的铝合金。
5.下列事实不能说明Zn比Ag活泼的是( )
A.Zn能与AgNO3溶液反应置换出Ag
B.Zn与稀硫酸反应,Ag则不能
C.自然界中没有以单质形式存在的Zn,而有以单质形式存在的Ag
D.Zn的熔点为420 ℃,Ag的熔点为962 ℃
【解析】选D。由于金属能从化合物溶液中置换出比它不活泼的金属,故A能说明;较活泼的金属才能与稀硫酸反应生成氢气,故B能说明;活动性强的金属由于能与周围物质发生化学反应生成化合物,因此不会以单质形式存在,不活泼金属不易与周围物质发生化学反应,因此以单质形式存在,故C能说明;金属的活泼性与金属的熔点无关,故D不能说明。
6.下表中不同金属被开发利用的年代不同,从化学反
应这一角度来看,决定这一年代先后顺序的关键因素
是( )
A.金属的活动性
B.金属的导电性
C.金属的延展性
D.地壳中金属元素的含量
【解析】选A。根据图中信息,金属越不活泼,被开发利用的年代越早,而金属越活泼,金属被开发利用的时间越晚,因此金属被开发和利用的时间与金属的活动性有关。
7.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是( )
A.X是金属时,Y一定比X活泼
B.X可能是铁,Y一定是铜
C.X是金属时,Y可能是金属,也可能是非金属
D.X一定是排在金属活动性顺序表中氢以前的金属
【解析】选C。活泼金属能置换出比它不活泼的金属,由题意知单质X能从某溶液中置换出单质Y,故X的活动性比Y强;当X可能是铁时,Y的活泼性应比铁弱,可能是铜;当X是排在金属活动性顺序表中H前面的金属时,Y可能是金属也可能是非金属,如H2。
8.将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一,现依据下表中的数据判断,不宜采取上述方法制取的合金是( )
A.Fe-Cu合金 B.Mg-Fe合金
C.Al-Na合金 D.Cu-Al合金
【解析】选B。制取合金时两种金属熔合的温度高于熔点较高的金属的熔点,低于沸点较低的金属的沸点,在该温度范围内同时熔化为液体。由于B中铁的熔点比镁的沸点还高,因而当铁熔化时,镁已处于气体状态,故不能制得合金。
9.向一定质量的稀盐酸中加入镁粉至过量,若图像中横坐标表示镁粉的质量,则纵坐标表示( )
A.溶液的质量
B.稀盐酸的质量
C.氯化镁的质量
D.生成气体的质量
【解析】选A。由反应Mg+2HCl====MgCl2+H2↑
24 2
可知,每有24份质量的镁反应进入溶液,溶液中会有2份质量的氢气逸出,即溶质质量逐渐增大至反应完全;由于反应中消耗盐酸,其质量应逐渐减少;MgCl2和H2是反应后才产生的。
10.铜锌合金若干克经粉碎后,加入足量的稀硫酸,充分反应后过滤,得到的滤渣在空气中充分灼烧,结果灼烧后的生成物质量与原合金质量相同,则原混合物中锌的质量分数为( )
A.20% B.40% C.50% D.80%
【解析】选A。Cu不与稀硫酸反应,得到的滤渣为Cu。因灼烧后生成的氧化铜的质量与原合金质量相等,则氧化铜中氧元素的质量分数等于原合金中锌的质量分数。即原合金中锌的质量分数为16/(16+64)×100%=20%。
二、理解与应用(本题包括4个小题,共30分)
11.(10分)(2009·达州中考)下表是生活中某种常见金属X的部分性质:
将金属X投入盐酸中,有大量气泡生成。根据上述信息,回答下列问题:
(1)试推断金属X可能的一种用途____。
(2)将金属X放入硫酸铜溶液中,观察到的现象是__。
(3)请自选试剂,设计实验比较金属X与Mg的活动性强弱。完成下表:
【解析】(1)由于该金属导电性能好,可制作导线;由于金属导热性良好,可制作水壶、锅;根据该金属延展性良好,可加工成丝或片。
(2)由于该金属能与盐酸反应,说明其活动性比铜强,因此能和硫酸铜溶液反应,表面有红色铜生成;
(3)由“结论”可知,该金属的活动性比镁弱,可用该金属与镁的化合物溶液进行验证。
答案:(1)做锅、水壶/加工成丝/加工成片
(2)金属X表面有红色固体生成
(3)
12.(5分)生活处处有化学,家庭厨房就是一个化学小世界。
(1)液态植物油和固态动物油合称为油脂。若锅里的油着火了,应立即盖上锅盖灭火,其原理是_____。
(2)为了全民的健康,卫生部推广使用强化加铁酱油。这里的“铁”指的是_____(填“单质”、“元素”或“原子”)。
(3)小明晚上切完西瓜后就将菜刀放在菜板上了,第二天早上发现菜刀生锈了。请你帮他分析菜刀生锈的原因:________;为了防止这把菜刀生锈,小明应采取哪些防锈措施________、_________(填两条)。
【解析】燃烧的条件是①温度达到可燃物的着火点;②可燃物与空气(或氧气)接触,二者缺一不可,破坏其中一个条件就可灭火。盖上锅盖灭火,隔绝了空气(或氧气)。铁生锈的条件是与氧气和水同时接触,防止菜刀生锈可保持菜刀表面干净干燥、涂上油等。
答案:(1)隔绝空气(或氧气)(2)元素
(3)铁与空气中的氧气和水接触,满足了铁生锈的条件 保持刀具表面干净干燥 涂油(合理答案均可)
13.(5分)(2009·眉山中考)构建知识网络是一种重要的学习方法。下图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
(1)A物质的化学式为_____________。
(2)B物质的一种用途是__________。
(3)反应②还需要的一种反应物是________(填化学式)。
(4)写出反应③的化学方程式,并注明基本反应类型:_______________( )。
【解析】本题属于物质推断题,解题的关键是要找准题中的关键信息。由题中信息知,A是铁燃烧的产物,则A是四氧化三铁,B是密度最小的气体,则B是氢气,C是红色固体单质,则C是铜,据此可以完成有关物质之间的转化,从而完成题目。
答案:(1)Fe3O4
(2)冶炼金属(作燃料等)
(3)C(或CO或H2)
(4)Fe+CuSO4====FeSO4+Cu(答案合理即可) 置换反应
14.(10分)某学生改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热再通入一氧化碳可能产生的后果是________;
(2)写出A中发生反应的化学方程式______;
(3)从B装置中产生的现象可以判断反应是否开始,则B中的试剂是___________;
(4)C装置的作用是____________;
(5)收集到C瓶中的气体如何处理?_________。
【解析】(1)先通CO的目的是排除装置内的空气,以免加热时CO与空气混合引起爆炸;
(3)CO还原氧化铁得到CO2,可用澄清石灰水检验反应是否发生;
(4)收集CO可防止污染空气;
(5)收集的CO可留作CO性质实验用。
答案:(1)发生爆炸
(2)3CO+Fe2O3 高温 2Fe+3CO2
(3)澄清石灰水
(4)收集未反应的CO,防止污染空气
(5)留作CO性质实验用
====
三、实验与探究(本题包括2个小题,共24分)
15.(14分)已知固体化合物由C、H、O、Cu四种元素组成。向盛有该化合物的试管中加入过量的稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液。已知这种蓝绿色溶液是氯化铜溶液。
(1)探究产生的气体是什么。
【猜想】①可能是氢气;②可能是甲烷;③还可能是________……
【实验】请设计一个简单的实验验证你提出的猜想,写出操作方法和可能出现的实验现象。_______。
(2)从蓝绿色溶液中提取金属铜。现利用该溶液制取金属铜,过程如下:
①操作a的名称是_____,完成该操作需要的玻璃仪器有烧杯、漏斗和_________;
②蓝绿色溶液中加入过量的铁粉后的生成物有:____;
③确定固体M中加入B是否已经过量的方法有:______。
【解析】(1)根据化学反应前后元素种类不变,由于反应中有CuCl2生成,可知该气体中应含有C、H、O三种元素中的一种或几种。由此可推知该气体可能为CH4、H2、CO2等。
(2)由于铁粉过量,得到的固体中除了含有生成的铜,还含有过量的铁粉,可采用过滤的方法将该固体分离出来;其中的铁粉可用过量的稀硫酸(或盐酸)除去;当向反应后的物质中再加入少量的稀硫酸(或盐酸),若无气泡生成,则说明稀硫酸(或盐酸)已过量。
答案:(1)二氧化碳 将气体通入澄清石灰水中,石灰水变浑浊,证明是二氧化碳
(2)①过滤 玻璃棒
②FeCl2、Cu、H2
③再加入少量B,无气泡产生,则说明B已经过量
16.(10分)长期露置于空气中的金属M表面会被锈蚀。经检测,锈蚀物中除含有M外,还有C、H、O三种元素。根据质量守恒定律,推测与金属M发生反应生成锈蚀物的物质。
推测Ⅰ:锈蚀物中的H来自空气中的(填化学式,下同)_______,C来自空气中的______,因此这两种物质肯定参加了反应;
推测Ⅱ:锈蚀物中的O有多种来源,因此不能确定空气中的O2是否参加了反应;
(1)某同学为了验证空气中的O2是否参加了反应,设计了如下系列实验,你认为其中必须要做的实验是_______(填实验编号)。
说明:①所用蒸馏水都是经煮沸迅速冷却的;
②固体干燥剂N只吸收水分,不吸收CO2和O2。
(2)假如要进行实验D,检验CO2是否充满的操作方法是__________。
【解析】由于锈蚀物中除M外的元素均来自空气中的物质,空气中含有H元素的物质是H2O,含有C元素的物质是CO2,而空气中含O元素的物质种类比较多,如O2、H2O、CO2。为了验证O2是否参加了反应,应设计两个对照实验,其中一个装置中含有O2,另一装置中没有O2,两装置中都应含有金属M、CO2和水,因此必须做的实验为A、F。
答案:H2O CO2 (1)A、F
(2)用燃着的木条放在试管口,如果木条熄灭,说明试管中已充满CO2
四、分析与计算(本题包括2个小题,共16分)
17.(6分)现有铁和氧化铁的混合物10 g,用一氧化碳充分还原后得到铁7.6 g,试计算10 g混合物中氧化铁的质量分数。
【解析】设原混合物中含铁的质量为x。
Fe2O3+3CO 高温 2Fe+3CO2
160 112
10 g-x 7.6 g-x
160∶112=(10 g-x)∶(7.6 g-x)
解得x=2.0 g
混合物中含氧化铁的质量分数为(10 g-2.0 g)/10 g
×100%=80%
答案:80%
====
18.(10分)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
根据该同学的实验,试回答以下问题:
(1)在上表合金里的铁完全反应的一组实验中,合金消耗稀硫酸溶液的质量是_________g。
(2)该铜铁合金中铁的质量分数是多少?
(3)求第三次实验所得溶液中硫酸亚铁的质量分数。(结果保留至0.1%)。
【解析】(1)由第一次和第二次实验可以看出,稀硫酸的质量增加时,生成氢气质量不增加,因此产生
0.4 g H2时,20 g合金已完全反应。第三次实验与前两次实验比较,所取合金质量增加时,生成的H2仍为
0.4 g,即80 g 稀硫酸恰好反应,合金中的铁没有完全反应。
(2)根据题意,设20 g合金中铁的质量为x。
Fe+H2SO4====FeSO4+H2↑
56 2
x 0.4 g
56∶2=x∶0.4 g
解得x=11.2 g
11.2 g/20 g×100%=56%
(3)设生成FeSO4的质量为y,则
Fe+H2SO4====FeSO4+H2↑
152 2
y 0.4 g
152∶2=y∶0.4 g
y=30.4 g
30.4 g/(11.2 g+80 g-0.4 g)×100%=33.5%
答案:(1)80 (2)56% (3)33.5%
第三单元 金属
(45分钟 100分)
可能用到的相对原子质量:H-1 O-16 S-32
Fe-56 Cu-64 Zn-65
一、选择题(本题包括10个小题,
每小题3分,共30分)
1.如图所示物质的用途中,不是利用其物理性质的
是( )
【解析】选A。A用液化气作燃料是利用了其可燃性,利用的是液化气的化学性质;B利用了铝的优良导热性,属于铝的物理性质;C利用了纯金属和合金在硬度上的不同进行区分,而硬度属于物质的物理性质;D利用了钢材的韧性和硬度这两方面的物理性质。
2.(2009·天水中考)有X、Y、Z三种金属,把X和Y放入稀盐酸中,X溶解Y不溶解;把Y和Z分别放入AgNO3溶液中,Y表面有银析出而Z没有变化,则X、Y、Z的金属活动性顺序是( )
A.X>Y>Z B.X>Z>Y
C.Z>Y>X D.Z>X>Y
【解析】选A。由X溶解于稀盐酸中,而Y不溶解,说明金属活动性顺序中,X排在H的前面,而Y排在H的后面,即金属活动性顺序为X>Y;由Y能置换出银而Z不能置换出银,说明金属活动性顺序为Y>Ag>Z,故金属活动性顺序为X>Y>Z。
3.下列家庭生活中的做法不能防止菜刀生锈的是( )
A.菜刀使用完后,用水洗净,并擦干
B.久置不用时菜刀表面涂一层植物油
C.把菜刀存放在潮湿的地方
D.用不锈钢菜刀取代普通菜刀
【解析】选C。菜刀放在潮湿的空气中易生锈,因此用后应及时洗净擦干。若久置不用,可在表面涂一层食用油。
4.利用铝合金而不用纯铝制作钥匙,主要是利用铝合金的哪种性质( )
A.熔点低 B.密度小
C.硬度大 D.无磁性
【解析】选C。合金比组成它的纯金属硬度大。由于纯铝硬度较小,在使用中易变形,因此使用硬度较大的铝合金。
5.下列事实不能说明Zn比Ag活泼的是( )
A.Zn能与AgNO3溶液反应置换出Ag
B.Zn与稀硫酸反应,Ag则不能
C.自然界中没有以单质形式存在的Zn,而有以单质形式存在的Ag
D.Zn的熔点为420 ℃,Ag的熔点为962 ℃
【解析】选D。由于金属能从化合物溶液中置换出比它不活泼的金属,故A能说明;较活泼的金属才能与稀硫酸反应生成氢气,故B能说明;活动性强的金属由于能与周围物质发生化学反应生成化合物,因此不会以单质形式存在,不活泼金属不易与周围物质发生化学反应,因此以单质形式存在,故C能说明;金属的活泼性与金属的熔点无关,故D不能说明。
6.下表中不同金属被开发利用的年代不同,从化学反
应这一角度来看,决定这一年代先后顺序的关键因素
是( )
A.金属的活动性
B.金属的导电性
C.金属的延展性
D.地壳中金属元素的含量
【解析】选A。根据图中信息,金属越不活泼,被开发利用的年代越早,而金属越活泼,金属被开发利用的时间越晚,因此金属被开发和利用的时间与金属的活动性有关。
7.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是( )
A.X是金属时,Y一定比X活泼
B.X可能是铁,Y一定是铜
C.X是金属时,Y可能是金属,也可能是非金属
D.X一定是排在金属活动性顺序表中氢以前的金属
【解析】选C。活泼金属能置换出比它不活泼的金属,由题意知单质X能从某溶液中置换出单质Y,故X的活动性比Y强;当X可能是铁时,Y的活泼性应比铁弱,可能是铜;当X是排在金属活动性顺序表中H前面的金属时,Y可能是金属也可能是非金属,如H2。
8.将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一,现依据下表中的数据判断,不宜采取上述方法制取的合金是( )
A.Fe-Cu合金 B.Mg-Fe合金
C.Al-Na合金 D.Cu-Al合金
【解析】选B。制取合金时两种金属熔合的温度高于熔点较高的金属的熔点,低于沸点较低的金属的沸点,在该温度范围内同时熔化为液体。由于B中铁的熔点比镁的沸点还高,因而当铁熔化时,镁已处于气体状态,故不能制得合金。
9.向一定质量的稀盐酸中加入镁粉至过量,若图像中横坐标表示镁粉的质量,则纵坐标表示( )
A.溶液的质量
B.稀盐酸的质量
C.氯化镁的质量
D.生成气体的质量
【解析】选A。由反应Mg+2HCl====MgCl2+H2↑
24 2
可知,每有24份质量的镁反应进入溶液,溶液中会有2份质量的氢气逸出,即溶质质量逐渐增大至反应完全;由于反应中消耗盐酸,其质量应逐渐减少;MgCl2和H2是反应后才产生的。
10.铜锌合金若干克经粉碎后,加入足量的稀硫酸,充分反应后过滤,得到的滤渣在空气中充分灼烧,结果灼烧后的生成物质量与原合金质量相同,则原混合物中锌的质量分数为( )
A.20% B.40% C.50% D.80%
【解析】选A。Cu不与稀硫酸反应,得到的滤渣为Cu。因灼烧后生成的氧化铜的质量与原合金质量相等,则氧化铜中氧元素的质量分数等于原合金中锌的质量分数。即原合金中锌的质量分数为16/(16+64)×100%=20%。
二、理解与应用(本题包括4个小题,共30分)
11.(10分)(2009·达州中考)下表是生活中某种常见金属X的部分性质:
将金属X投入盐酸中,有大量气泡生成。根据上述信息,回答下列问题:
(1)试推断金属X可能的一种用途____。
(2)将金属X放入硫酸铜溶液中,观察到的现象是__。
(3)请自选试剂,设计实验比较金属X与Mg的活动性强弱。完成下表:
【解析】(1)由于该金属导电性能好,可制作导线;由于金属导热性良好,可制作水壶、锅;根据该金属延展性良好,可加工成丝或片。
(2)由于该金属能与盐酸反应,说明其活动性比铜强,因此能和硫酸铜溶液反应,表面有红色铜生成;
(3)由“结论”可知,该金属的活动性比镁弱,可用该金属与镁的化合物溶液进行验证。
答案:(1)做锅、水壶/加工成丝/加工成片
(2)金属X表面有红色固体生成
(3)
12.(5分)生活处处有化学,家庭厨房就是一个化学小世界。
(1)液态植物油和固态动物油合称为油脂。若锅里的油着火了,应立即盖上锅盖灭火,其原理是_____。
(2)为了全民的健康,卫生部推广使用强化加铁酱油。这里的“铁”指的是_____(填“单质”、“元素”或“原子”)。
(3)小明晚上切完西瓜后就将菜刀放在菜板上了,第二天早上发现菜刀生锈了。请你帮他分析菜刀生锈的原因:________;为了防止这把菜刀生锈,小明应采取哪些防锈措施________、_________(填两条)。
【解析】燃烧的条件是①温度达到可燃物的着火点;②可燃物与空气(或氧气)接触,二者缺一不可,破坏其中一个条件就可灭火。盖上锅盖灭火,隔绝了空气(或氧气)。铁生锈的条件是与氧气和水同时接触,防止菜刀生锈可保持菜刀表面干净干燥、涂上油等。
答案:(1)隔绝空气(或氧气)(2)元素
(3)铁与空气中的氧气和水接触,满足了铁生锈的条件 保持刀具表面干净干燥 涂油(合理答案均可)
13.(5分)(2009·眉山中考)构建知识网络是一种重要的学习方法。下图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
(1)A物质的化学式为_____________。
(2)B物质的一种用途是__________。
(3)反应②还需要的一种反应物是________(填化学式)。
(4)写出反应③的化学方程式,并注明基本反应类型:_______________( )。
【解析】本题属于物质推断题,解题的关键是要找准题中的关键信息。由题中信息知,A是铁燃烧的产物,则A是四氧化三铁,B是密度最小的气体,则B是氢气,C是红色固体单质,则C是铜,据此可以完成有关物质之间的转化,从而完成题目。
答案:(1)Fe3O4
(2)冶炼金属(作燃料等)
(3)C(或CO或H2)
(4)Fe+CuSO4====FeSO4+Cu(答案合理即可) 置换反应
14.(10分)某学生改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热再通入一氧化碳可能产生的后果是________;
(2)写出A中发生反应的化学方程式______;
(3)从B装置中产生的现象可以判断反应是否开始,则B中的试剂是___________;
(4)C装置的作用是____________;
(5)收集到C瓶中的气体如何处理?_________。
【解析】(1)先通CO的目的是排除装置内的空气,以免加热时CO与空气混合引起爆炸;
(3)CO还原氧化铁得到CO2,可用澄清石灰水检验反应是否发生;
(4)收集CO可防止污染空气;
(5)收集的CO可留作CO性质实验用。
答案:(1)发生爆炸
(2)3CO+Fe2O3 高温 2Fe+3CO2
(3)澄清石灰水
(4)收集未反应的CO,防止污染空气
(5)留作CO性质实验用
====
三、实验与探究(本题包括2个小题,共24分)
15.(14分)已知固体化合物由C、H、O、Cu四种元素组成。向盛有该化合物的试管中加入过量的稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液。已知这种蓝绿色溶液是氯化铜溶液。
(1)探究产生的气体是什么。
【猜想】①可能是氢气;②可能是甲烷;③还可能是________……
【实验】请设计一个简单的实验验证你提出的猜想,写出操作方法和可能出现的实验现象。_______。
(2)从蓝绿色溶液中提取金属铜。现利用该溶液制取金属铜,过程如下:
①操作a的名称是_____,完成该操作需要的玻璃仪器有烧杯、漏斗和_________;
②蓝绿色溶液中加入过量的铁粉后的生成物有:____;
③确定固体M中加入B是否已经过量的方法有:______。
【解析】(1)根据化学反应前后元素种类不变,由于反应中有CuCl2生成,可知该气体中应含有C、H、O三种元素中的一种或几种。由此可推知该气体可能为CH4、H2、CO2等。
(2)由于铁粉过量,得到的固体中除了含有生成的铜,还含有过量的铁粉,可采用过滤的方法将该固体分离出来;其中的铁粉可用过量的稀硫酸(或盐酸)除去;当向反应后的物质中再加入少量的稀硫酸(或盐酸),若无气泡生成,则说明稀硫酸(或盐酸)已过量。
答案:(1)二氧化碳 将气体通入澄清石灰水中,石灰水变浑浊,证明是二氧化碳
(2)①过滤 玻璃棒
②FeCl2、Cu、H2
③再加入少量B,无气泡产生,则说明B已经过量
16.(10分)长期露置于空气中的金属M表面会被锈蚀。经检测,锈蚀物中除含有M外,还有C、H、O三种元素。根据质量守恒定律,推测与金属M发生反应生成锈蚀物的物质。
推测Ⅰ:锈蚀物中的H来自空气中的(填化学式,下同)_______,C来自空气中的______,因此这两种物质肯定参加了反应;
推测Ⅱ:锈蚀物中的O有多种来源,因此不能确定空气中的O2是否参加了反应;
(1)某同学为了验证空气中的O2是否参加了反应,设计了如下系列实验,你认为其中必须要做的实验是_______(填实验编号)。
说明:①所用蒸馏水都是经煮沸迅速冷却的;
②固体干燥剂N只吸收水分,不吸收CO2和O2。
(2)假如要进行实验D,检验CO2是否充满的操作方法是__________。
【解析】由于锈蚀物中除M外的元素均来自空气中的物质,空气中含有H元素的物质是H2O,含有C元素的物质是CO2,而空气中含O元素的物质种类比较多,如O2、H2O、CO2。为了验证O2是否参加了反应,应设计两个对照实验,其中一个装置中含有O2,另一装置中没有O2,两装置中都应含有金属M、CO2和水,因此必须做的实验为A、F。
答案:H2O CO2 (1)A、F
(2)用燃着的木条放在试管口,如果木条熄灭,说明试管中已充满CO2
四、分析与计算(本题包括2个小题,共16分)
17.(6分)现有铁和氧化铁的混合物10 g,用一氧化碳充分还原后得到铁7.6 g,试计算10 g混合物中氧化铁的质量分数。
【解析】设原混合物中含铁的质量为x。
Fe2O3+3CO 高温 2Fe+3CO2
160 112
10 g-x 7.6 g-x
160∶112=(10 g-x)∶(7.6 g-x)
解得x=2.0 g
混合物中含氧化铁的质量分数为(10 g-2.0 g)/10 g
×100%=80%
答案:80%
====
18.(10分)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
根据该同学的实验,试回答以下问题:
(1)在上表合金里的铁完全反应的一组实验中,合金消耗稀硫酸溶液的质量是_________g。
(2)该铜铁合金中铁的质量分数是多少?
(3)求第三次实验所得溶液中硫酸亚铁的质量分数。(结果保留至0.1%)。
【解析】(1)由第一次和第二次实验可以看出,稀硫酸的质量增加时,生成氢气质量不增加,因此产生
0.4 g H2时,20 g合金已完全反应。第三次实验与前两次实验比较,所取合金质量增加时,生成的H2仍为
0.4 g,即80 g 稀硫酸恰好反应,合金中的铁没有完全反应。
(2)根据题意,设20 g合金中铁的质量为x。
Fe+H2SO4====FeSO4+H2↑
56 2
x 0.4 g
56∶2=x∶0.4 g
解得x=11.2 g
11.2 g/20 g×100%=56%
(3)设生成FeSO4的质量为y,则
Fe+H2SO4====FeSO4+H2↑
152 2
y 0.4 g
152∶2=y∶0.4 g
y=30.4 g
30.4 g/(11.2 g+80 g-0.4 g)×100%=33.5%
答案:(1)80 (2)56% (3)33.5%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
