沪教版(全国)初中化学九年级上册第4章 认识化学变化检测题(含答案)
文档属性
| 名称 | 沪教版(全国)初中化学九年级上册第4章 认识化学变化检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 157.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-02 16:53:23 | ||
图片预览

文档简介
《认识化学变化》检测题
一、单选题
1.根据化学方程式:2Na2S2O4
=Na2S2O3+X+SO2↑,推断X的化学式为(
)
A.Na2SO3
B.Na2SO4
C.Na2S
D.SO2
2.火的使用标志着人类文明的伟大进步,下列说法不正确的是
A.烧锅炉用的煤加工成粉末状,是为了增大煤与氧气的接触面积促进燃烧
B.炒菜时油锅着火,立即盖上锅盖,使可燃物隔绝氧气而灭火
C.发现家中天然气或者液化气泄漏时,应先关闭阀门,并开窗通风
D.当可燃物的温度达到着火点时即可燃烧
3.已知反应,则Z中X与Y原子个数比是(
)
A.
B.
C.
D.
4.在化学反应C+O2CO2中,下列说法正确的是( )
A.碳加氧气等于二氧化碳
B.反应前后分子的种类和数目不变
C.反应前后元素的数目不变
D.反应前后原子的种类和数目不变
5.下列物质的化学式书写正确的是
A.氧化铁:FeO
B.氢氧化镁:Mg(OH)2
C.氯化铵:NH3Cl
D.碳酸:CO3
6.下列对四类化学基本观念的认识错误的是(
)
A.元素观:金刚石和石墨均由碳元素组成
B.分类观:从组成上看干冰和酒精都属于化合物
C.能量观:氢气和天然气都会放出大量的热
D.守恒观:水电解前后,分子的种类和质量均不变
7.下列化学方程式中,书写正确的是( )
A.
B.
C.
D.
8.下列现象或事实与相应的解释不一致的是
事实
解释
A
木炭燃烧能生成一氧化碳或二氧化碳
反应物的量不同,生成物可能不同
B
二氧化碳与水反应生成碳酸,但在光照的条件下生成葡萄糖和氧气
反应的条件不同,产物不一样
C
冰水混合物属于纯净物
冰、水由同种分子构成
D
液氧和氧气的颜色不同
同种分子在不同温度时,颜色不同
A.A
B.B
C.C
D.D
9.如图所示,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部,下列实验现象或结论错误的是
A.实验中使用铜片,是利用了铜的导热性
B.实验说明燃烧的条件之一是物质必须是可燃物
C.铜片受热的一面变黑,是因为产生了CuO
D.实验过程中乒乓球碎片先燃烧,滤纸碎片后燃烧
10.2017年在贵阳举行了以“走向生态文明新时代共享绿色红利”为主题的生态文明国际研讨会。下列做法符合这一主题的是( )
A.节约用纸,用电子贺卡代替纸质贺卡
B.大量使用农药和化肥
C.禁止使用煤石油
D.提倡城市私家车的广泛使用
11.下列实验中物质鉴别利用提供的方案不能达到目的是(
)
选项
物质鉴别
实验方案
A
水和过氧化氢溶液
加入二氧化锰,观察有无气泡冒出
B
鉴别氮气和氧气
将带火星的木条插入集气瓶中,看是否复燃
C
硬水和软水
加入肥皂水
D
CO
和
CO2
闻气味
A.A
B.B
C.C
D.D
12.学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是()
A.原子中核内质子数和核外电子数一定相等
B.中和反应中参加反应的酸和碱的质量一定相等
C.溶液稀释前后溶质的质量一定相等
D.物质发生化学变化前后,元素的种类一定相等
13.乙醇汽油是在汽油中加入适量酒精混合而成的一种燃料。乙醇(用X表示)完全燃烧的化学方程式为X+3O22CO2+3H2O。推断乙醇的化学式为
A.C2H6O
B.C3H8
C.C2H6
D.C4H6O2
14.下图表示治理汽车尾气所涉及反应的微观过程。下列说法不正确的是( )
A.图中单质的化学式为
B.该反应使有害气体转化为无害气体
C.参加反应的两种分子的个数比为
D.生成的单质与化合物的质量比为
二、实验题
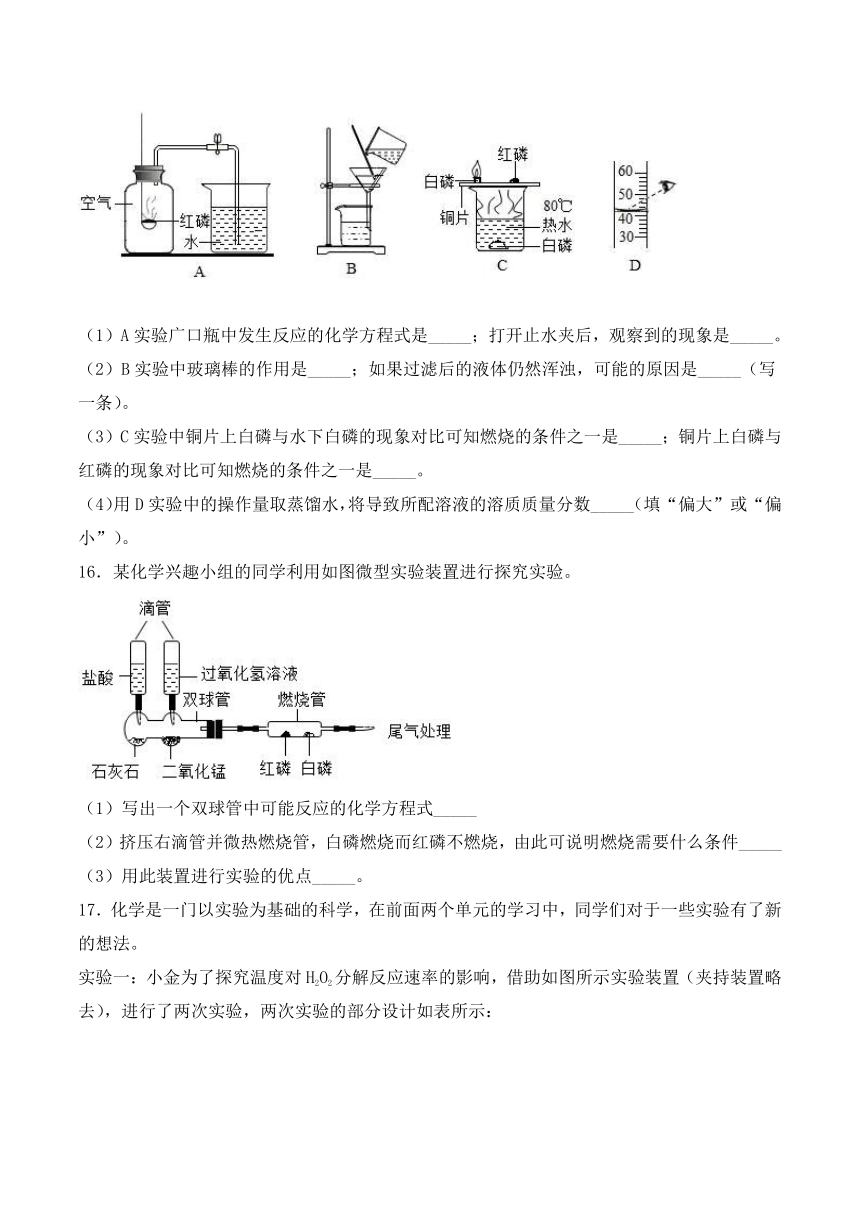
15.下列是初中化学教材常见的实验装置图,请根据要求回答下列问题:
(1)A实验广口瓶中发生反应的化学方程式是_____;打开止水夹后,观察到的现象是_____。
(2)B实验中玻璃棒的作用是_____;如果过滤后的液体仍然浑浊,可能的原因是_____(写一条)。
(3)C实验中铜片上白磷与水下白磷的现象对比可知燃烧的条件之一是_____;铜片上白磷与红磷的现象对比可知燃烧的条件之一是_____。
(4)用D实验中的操作量取蒸馏水,将导致所配溶液的溶质质量分数_____(填“偏大”或“偏小”)。
16.某化学兴趣小组的同学利用如图微型实验装置进行探究实验。
(1)写出一个双球管中可能反应的化学方程式_____
(2)挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件_____
(3)用此装置进行实验的优点_____。
17.化学是一门以实验为基础的科学,在前面两个单元的学习中,同学们对于一些实验有了新的想法。
实验一:小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
实验1
实验2
MnO2的质量/克
0.5
0.5
5%的H2O2的体积/毫升
40
待填
水浴温度/℃
20
80
(1)实验2中应加入5%H2O2__________毫升。
(2)在两次实验中,可通过_______来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有_______。
(4)实验结束后若要将MnO2从混合物汇总分离出来,可采取的操作是过滤、_____、_____。
实验二:在测定空气氧气含量实验中,部分同学发现如果燃烧匙位置太靠上,会导致测定结果偏小。针对这一结果,同学们设计了如图的实验。实验步骤如下:
①连接好仪器,检查装置气密性,气密性良好;
②装好药品,瓶底倒入50mL水,量筒内装有50mL水(集气瓶容积为200mL)
③通过凸透镜聚光引燃燃烧匙中的白磷,白磷燃烧,待白磷熄灭装置冷却后,打开弹簧夹,量筒中的水进入集气瓶,量筒剩余30mL水;
④再次通过凸透镜聚光引燃铝盒中的白磷,白磷燃烧,待白磷熄灭装置冷却后,打开弹簧夹,量筒中的水进入集气瓶,量筒内剩余20mL水。
根据以上现象,回答下列问题:
(5)写出白磷燃烧的文字表达式:__________。
(6)若根据步骤③的数据计算氧气的体积分数,则此时氧气的体积分数为_______________(列出计算式),结果偏小;
(7)步骤④中铝盒中的白磷燃烧,说明集气瓶中___(填“是”/“否”)还有氧气,所以步骤③中测定结果偏小的原因是_________。
三、计算题
18.高铁酸钾(K2FeO4)是一种集吸附、凝聚、杀菌等多功能的新型、高效能水处理剂。198℃以下时能稳定存在,但受热易分解(4K2FeO4=2Fe2O3+4K2O+3O2↑)、遇水将变质(4K2FeO4+10H2O
4Fe(OH)3
+8KOH+3O2↑)。为检测实验室新买的高铁酸钾固体样品中高铁酸钾的质量分数,某同学取10g样品进行实验,共收集到氧气0.96g。试通过计算求该样品中高铁酸钾的质量分数。_____
(K2FeO4的相对分子质量为198)
19.为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取10g样品加热(杂质不反应),剩余固体质量(纵坐标)与加热时间(横坐标)的关系如下图所示:
(1)t0至t1时间段,固体质量不变的原因是__________。
(2)求样品中高锰酸钾的质量分数是多少_________?(写出计算过程)
20.将铜、氧化铜、氢氧化铜混合粉末25g在加热条件下用氢气还原,反应完全后,测得有0.5g氢气参加了反应,同时有6.3g水生成。试计算该混合物中铜、氧化铜、氢氧化铜各多少克。
四、推断题
21.在如图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用,C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质图中部分生成物已省略.
用化学式表示:D______??G______
写出E与F反应的化学方程式______
光合作用生成的淀粉在人体内变成葡萄糖,葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式______.
22.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。
己知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是_________;
(2)C的化学式为_________;
(3)B转化为D的化学方程式为__________________。
参考答案
1.A
2.D
3.A
4.D
5.B
6.D
7.C
8.D
9.B
10.A
11.D
12.B
13.A
14.D
15.4P+5O22P2O5
烧杯中的水沿导管进入广口瓶,水的体积约占广口瓶容积的1/5
引流
滤纸破损(或过滤时液面超过滤纸上缘)
可燃物与氧气(或空气)接触
温度达到可燃物的着火点
偏大
16.2HCl+CaCO3=CaCl2+H2O+CO2↑或
温度达到可燃物着火点,可燃物与氧气接触
节约药品(合理即可)
17.40
相同时间内注射器收集氧气的体积
温度升高,水受热变为水蒸气
洗涤
干燥
磷+氧气五氧化二磷
是
集气瓶下部仍有氧气未消耗完
18.解:设10g高铁酸钾固体样品中含高铁酸钾质量为X
4K2FeO4
△
2Fe2O3+4K2O+3O2↑)
792
96
X
0.96g
792:96=X:0.96g
X=7.
92g
7.92g÷10g×100%=79.2%
答:该样品中高铁酸钾的质量分数为79.2%
说明:用化学方程式4K2FeO4+10H2O=4Fe(OH)
3+8KOH+3O2↑解题也行。
19.刚刚开始加热未达到高锰酸钾的分解温度.(高锰酸钾还未开始分解或反应也可以)
79%
20.铜、氧化铜、氢氧化铜质量分别为3.2g、12g、9.8g
21.C
22.用作干燥剂
Ca(OH)2
CaO+2HCl=CaCl2+H2O
一、单选题
1.根据化学方程式:2Na2S2O4
=Na2S2O3+X+SO2↑,推断X的化学式为(
)
A.Na2SO3
B.Na2SO4
C.Na2S
D.SO2
2.火的使用标志着人类文明的伟大进步,下列说法不正确的是
A.烧锅炉用的煤加工成粉末状,是为了增大煤与氧气的接触面积促进燃烧
B.炒菜时油锅着火,立即盖上锅盖,使可燃物隔绝氧气而灭火
C.发现家中天然气或者液化气泄漏时,应先关闭阀门,并开窗通风
D.当可燃物的温度达到着火点时即可燃烧
3.已知反应,则Z中X与Y原子个数比是(
)
A.
B.
C.
D.
4.在化学反应C+O2CO2中,下列说法正确的是( )
A.碳加氧气等于二氧化碳
B.反应前后分子的种类和数目不变
C.反应前后元素的数目不变
D.反应前后原子的种类和数目不变
5.下列物质的化学式书写正确的是
A.氧化铁:FeO
B.氢氧化镁:Mg(OH)2
C.氯化铵:NH3Cl
D.碳酸:CO3
6.下列对四类化学基本观念的认识错误的是(
)
A.元素观:金刚石和石墨均由碳元素组成
B.分类观:从组成上看干冰和酒精都属于化合物
C.能量观:氢气和天然气都会放出大量的热
D.守恒观:水电解前后,分子的种类和质量均不变
7.下列化学方程式中,书写正确的是( )
A.
B.
C.
D.
8.下列现象或事实与相应的解释不一致的是
事实
解释
A
木炭燃烧能生成一氧化碳或二氧化碳
反应物的量不同,生成物可能不同
B
二氧化碳与水反应生成碳酸,但在光照的条件下生成葡萄糖和氧气
反应的条件不同,产物不一样
C
冰水混合物属于纯净物
冰、水由同种分子构成
D
液氧和氧气的颜色不同
同种分子在不同温度时,颜色不同
A.A
B.B
C.C
D.D
9.如图所示,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部,下列实验现象或结论错误的是
A.实验中使用铜片,是利用了铜的导热性
B.实验说明燃烧的条件之一是物质必须是可燃物
C.铜片受热的一面变黑,是因为产生了CuO
D.实验过程中乒乓球碎片先燃烧,滤纸碎片后燃烧
10.2017年在贵阳举行了以“走向生态文明新时代共享绿色红利”为主题的生态文明国际研讨会。下列做法符合这一主题的是( )
A.节约用纸,用电子贺卡代替纸质贺卡
B.大量使用农药和化肥
C.禁止使用煤石油
D.提倡城市私家车的广泛使用
11.下列实验中物质鉴别利用提供的方案不能达到目的是(
)
选项
物质鉴别
实验方案
A
水和过氧化氢溶液
加入二氧化锰,观察有无气泡冒出
B
鉴别氮气和氧气
将带火星的木条插入集气瓶中,看是否复燃
C
硬水和软水
加入肥皂水
D
CO
和
CO2
闻气味
A.A
B.B
C.C
D.D
12.学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是()
A.原子中核内质子数和核外电子数一定相等
B.中和反应中参加反应的酸和碱的质量一定相等
C.溶液稀释前后溶质的质量一定相等
D.物质发生化学变化前后,元素的种类一定相等
13.乙醇汽油是在汽油中加入适量酒精混合而成的一种燃料。乙醇(用X表示)完全燃烧的化学方程式为X+3O22CO2+3H2O。推断乙醇的化学式为
A.C2H6O
B.C3H8
C.C2H6
D.C4H6O2
14.下图表示治理汽车尾气所涉及反应的微观过程。下列说法不正确的是( )
A.图中单质的化学式为
B.该反应使有害气体转化为无害气体
C.参加反应的两种分子的个数比为
D.生成的单质与化合物的质量比为
二、实验题
15.下列是初中化学教材常见的实验装置图,请根据要求回答下列问题:
(1)A实验广口瓶中发生反应的化学方程式是_____;打开止水夹后,观察到的现象是_____。
(2)B实验中玻璃棒的作用是_____;如果过滤后的液体仍然浑浊,可能的原因是_____(写一条)。
(3)C实验中铜片上白磷与水下白磷的现象对比可知燃烧的条件之一是_____;铜片上白磷与红磷的现象对比可知燃烧的条件之一是_____。
(4)用D实验中的操作量取蒸馏水,将导致所配溶液的溶质质量分数_____(填“偏大”或“偏小”)。
16.某化学兴趣小组的同学利用如图微型实验装置进行探究实验。
(1)写出一个双球管中可能反应的化学方程式_____
(2)挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件_____
(3)用此装置进行实验的优点_____。
17.化学是一门以实验为基础的科学,在前面两个单元的学习中,同学们对于一些实验有了新的想法。
实验一:小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
实验1
实验2
MnO2的质量/克
0.5
0.5
5%的H2O2的体积/毫升
40
待填
水浴温度/℃
20
80
(1)实验2中应加入5%H2O2__________毫升。
(2)在两次实验中,可通过_______来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有_______。
(4)实验结束后若要将MnO2从混合物汇总分离出来,可采取的操作是过滤、_____、_____。
实验二:在测定空气氧气含量实验中,部分同学发现如果燃烧匙位置太靠上,会导致测定结果偏小。针对这一结果,同学们设计了如图的实验。实验步骤如下:
①连接好仪器,检查装置气密性,气密性良好;
②装好药品,瓶底倒入50mL水,量筒内装有50mL水(集气瓶容积为200mL)
③通过凸透镜聚光引燃燃烧匙中的白磷,白磷燃烧,待白磷熄灭装置冷却后,打开弹簧夹,量筒中的水进入集气瓶,量筒剩余30mL水;
④再次通过凸透镜聚光引燃铝盒中的白磷,白磷燃烧,待白磷熄灭装置冷却后,打开弹簧夹,量筒中的水进入集气瓶,量筒内剩余20mL水。
根据以上现象,回答下列问题:
(5)写出白磷燃烧的文字表达式:__________。
(6)若根据步骤③的数据计算氧气的体积分数,则此时氧气的体积分数为_______________(列出计算式),结果偏小;
(7)步骤④中铝盒中的白磷燃烧,说明集气瓶中___(填“是”/“否”)还有氧气,所以步骤③中测定结果偏小的原因是_________。
三、计算题
18.高铁酸钾(K2FeO4)是一种集吸附、凝聚、杀菌等多功能的新型、高效能水处理剂。198℃以下时能稳定存在,但受热易分解(4K2FeO4=2Fe2O3+4K2O+3O2↑)、遇水将变质(4K2FeO4+10H2O
4Fe(OH)3
+8KOH+3O2↑)。为检测实验室新买的高铁酸钾固体样品中高铁酸钾的质量分数,某同学取10g样品进行实验,共收集到氧气0.96g。试通过计算求该样品中高铁酸钾的质量分数。_____
(K2FeO4的相对分子质量为198)
19.为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取10g样品加热(杂质不反应),剩余固体质量(纵坐标)与加热时间(横坐标)的关系如下图所示:
(1)t0至t1时间段,固体质量不变的原因是__________。
(2)求样品中高锰酸钾的质量分数是多少_________?(写出计算过程)
20.将铜、氧化铜、氢氧化铜混合粉末25g在加热条件下用氢气还原,反应完全后,测得有0.5g氢气参加了反应,同时有6.3g水生成。试计算该混合物中铜、氧化铜、氢氧化铜各多少克。
四、推断题
21.在如图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用,C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质图中部分生成物已省略.
用化学式表示:D______??G______
写出E与F反应的化学方程式______
光合作用生成的淀粉在人体内变成葡萄糖,葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式______.
22.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。
己知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是_________;
(2)C的化学式为_________;
(3)B转化为D的化学方程式为__________________。
参考答案
1.A
2.D
3.A
4.D
5.B
6.D
7.C
8.D
9.B
10.A
11.D
12.B
13.A
14.D
15.4P+5O22P2O5
烧杯中的水沿导管进入广口瓶,水的体积约占广口瓶容积的1/5
引流
滤纸破损(或过滤时液面超过滤纸上缘)
可燃物与氧气(或空气)接触
温度达到可燃物的着火点
偏大
16.2HCl+CaCO3=CaCl2+H2O+CO2↑或
温度达到可燃物着火点,可燃物与氧气接触
节约药品(合理即可)
17.40
相同时间内注射器收集氧气的体积
温度升高,水受热变为水蒸气
洗涤
干燥
磷+氧气五氧化二磷
是
集气瓶下部仍有氧气未消耗完
18.解:设10g高铁酸钾固体样品中含高铁酸钾质量为X
4K2FeO4
△
2Fe2O3+4K2O+3O2↑)
792
96
X
0.96g
792:96=X:0.96g
X=7.
92g
7.92g÷10g×100%=79.2%
答:该样品中高铁酸钾的质量分数为79.2%
说明:用化学方程式4K2FeO4+10H2O=4Fe(OH)
3+8KOH+3O2↑解题也行。
19.刚刚开始加热未达到高锰酸钾的分解温度.(高锰酸钾还未开始分解或反应也可以)
79%
20.铜、氧化铜、氢氧化铜质量分别为3.2g、12g、9.8g
21.C
22.用作干燥剂
Ca(OH)2
CaO+2HCl=CaCl2+H2O
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
