11.1 生活中常见的盐(第2课时)(课件24页)
文档属性
| 名称 | 11.1 生活中常见的盐(第2课时)(课件24页) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-03 09:58:01 | ||
图片预览







文档简介
(共24张PPT)
第十一单元
盐
化肥
人教版
初中化学
课题1
生活中常见的盐(第2课时)
知识与技能:
1、了解CaCO3、Na2CO3、NaHCO3的组成及其在生产、
生活中的主要用途
2、了解碳酸盐的性质
3、理解复分解反应的概念及其发生的条件
过程与方法:
1、利用已知物质的性质对陌生物质进行探究
2、根据已知物质的用途分析物质的性质
情感态度与价值观:
1、通过对碳酸盐的学习进一步体会
“生活中处处有
化学”,“生活离不化学”,“化学可服务于生活”
2、通过实验探究培养学生严谨的态度及合作精神
教学目标:
1、碳酸钠(Na2CO3)
俗称:纯碱、苏打
白色粉末状物质,易溶于水,水溶液显碱性
三、几种常见的碳酸盐
纯碱不是碱,而是盐
用途:
广泛用于玻璃、造纸、纺织、洗涤剂的生产等
2、碳酸氢钠(NaHCO3)
俗称:小苏打,白色粉末,较易溶于水。水溶液呈碱性
用途::焙制糕点、发酵粉、治疗胃酸过多症
碳酸钙
3、碳酸钙(CaCO3)
俗称:石灰石、大理石。白色固体,难溶于水。
建筑材料。石灰石是制生石灰的原料(CaCO3
CaO+
CO2↑)。
碳酸钙还可用作补钙剂。
高温
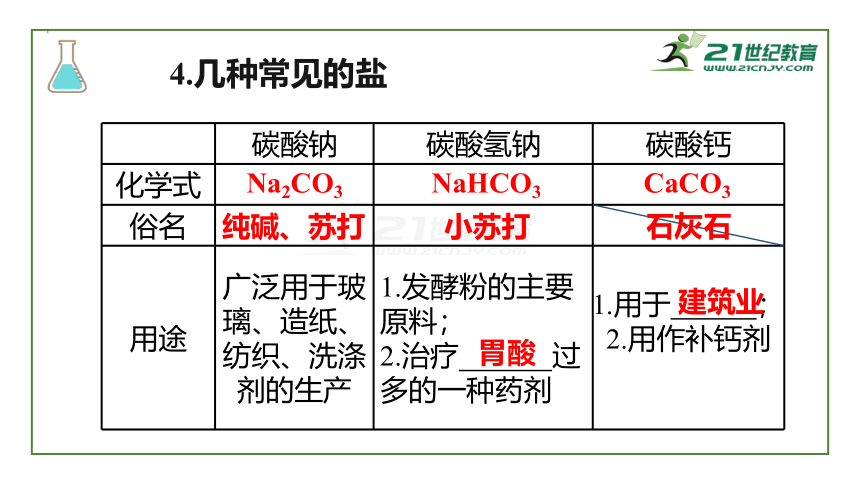
4.几种常见的盐
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗名
石灰石
用途
广泛用于玻璃、造纸、纺织、洗涤剂的生产
1.发酵粉的主要原料;
2.治疗
过多的一种药剂
1.用于
;2.用作补钙剂
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
胃酸
建筑业
实验室
制取二氧化碳
反应原理是
大理石和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2
碳酸钠可以吗?碳酸氢钠呢?
实验
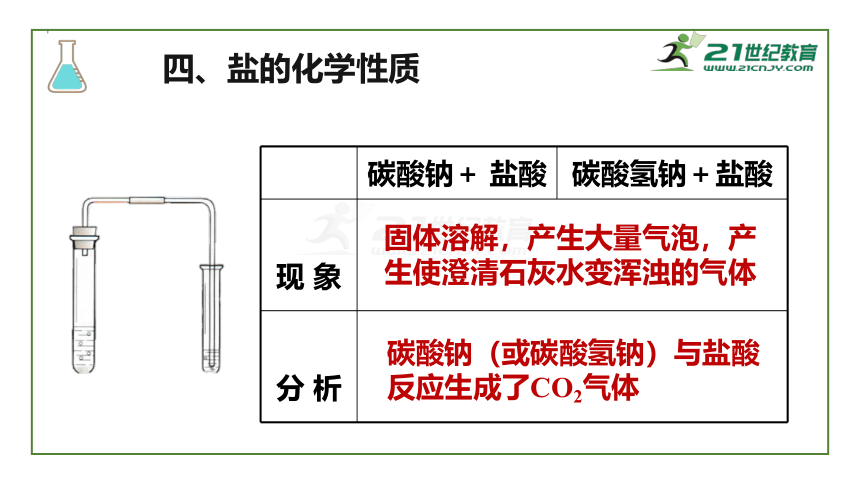
1.碳酸钠+盐酸
2.碳酸氢钠+盐酸
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
固体溶解,产生大量气泡,产生使澄清石灰水变浑浊的气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
四、盐的化学性质
写出上述有关化学方程式。
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+H2O
NaHCO3
+
HCl
=
NaCl
+
CO2
+
H2O
CaCO3
+
2HCl
=
CaCl2
+
CO2
+
H2O
↑
↑
通式:
盐
+
酸
=
新盐
+
新酸
1.CO32-的检验
CaCO3
+
2HCl
==
CaCl2
+
H2O
+
CO2↑
Na2CO3
+
2HCl==2NaCl
+
H2O
+
CO2↑
某物质
+HCl
产生气体
变浑浊
+Ca(OH)2
CO2
CaCO3
碳酸盐
2.CO32-检验方法?
向待测液中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,石灰水变浑浊,则待测液中含有CO32-(碳酸根离子)
碳酸钠+
氢氧化钙
现
象
化学方程式
溶液变浑浊
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象
通式:
盐
+
碱
=
新盐
+
新碱
根据以上反应,总结一下什么叫复分解反应?
1、定义:在溶液中,两种化合物相
互交换成分,生成另外两种化合物的反应
复分解反应
2、表达式:AB
+
CD
AD
+
CB
3、特点:
双交换,价不变
五.
复分解反应发生的条件:
Cu(OH)2
+
2HCl
=
CuCl2
+
2H2O
HCl
+
AgNO3
=
AgCl
↓
+
HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2O
↓
↑
酸碱盐溶解性记忆口诀
盐酸不溶氯化银,硫酸不溶铅和钡,
钾钠铵盐硝酸盐,完全溶于水中间,
碱溶钾钠钡和钙
复分解反应条件
两种化合物交换成分后,有H2O、气体(↑)、沉淀(↓)三者中的至少一种生成,复分解反应才可以发生。
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的
大厦,这位先驱者就是被称为“国
宝”的侯德榜。
侯德榜一生在化工技术上有
三大贡献。第一,揭开了苏尔维
法的秘密。第二,创立了中国人
自己的制碱工艺——侯氏制碱法。
第三,就是他为发展小化肥工业所做的贡献。
六、石灰石和石灰岩地区的溶洞
溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
资料:石笋和钟乳石的形成
CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑
1、下列各组物质两两混合能发生复分解反应的是(
)
A、NaOH、KCl
B、NaNO3、KCl
C、K2SO4、NaOH
D、CuSO4、NaOH
2、下列物质在同一溶液中能大量共存的(
)
A、CuSO4、Ca(OH)2、NaCl
B、Na2SO4、KOH、HNO3
C、BaCl2、NaOH
、KNO3
D、Na2CO3、HCl、KCl
D
C
达标测评
3.
下列有关常见的盐的说法中错误的是
(
)
A.Na2CO3的俗名叫烧碱
B.CaCO3是大理石的主要成分
C.盐是一类物质的总称
D.NaHCO3可用于治疗胃酸过多
氢氧化钠NaOH
碳酸钠Na2CO3
俗名
烧碱、火碱、苛性钠
纯碱、苏打
A
4.下列各组物质中,按酸、碱、盐顺序排列的是(
)
A.KNO3、NaOH、HCl
B.Ca(OH)2、HCl、NaCl
C.H2SO4、Na2CO3、Ba(OH)2
D.HNO3、KOH、CuSO4
D
1、碳酸钙、碳酸钠、碳酸氢钠的化学性质:
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
Na2CO3+2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3+
HCl
=
NaCl
+
H2O
+
CO2↑
Na2CO3+Ca(OH)2
=
CaCO3↓+
NaOH
由两种化合物互相交换成分,生成另外两种化合物的反应。
2、复分解反应:
3、复分解反应的条件:
有H2O、↑、↓三者中的至少一种生成。
4、酸碱盐溶解性记忆口诀:
钾钠铵盐硝酸盐,完全溶于水中间,
盐酸不溶氯化银,硫酸不溶铅和钡,
碱溶钾钠钡和钙
课堂小结
第十一单元
盐
化肥
人教版
初中化学
课题1
生活中常见的盐(第2课时)
知识与技能:
1、了解CaCO3、Na2CO3、NaHCO3的组成及其在生产、
生活中的主要用途
2、了解碳酸盐的性质
3、理解复分解反应的概念及其发生的条件
过程与方法:
1、利用已知物质的性质对陌生物质进行探究
2、根据已知物质的用途分析物质的性质
情感态度与价值观:
1、通过对碳酸盐的学习进一步体会
“生活中处处有
化学”,“生活离不化学”,“化学可服务于生活”
2、通过实验探究培养学生严谨的态度及合作精神
教学目标:
1、碳酸钠(Na2CO3)
俗称:纯碱、苏打
白色粉末状物质,易溶于水,水溶液显碱性
三、几种常见的碳酸盐
纯碱不是碱,而是盐
用途:
广泛用于玻璃、造纸、纺织、洗涤剂的生产等
2、碳酸氢钠(NaHCO3)
俗称:小苏打,白色粉末,较易溶于水。水溶液呈碱性
用途::焙制糕点、发酵粉、治疗胃酸过多症
碳酸钙
3、碳酸钙(CaCO3)
俗称:石灰石、大理石。白色固体,难溶于水。
建筑材料。石灰石是制生石灰的原料(CaCO3
CaO+
CO2↑)。
碳酸钙还可用作补钙剂。
高温
4.几种常见的盐
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗名
石灰石
用途
广泛用于玻璃、造纸、纺织、洗涤剂的生产
1.发酵粉的主要原料;
2.治疗
过多的一种药剂
1.用于
;2.用作补钙剂
Na2CO3
NaHCO3
CaCO3
纯碱、苏打
小苏打
胃酸
建筑业
实验室
制取二氧化碳
反应原理是
大理石和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2
碳酸钠可以吗?碳酸氢钠呢?
实验
1.碳酸钠+盐酸
2.碳酸氢钠+盐酸
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
固体溶解,产生大量气泡,产生使澄清石灰水变浑浊的气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
四、盐的化学性质
写出上述有关化学方程式。
Na2CO3
+
2HCl
=
2NaCl
+
CO2
↑
+H2O
NaHCO3
+
HCl
=
NaCl
+
CO2
+
H2O
CaCO3
+
2HCl
=
CaCl2
+
CO2
+
H2O
↑
↑
通式:
盐
+
酸
=
新盐
+
新酸
1.CO32-的检验
CaCO3
+
2HCl
==
CaCl2
+
H2O
+
CO2↑
Na2CO3
+
2HCl==2NaCl
+
H2O
+
CO2↑
某物质
+HCl
产生气体
变浑浊
+Ca(OH)2
CO2
CaCO3
碳酸盐
2.CO32-检验方法?
向待测液中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,石灰水变浑浊,则待测液中含有CO32-(碳酸根离子)
碳酸钠+
氢氧化钙
现
象
化学方程式
溶液变浑浊
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象
通式:
盐
+
碱
=
新盐
+
新碱
根据以上反应,总结一下什么叫复分解反应?
1、定义:在溶液中,两种化合物相
互交换成分,生成另外两种化合物的反应
复分解反应
2、表达式:AB
+
CD
AD
+
CB
3、特点:
双交换,价不变
五.
复分解反应发生的条件:
Cu(OH)2
+
2HCl
=
CuCl2
+
2H2O
HCl
+
AgNO3
=
AgCl
↓
+
HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2O
↓
↑
酸碱盐溶解性记忆口诀
盐酸不溶氯化银,硫酸不溶铅和钡,
钾钠铵盐硝酸盐,完全溶于水中间,
碱溶钾钠钡和钙
复分解反应条件
两种化合物交换成分后,有H2O、气体(↑)、沉淀(↓)三者中的至少一种生成,复分解反应才可以发生。
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的
大厦,这位先驱者就是被称为“国
宝”的侯德榜。
侯德榜一生在化工技术上有
三大贡献。第一,揭开了苏尔维
法的秘密。第二,创立了中国人
自己的制碱工艺——侯氏制碱法。
第三,就是他为发展小化肥工业所做的贡献。
六、石灰石和石灰岩地区的溶洞
溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
资料:石笋和钟乳石的形成
CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑
1、下列各组物质两两混合能发生复分解反应的是(
)
A、NaOH、KCl
B、NaNO3、KCl
C、K2SO4、NaOH
D、CuSO4、NaOH
2、下列物质在同一溶液中能大量共存的(
)
A、CuSO4、Ca(OH)2、NaCl
B、Na2SO4、KOH、HNO3
C、BaCl2、NaOH
、KNO3
D、Na2CO3、HCl、KCl
D
C
达标测评
3.
下列有关常见的盐的说法中错误的是
(
)
A.Na2CO3的俗名叫烧碱
B.CaCO3是大理石的主要成分
C.盐是一类物质的总称
D.NaHCO3可用于治疗胃酸过多
氢氧化钠NaOH
碳酸钠Na2CO3
俗名
烧碱、火碱、苛性钠
纯碱、苏打
A
4.下列各组物质中,按酸、碱、盐顺序排列的是(
)
A.KNO3、NaOH、HCl
B.Ca(OH)2、HCl、NaCl
C.H2SO4、Na2CO3、Ba(OH)2
D.HNO3、KOH、CuSO4
D
1、碳酸钙、碳酸钠、碳酸氢钠的化学性质:
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
Na2CO3+2HCl
=
2NaCl
+
H2O
+
CO2↑
NaHCO3+
HCl
=
NaCl
+
H2O
+
CO2↑
Na2CO3+Ca(OH)2
=
CaCO3↓+
NaOH
由两种化合物互相交换成分,生成另外两种化合物的反应。
2、复分解反应:
3、复分解反应的条件:
有H2O、↑、↓三者中的至少一种生成。
4、酸碱盐溶解性记忆口诀:
钾钠铵盐硝酸盐,完全溶于水中间,
盐酸不溶氯化银,硫酸不溶铅和钡,
碱溶钾钠钡和钙
课堂小结
同课章节目录
