课题2 如何正确书写化学方程式
文档属性
| 名称 | 课题2 如何正确书写化学方程式 |

|
|
| 格式 | rar | ||
| 文件大小 | 434.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-05 00:00:00 | ||
图片预览






文档简介
(共17张PPT)
第四章 化学方程式
—— 化学方程式
第 二 课 时
引入课题
描述金属镁在空气中燃烧的过程
1、镁条在空气中燃烧生成氧化镁
2、镁 + 氧气
点 燃
氧化镁
化学方程式
MgO
3、Mg + O2
点 燃
4、2Mg+O2
2MgO
点 燃
1、可以表示出反应物和生成物
2、可以体现出质量守恒定律
生成物
2H2 + O2 2H2O
点燃
一、化学方程式的书写
1、原则:
①、必须遵循客观事实
②、必须遵循质量守恒定律
2、读法:
2KClO3 2KCl + 3O2
MnO2
△
反应物
“和”
“反应条件”
“反应生成”
读作:氢气和氧气在点燃的条件下反应生成水。
通电
3、书写:
①.根据实验事实,在式子的左、右两边写出
反应物、生成物,中间用短线连接。
②.配平化学方程式,并检查。
③.标明化学反应发生的条件,把短线改成等号。
H2 + O2
H2O
2
2
④.注明产物的状态。 a、如果反应物中没有气体,
而生成物中有气体,就要标明“ ”
b、溶液中的反应,如果反应物中没有固体,
而生成物中有固体,就要标明“ ”
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
1.写
2.配
3.等
4.标
H2O +
H2O2
O2
2H2O +
2H2O2
O2↑
MnO2
切记:所配化学式前边的化学计量数
应是最简整数比。
双氧水分解放出氧气
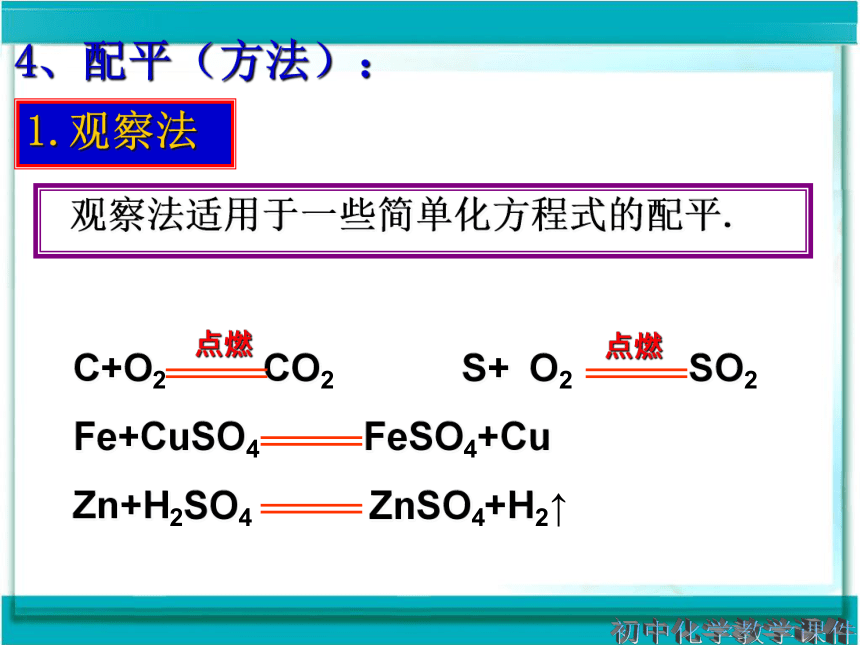
观察法适用于一些简单化方程式的配平.
4、配平(方法):
1.观察法
C+O2 CO2 S+ O2 SO2
Fe+CuSO4 FeSO4+Cu
Zn+H2SO4 ZnSO4+H2↑
点燃
点燃
P + O2 P2O5
2.最小公倍数法
点燃
4
5
2
配平要领:首先找到方程两边各出现一次,并且两边原子
个数相差较多(或最小公倍数较大)的元素,然后
求此元素两边原子个数的最小公倍数。
技巧点拨:对于有氧气参加的化合、分解反应,
通常由氧元素入手配平.
如下例:方程两边原子个数相差较多的元素是氧元素,它们
的最小公倍数是10,因此配10个氧原子即可。
配平过程如下图所示。
3.奇偶配平法
配平要领:首先找到方程两边出现次数最多的元素(多为氧元素),将方程两边该元素的原子为奇数的配成偶数,然后各个配平.
如下例:方程两边出现次数最多的是氧元素,而且只有右边H2O中的氧原子为奇数,先在其前面配2,把它变为偶数,然后配左边CH4前的系数,再配右边CO2前系数,最后配平O2前的系数.
配平过程如下图所示。
CH4+ O2 CO2 + H2O
点燃
2
1
1
2
“1”省略不写
“1”省略不写
↑
奇数
高温
Fe + CO2
4.观察分析法
如下例:生成物CO2中比反应物CO中多一个氧原子,而一个Fe2O3分子被还原为一个Fe原子可提供3个氧原子,因此CO2前面应配3, CO前也应配3,然后再配Fe 、Fe2O3化学式前的系数.
观察分析法是在观察法的基础上对所给化学方程式两边的化学式作进一步的分析、研究、对比,找出两边化学式的差异,然后配平.在配平的过程中,往往要与最小公倍数法结合使用.
Fe2O3 + CO
3
3
2
少1个氧原子
多3个氧原子
1. Al + O2 Al2O3
2. Mg + O2 MgO
3. KClO3 KCl + O2↑
4. Zn + CuSO4 Cu + ZnSO4
5. C2H4 + O2 CO2 + H2O
6. FeO + CO CO2 + H2O
7. Fe3O4 + CO CO2 + H2O
8.Cu2(OH)2CO3 CuO + H2O + CO2 ↑
练习:配平下列化学方程式:
点燃
MnO2
△
△
点燃
△
△
点燃
4.按要求完成下列反应的化学方程式。
(1)白磷自燃
(2)气体打火机中充入的燃料是丁烷(C4H10),
它充分燃烧生成水和二氧化碳
(3)目前,我国运送飞船的火箭所用的燃料是 偏二甲肼(C2H8N2),火箭发射时该燃料与四氧化二氮剧烈反应,生成二氧化碳、水和一种常见的气体单质。
二、化学方程式能提供的信息
2H2 + O2 2H2O
点 燃
①.表明反应物,生成物的元素组成及反应条件。
②.表示反应物和生成物之间的分子个数比。
③.表示各物质间的质量(比)关系。
分子个
数关系
2
1
2
质量
关系
2*2*1
4
2*16
32
2*18
36
:
:
:
:
化 学 式
水
氯酸钾
高锰酸钾
氯化钾
碱式碳酸铜
氧化铜
二氧化锰
锰酸钾
二氧化碳
H2O
KClO3
KCl
CuO
K2MnO4
KMnO4
MnO2
CO2
Cu2(OH)2CO3
五氧化二磷
P2O5
四氧化三铁
Fe3O4
氧化镁
MgO
例2:用化学式表示化学变化:
Mg + O2 MgO
点 燃
S + O2 SO2
点 燃
C + O2 CO2
点 燃
P + O2 P2O5
点 燃
Fe + O2 Fe3O4
点 燃
Hg + O2 HgO
点 燃
HgO Hg + O2
加 热
KMnO4 K2MnO4 + MnO2 + O2
加 热
Cu2 (OH)2CO3 CuO + H2O + CO2
加 热
KClO3 KCl + O2
加 热
MnO2
【作业】
第四章 化学方程式
—— 化学方程式
第 二 课 时
引入课题
描述金属镁在空气中燃烧的过程
1、镁条在空气中燃烧生成氧化镁
2、镁 + 氧气
点 燃
氧化镁
化学方程式
MgO
3、Mg + O2
点 燃
4、2Mg+O2
2MgO
点 燃
1、可以表示出反应物和生成物
2、可以体现出质量守恒定律
生成物
2H2 + O2 2H2O
点燃
一、化学方程式的书写
1、原则:
①、必须遵循客观事实
②、必须遵循质量守恒定律
2、读法:
2KClO3 2KCl + 3O2
MnO2
△
反应物
“和”
“反应条件”
“反应生成”
读作:氢气和氧气在点燃的条件下反应生成水。
通电
3、书写:
①.根据实验事实,在式子的左、右两边写出
反应物、生成物,中间用短线连接。
②.配平化学方程式,并检查。
③.标明化学反应发生的条件,把短线改成等号。
H2 + O2
H2O
2
2
④.注明产物的状态。 a、如果反应物中没有气体,
而生成物中有气体,就要标明“ ”
b、溶液中的反应,如果反应物中没有固体,
而生成物中有固体,就要标明“ ”
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
1.写
2.配
3.等
4.标
H2O +
H2O2
O2
2H2O +
2H2O2
O2↑
MnO2
切记:所配化学式前边的化学计量数
应是最简整数比。
双氧水分解放出氧气
观察法适用于一些简单化方程式的配平.
4、配平(方法):
1.观察法
C+O2 CO2 S+ O2 SO2
Fe+CuSO4 FeSO4+Cu
Zn+H2SO4 ZnSO4+H2↑
点燃
点燃
P + O2 P2O5
2.最小公倍数法
点燃
4
5
2
配平要领:首先找到方程两边各出现一次,并且两边原子
个数相差较多(或最小公倍数较大)的元素,然后
求此元素两边原子个数的最小公倍数。
技巧点拨:对于有氧气参加的化合、分解反应,
通常由氧元素入手配平.
如下例:方程两边原子个数相差较多的元素是氧元素,它们
的最小公倍数是10,因此配10个氧原子即可。
配平过程如下图所示。
3.奇偶配平法
配平要领:首先找到方程两边出现次数最多的元素(多为氧元素),将方程两边该元素的原子为奇数的配成偶数,然后各个配平.
如下例:方程两边出现次数最多的是氧元素,而且只有右边H2O中的氧原子为奇数,先在其前面配2,把它变为偶数,然后配左边CH4前的系数,再配右边CO2前系数,最后配平O2前的系数.
配平过程如下图所示。
CH4+ O2 CO2 + H2O
点燃
2
1
1
2
“1”省略不写
“1”省略不写
↑
奇数
高温
Fe + CO2
4.观察分析法
如下例:生成物CO2中比反应物CO中多一个氧原子,而一个Fe2O3分子被还原为一个Fe原子可提供3个氧原子,因此CO2前面应配3, CO前也应配3,然后再配Fe 、Fe2O3化学式前的系数.
观察分析法是在观察法的基础上对所给化学方程式两边的化学式作进一步的分析、研究、对比,找出两边化学式的差异,然后配平.在配平的过程中,往往要与最小公倍数法结合使用.
Fe2O3 + CO
3
3
2
少1个氧原子
多3个氧原子
1. Al + O2 Al2O3
2. Mg + O2 MgO
3. KClO3 KCl + O2↑
4. Zn + CuSO4 Cu + ZnSO4
5. C2H4 + O2 CO2 + H2O
6. FeO + CO CO2 + H2O
7. Fe3O4 + CO CO2 + H2O
8.Cu2(OH)2CO3 CuO + H2O + CO2 ↑
练习:配平下列化学方程式:
点燃
MnO2
△
△
点燃
△
△
点燃
4.按要求完成下列反应的化学方程式。
(1)白磷自燃
(2)气体打火机中充入的燃料是丁烷(C4H10),
它充分燃烧生成水和二氧化碳
(3)目前,我国运送飞船的火箭所用的燃料是 偏二甲肼(C2H8N2),火箭发射时该燃料与四氧化二氮剧烈反应,生成二氧化碳、水和一种常见的气体单质。
二、化学方程式能提供的信息
2H2 + O2 2H2O
点 燃
①.表明反应物,生成物的元素组成及反应条件。
②.表示反应物和生成物之间的分子个数比。
③.表示各物质间的质量(比)关系。
分子个
数关系
2
1
2
质量
关系
2*2*1
4
2*16
32
2*18
36
:
:
:
:
化 学 式
水
氯酸钾
高锰酸钾
氯化钾
碱式碳酸铜
氧化铜
二氧化锰
锰酸钾
二氧化碳
H2O
KClO3
KCl
CuO
K2MnO4
KMnO4
MnO2
CO2
Cu2(OH)2CO3
五氧化二磷
P2O5
四氧化三铁
Fe3O4
氧化镁
MgO
例2:用化学式表示化学变化:
Mg + O2 MgO
点 燃
S + O2 SO2
点 燃
C + O2 CO2
点 燃
P + O2 P2O5
点 燃
Fe + O2 Fe3O4
点 燃
Hg + O2 HgO
点 燃
HgO Hg + O2
加 热
KMnO4 K2MnO4 + MnO2 + O2
加 热
Cu2 (OH)2CO3 CuO + H2O + CO2
加 热
KClO3 KCl + O2
加 热
MnO2
【作业】
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
