浙教版科学九年级上册章节检测第2章 物质转化与材料利用【含答案】
文档属性
| 名称 | 浙教版科学九年级上册章节检测第2章 物质转化与材料利用【含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 463.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-12-04 14:26:45 | ||
图片预览




文档简介
第二章综合
满分162分
一、单选(本部分共有20道题,共60分)
1.?(3分)对物质进行分类是我们研究物质的便捷途径,现有以下物质:①塑料保鲜膜;②纯碱;③硝酸钾;④铝制易拉罐;⑤高铁的铁轨;⑥我国自主生产的圆珠笔头的圆珠;⑦PET制的矿泉水瓶;⑧磷酸二铵;⑨烧碱。对上述物质分类不正确的是(??? )
? A.?属于复合肥的有③⑧
? B.?属于有机合成材料的有①⑦
? C.?属于金属材料的有④⑤⑥
D.?属于碱的有②⑨
2.?(3分)金属M与AgN03溶液发生反应:M+2AgN03==M(N03)2+2Ag,下列说法不正确的是(??? )
? A.?M不可能是铝
? B.?反应前后M的化合价改变
? C.?M的金属活动性比Ag强
D.?在金属活动性顺序表中,M一定排在氢前
3.?(3分)金属M与Cu( NO3)2溶液发生反应:M+Cu(NO3)2==Cu+M( NO3)2,下列叙述不正确的是(??? )
? A.?金属M不可能是铝
? B.?M一定发生反应:M+2AgNO3==2Ag+M(NO3)2
? C.?若M为镁,恰好完全反应后,溶液质量较反应前减少
D.?恰好完全反应后,M表面有红色固体析出,溶液一定由蓝色变为无色
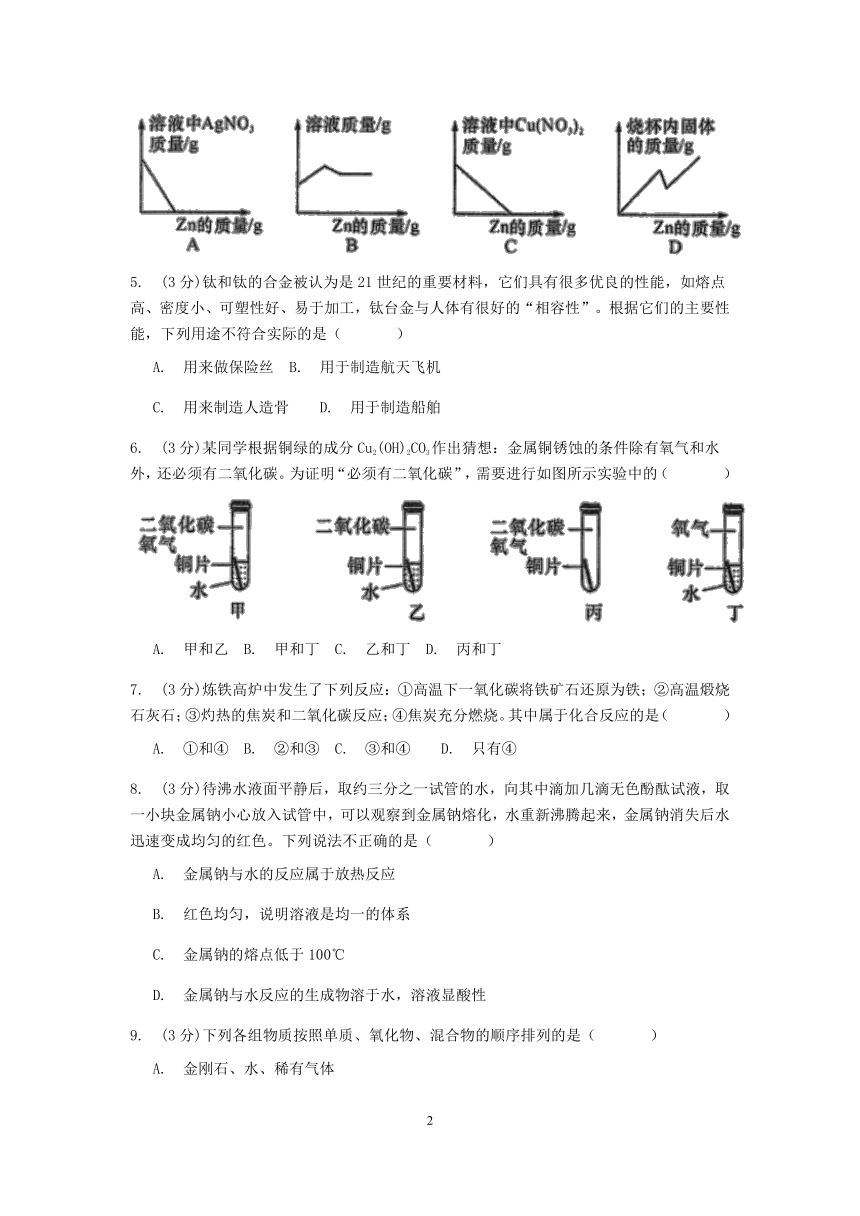
4.?(3分)向盛有Cu(NO3)2和AgNO3混合溶液的烧杯中逐渐加入金属锌。下列图像对应关系正确的是(??? )
5.?(3分)钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛台金与人体有很好的“相容性”。根据它们的主要性能,下列用途不符合实际的是(??? )
A.?用来做保险丝 B.?用于制造航天飞机
? C.?用来制造人造骨? D.?用于制造船舶
6.?(3分)某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的(??? )
? A.?甲和乙 B.?甲和丁 C.?乙和丁 D.?丙和丁
7.?(3分)炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳反应;④焦炭充分燃烧。其中属于化合反应的是(??? )
? A.?①和④ B.?②和③ C.?③和④ ? D.?只有④
8.?(3分)待沸水液面平静后,取约三分之一试管的水,向其中滴加几滴无色酚酞试液,取一小块金属钠小心放入试管中,可以观察到金属钠熔化,水重新沸腾起来,金属钠消失后水迅速变成均匀的红色。下列说法不正确的是(??? )
? A.?金属钠与水的反应属于放热反应
? B.?红色均匀,说明溶液是均一的体系
? C.?金属钠的熔点低于100℃
D.?金属钠与水反应的生成物溶于水,溶液显酸性
9.?(3分)下列各组物质按照单质、氧化物、混合物的顺序排列的是(??? )
A.?金刚石、水、稀有气体
? B.?生铁、二氧化硫、稀硫酸
? C.?氧气、酒精、大理石
? D.?氮气、生石灰、纯碱
10.?(3分)如图所示,为某化学反应的微观模拟示意图,其中表示氧原子,表示碳原子,表示氢原子,则该化学反应中不存在的物质种类是(??? )
? A.?单质 B.?氧化物 C.?盐 ? D.?有机物
11.?(3分)材料在人类生产、生活中有重要的作用。下列有关材料的说法中正确的是(??? )
A.?塑料是最常见的有机合成材料,具有密度小、耐腐蚀、易加工等优点
? B.?棉花和羊毛的主要成分都是蛋白质
? C.?日常生活中使用的有机玻璃、腈纶、蚕丝等都属于合成纤维
? D.?钛合金、玻璃钢、碳纤维复合材料等都属于新型有机合成材料
12.?(3分)从探测“土卫六”发回的信息中得知,“土卫六”酷似地球,经常下“雨”,不过“雨”的成分是液态甲烷。下列叙述中错误的是(??? )
? A.?这种“雨”可以作为燃料来提供能量
? B.?“土卫六”表面的温度比地球表面低
? C.?“土卫六”上形成了甲烷的气一液循环
D.?“土卫六”表面是否存在有机物还无法确定
13.?(3分)我们可以利用物质与物质间的反应制造出新的物质,下列物质间的转化,不能一步实现的是(??? )
? A.?CuC12→Cu B.?NaNO3→NaCl C.?H2SO4→HCl D.?Ba(OH)2→NaOH
14.?(3分)如表是小明同学用两种布法来鉴别物质的情况,其中一种方法错误的是(??? )
15.?(3分)如图所示,“一”表示相连的两种物质能发生反应,“一”表示一种物质能转化成另一种物质,部分反应物、生成物及反应条件未标出。下列说法错误的是(??? )
? A.?甲是酸,乙和丙可以是金属
? B.?甲是碳,乙和丙可以是氧化物
C.?甲的物质类别只能是单质或酸
? D.?甲、乙、丙、丁可分属不同类别的物质
16.?(3分)下列分析正确的是(??? )
17.?(3分)据报道,我省某民营企业研发的“天鹊”火箭发动机试车成功,这种火箭发动机用液态氧,液态甲烷作燃料,多项指标达到国际先进水平。下列说法不正确的是(??? )
? A.?甲烷是有机物
? B.?甲烷具有可燃性
C.?液态氧是由氧原子直接构成的
? D.?一定条件下液态氧和液态甲烷能发生化学反应
18.?(3分)有化合价变化的化学反应叫做氧化还原反应,其中化合价升高的物质是还原剂,化合价降低的物质是氧化剂,在“Zn+H2SO4==ZnSO4+H2↑”反应中,还原剂是(??? )
A.?Zn B.?H2SO4 C.?ZnSO4 D.?H2
19.?(3分)推理是一种重要的学习方法。下列推理中正确的是(? )
? A.?置换反应的生成物为单质和化合物,所以有单质和化合物生成的反应一定为置换反应
? B.?单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质
C.?分子、原子都是不带电的微粒,但不带电的微粒不一定都是分子、原子
? D.?酸、碱、盐之间的复分解反应一定有盐生成,则有盐生成的反应一定是酸、碱、盐之间的复分解反应
20.?(3分)黄铁矿的主要成分为二硫化亚铁( FeS2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图;下列说法错误的是(??? )
? A.?反应②不是置换反应,反应③④为化合反应
? B.?反应①中各元素的化合价均发生了改变
? C.?该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收
D.?向制得的100克98%的浓硫酸中加入100克蒸馏水,配制49%的稀硫酸
二、填空(本部分共有6道题,共60分)
21.?(6分)回答下列与金属有关的问题:
(1)生铁和纯铁,硬度较大的是__________;
(2)铝制品其有很好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的__________(用名称或化学式填空)薄膜;
(3)向AgNO3、Cu(NO3)2、NaNO3的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到金属滤渣和无色滤液。则所得滤液中一定含有的溶质是__________。
22.?(12分)某可燃性气体X可能含有H、C、O三种元素中的一种或几种,为探究其成分,某同学按如图所示装置在空气中点燃X(夹持仪器已略去)。已知:无水硫酸铜为白色粉末,遇水变蓝,分析推断:??
(1)若无水硫酸铜变蓝,澄清石灰水未出现浑浊,则X一定含有的元素是__________,X燃烧的化学方程式为__________;
(2)若无水硫酸铜不变色,澄清石灰水出现浑浊,则X一定含有的元素是__________,X燃烧的化学方程式为__________。
(3)若无水硫酸铜变蓝,澄清石灰水出现浑浊,则X一定含有的元素是__________,且X__________(选填字母编号)。
A.只能是纯净物??? B.只能是混合物
C.既可能是纯净物,又可能是混合物
23.?(12分)以化合价为纵坐标,物质类别为横坐标所绘制的图象叫价类图,如图为碳的价类图,例如C点可能表示+2价的碳的氧化物,请回答:
(1)A点所表示的物质是天然气的主要成分,其化学式为__________。
(2)B点对应的物质类别是__________。
(3)D和水反应能生成E,化学方程式为__________,该反应属于基本反应类型中的__________。
(4)若F点表示的物质为含有4种元素的钠盐,该盐的用途有__________(任写一种)。
(5)查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则CO可能具有的性质是__________。
24.?(10分)某溶液中可能含有盐酸、硫酸,硝酸钠、氯化铜中的一种或几种,为了探究其组成,取一定质量的该溶液,向其中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。请回答下列问题。
(1)该溶液中一定含有的溶质是__________,可能含有的溶质是__________。(均填化学式)
(2)请写出上述过程中发生中和反应的化学方程式:__________。
(3)当滴加氢氧化钡溶液至图中b点时,溶液中一定含有的溶质是__________。(填化学式)
(4)所取溶液中含有氯化铜的质量为__________。
25.?(8分)有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、NaCO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定含有__________;可能含有__________;一定不含有__________。
(2)写出步骤②中发生反应的化学方程式:__________。
26.?(12分)波尔多液是一种农药,由Ca(OH)2溶液和CuSO4溶液混合而成。某农场需要大量的波尔多液,农场工人就地取材,利用农场废弃的铜渣(只含有铜和一定量的铁)和附近的石灰石来制作波尔多液。下面是制作波尔多液的工艺流程图:
请回答下列问题:
(1)CaO的俗名是__________,写出由CaO生成Ca(OH)2的化学方程式:__________;
(2)请说出如何由铜渣得到纯净的铜:__________;
(3)B物质是__________,写出由B物质生成CuSO4的化学方程式:__________
(4)将铜渣与Zn按质量比10:1的比例分别加人足量的盐酸溶液中,产生H2的质量恰好相等,铜渣中铜的质量分数是__________。(精确到0.1%)
三、解答题(本部分共有4道题,共42分)
27.?(12分)在探究课上,老师给同学们一包黑色粉末,该粉末是由铁粉和氧化铜粉末中的一种或两种组成。为了确定该粉末的成分,同学们进行如下探究。请回答下列问题:
【猜想假设】(1)黑色粉末是铁粉;
(2)黑色粉末是氧化铜粉末;
(3)黑色粉末是铁粉和氧化铜粉末;
【设计方案】取少量黑色粉末,放入硬质玻璃管中,通人一氧化碳气体,片刻后加热充分反应。(实验装置如图所示)
请填写下表空白:(不考虑铁粉和氧化铜粉末可能发生反应)
【实验结论】经过分析实验现象,确认猜想(3)成立。
【反思评价】
(1)实验完毕后,先停止加热,继续通入一氧化碳直至玻璃管冷却至室温。继续通人一氧化碳的目的是___________________________。
(2)从环保角度上看,上述设置有不足之处,改进措施是______________________。
(3)猜想(2)玻璃管中发生反应的化学方程式是________________________。
28.?(8分)已知:草酸钠固体(化学式为Na2C2O4)加热分解生成碳酸钠和CO。小陆同学利用该反应制取CO,并用CO还原氧化铁。他设计的实验装置如图:
(1)一氧化碳的发生装置可以选择上述所给装置中的_______(填序号)。写出该反应的化学方程式:____________。
(2)L型的硬质玻璃管中的反应现象是_________。
(3)该装置中锥形瓶(足量澄清石灰水)的作用是:
I.检验并吸收生成的CO2
Ⅱ.___________________________。
29.?(12分)实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3·3H2O。其主要实验过程如图:
已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为_________和________。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有____(填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤I”只进行“过滤Ⅱ”____(填“能”或“否”),理由是________________。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是________________________。
30.?(10分)钢铁在生产、生活中有着广泛的应用。
(1)钢铁属于_______(填“纯净物”或“混合物”);钢铁在空气中锈蚀是铁跟空气中的水蒸气和_______共同作用的结果。为了防止钢铁的锈蚀,人们除采用在其表面涂油漆的方法外,还可________(任填一种方法);工业上用稀盐酸除去铁锈(主要成分为Fe2O3),写出该反应的化学方程式:_____________________。
(2)某钢铁厂为分析赤铁矿看中Fe2O3的质量分数:准确称取20g样品,在高温条件下用足量CO气体还原,充分反应(假设其他杂质不与CO反应)后冷却、称重,质量为15.2g。计算该赤铁矿石样品中Fe2O3的质量分数。(写出计算过程)
参考答案
满分162分
一、单选(本部分共有20道题,共60分)
1.?(3分)D
2.?(3分)D
3.?(3分)D
4.?(3分)A
5.?(3分)A
6.?(3分)B
7.?(3分)C
8.?(3分)D
9.?(3分)A
10.?(3分)C
11.?(3分)A
12.?(3分)D
13.?(3分)B
14.?(3分)A
15.?(3分)C
16.?(3分)C
17.?(3分)C
18.?(3分)A
19.?(3分)C
20.?(3分)D
二、填空(本部分共有6道题,共60分)
21.?(6分)(1)生铁 (2)氧化铝或 Al2O3 (3)硝酸钠、硝酸锌
22.?(12分)(1)氢元素;2H2+O2=点燃2H2O (2)碳元素、氧元素2CO+O2=点燃2CO2 (3)碳元素、氢元素;C
23.?(12分)(1)CH4 (2)单质 (3)CO2+H2O==H2CO3;化合反应 (4)治疗胃酸过多或用作发酵粉等(5)既具有氧化性,又具有还原性
24.?(10分)(1)HCl、CuCl2;NaNO3 (2)2HCl+Ba(OH)2==BaCl2+2H2O (3)BaCl2 (4)13.5g
25.?(8分)(1)氢氧化钡、碳酸钠硝酸钾硫酸钠和氯化铁 (2) BaCO3+2HCl==BaCl2+CO2↑十H2O
26.?(12分)(1)生石灰;CaO+H2O==Ca(OH)2 (2)加入足量的稀硫酸,过滤 (3)CuO;CuO+H2SO4==CuSO4+H2O (4)91.4%
三、解答题(本部分共有4道题,共42分)
27.?(12分)
[反思评价](1)防止生成的铜再次被氧化(合理说法均可)(2)在b处放一只燃着的酒精灯(或安装尾气处理装置或在b处导管处绑一个小气球等) (3)CO+CuO=ΔCu+CO2
28.?(8分)(1)C;Na2C2O4=ΔNa2CO3+CO↑ (2)红色粉末变成黑色? (3)收集二氧化碳,防止污染空气
29.?(12分)(1)MgO+H2SO4==MgSO4+H2O MgCO3+H2SO4==MgSO4+H2O+CO2↑(2)Na+;SO42-、CO32-(3)否导致产品不纯(4)避免制备产品消耗更多的碳酸钠
30.?(10分)(1)混合物;氧气;制成合金;FeO3+6HCl==2FeCl3+3H2O (2)80%
满分162分
一、单选(本部分共有20道题,共60分)
1.?(3分)对物质进行分类是我们研究物质的便捷途径,现有以下物质:①塑料保鲜膜;②纯碱;③硝酸钾;④铝制易拉罐;⑤高铁的铁轨;⑥我国自主生产的圆珠笔头的圆珠;⑦PET制的矿泉水瓶;⑧磷酸二铵;⑨烧碱。对上述物质分类不正确的是(??? )
? A.?属于复合肥的有③⑧
? B.?属于有机合成材料的有①⑦
? C.?属于金属材料的有④⑤⑥
D.?属于碱的有②⑨
2.?(3分)金属M与AgN03溶液发生反应:M+2AgN03==M(N03)2+2Ag,下列说法不正确的是(??? )
? A.?M不可能是铝
? B.?反应前后M的化合价改变
? C.?M的金属活动性比Ag强
D.?在金属活动性顺序表中,M一定排在氢前
3.?(3分)金属M与Cu( NO3)2溶液发生反应:M+Cu(NO3)2==Cu+M( NO3)2,下列叙述不正确的是(??? )
? A.?金属M不可能是铝
? B.?M一定发生反应:M+2AgNO3==2Ag+M(NO3)2
? C.?若M为镁,恰好完全反应后,溶液质量较反应前减少
D.?恰好完全反应后,M表面有红色固体析出,溶液一定由蓝色变为无色
4.?(3分)向盛有Cu(NO3)2和AgNO3混合溶液的烧杯中逐渐加入金属锌。下列图像对应关系正确的是(??? )
5.?(3分)钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛台金与人体有很好的“相容性”。根据它们的主要性能,下列用途不符合实际的是(??? )
A.?用来做保险丝 B.?用于制造航天飞机
? C.?用来制造人造骨? D.?用于制造船舶
6.?(3分)某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的(??? )
? A.?甲和乙 B.?甲和丁 C.?乙和丁 D.?丙和丁
7.?(3分)炼铁高炉中发生了下列反应:①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳反应;④焦炭充分燃烧。其中属于化合反应的是(??? )
? A.?①和④ B.?②和③ C.?③和④ ? D.?只有④
8.?(3分)待沸水液面平静后,取约三分之一试管的水,向其中滴加几滴无色酚酞试液,取一小块金属钠小心放入试管中,可以观察到金属钠熔化,水重新沸腾起来,金属钠消失后水迅速变成均匀的红色。下列说法不正确的是(??? )
? A.?金属钠与水的反应属于放热反应
? B.?红色均匀,说明溶液是均一的体系
? C.?金属钠的熔点低于100℃
D.?金属钠与水反应的生成物溶于水,溶液显酸性
9.?(3分)下列各组物质按照单质、氧化物、混合物的顺序排列的是(??? )
A.?金刚石、水、稀有气体
? B.?生铁、二氧化硫、稀硫酸
? C.?氧气、酒精、大理石
? D.?氮气、生石灰、纯碱
10.?(3分)如图所示,为某化学反应的微观模拟示意图,其中表示氧原子,表示碳原子,表示氢原子,则该化学反应中不存在的物质种类是(??? )
? A.?单质 B.?氧化物 C.?盐 ? D.?有机物
11.?(3分)材料在人类生产、生活中有重要的作用。下列有关材料的说法中正确的是(??? )
A.?塑料是最常见的有机合成材料,具有密度小、耐腐蚀、易加工等优点
? B.?棉花和羊毛的主要成分都是蛋白质
? C.?日常生活中使用的有机玻璃、腈纶、蚕丝等都属于合成纤维
? D.?钛合金、玻璃钢、碳纤维复合材料等都属于新型有机合成材料
12.?(3分)从探测“土卫六”发回的信息中得知,“土卫六”酷似地球,经常下“雨”,不过“雨”的成分是液态甲烷。下列叙述中错误的是(??? )
? A.?这种“雨”可以作为燃料来提供能量
? B.?“土卫六”表面的温度比地球表面低
? C.?“土卫六”上形成了甲烷的气一液循环
D.?“土卫六”表面是否存在有机物还无法确定
13.?(3分)我们可以利用物质与物质间的反应制造出新的物质,下列物质间的转化,不能一步实现的是(??? )
? A.?CuC12→Cu B.?NaNO3→NaCl C.?H2SO4→HCl D.?Ba(OH)2→NaOH
14.?(3分)如表是小明同学用两种布法来鉴别物质的情况,其中一种方法错误的是(??? )
15.?(3分)如图所示,“一”表示相连的两种物质能发生反应,“一”表示一种物质能转化成另一种物质,部分反应物、生成物及反应条件未标出。下列说法错误的是(??? )
? A.?甲是酸,乙和丙可以是金属
? B.?甲是碳,乙和丙可以是氧化物
C.?甲的物质类别只能是单质或酸
? D.?甲、乙、丙、丁可分属不同类别的物质
16.?(3分)下列分析正确的是(??? )
17.?(3分)据报道,我省某民营企业研发的“天鹊”火箭发动机试车成功,这种火箭发动机用液态氧,液态甲烷作燃料,多项指标达到国际先进水平。下列说法不正确的是(??? )
? A.?甲烷是有机物
? B.?甲烷具有可燃性
C.?液态氧是由氧原子直接构成的
? D.?一定条件下液态氧和液态甲烷能发生化学反应
18.?(3分)有化合价变化的化学反应叫做氧化还原反应,其中化合价升高的物质是还原剂,化合价降低的物质是氧化剂,在“Zn+H2SO4==ZnSO4+H2↑”反应中,还原剂是(??? )
A.?Zn B.?H2SO4 C.?ZnSO4 D.?H2
19.?(3分)推理是一种重要的学习方法。下列推理中正确的是(? )
? A.?置换反应的生成物为单质和化合物,所以有单质和化合物生成的反应一定为置换反应
? B.?单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质
C.?分子、原子都是不带电的微粒,但不带电的微粒不一定都是分子、原子
? D.?酸、碱、盐之间的复分解反应一定有盐生成,则有盐生成的反应一定是酸、碱、盐之间的复分解反应
20.?(3分)黄铁矿的主要成分为二硫化亚铁( FeS2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图;下列说法错误的是(??? )
? A.?反应②不是置换反应,反应③④为化合反应
? B.?反应①中各元素的化合价均发生了改变
? C.?该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收
D.?向制得的100克98%的浓硫酸中加入100克蒸馏水,配制49%的稀硫酸
二、填空(本部分共有6道题,共60分)
21.?(6分)回答下列与金属有关的问题:
(1)生铁和纯铁,硬度较大的是__________;
(2)铝制品其有很好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的__________(用名称或化学式填空)薄膜;
(3)向AgNO3、Cu(NO3)2、NaNO3的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到金属滤渣和无色滤液。则所得滤液中一定含有的溶质是__________。
22.?(12分)某可燃性气体X可能含有H、C、O三种元素中的一种或几种,为探究其成分,某同学按如图所示装置在空气中点燃X(夹持仪器已略去)。已知:无水硫酸铜为白色粉末,遇水变蓝,分析推断:??
(1)若无水硫酸铜变蓝,澄清石灰水未出现浑浊,则X一定含有的元素是__________,X燃烧的化学方程式为__________;
(2)若无水硫酸铜不变色,澄清石灰水出现浑浊,则X一定含有的元素是__________,X燃烧的化学方程式为__________。
(3)若无水硫酸铜变蓝,澄清石灰水出现浑浊,则X一定含有的元素是__________,且X__________(选填字母编号)。
A.只能是纯净物??? B.只能是混合物
C.既可能是纯净物,又可能是混合物
23.?(12分)以化合价为纵坐标,物质类别为横坐标所绘制的图象叫价类图,如图为碳的价类图,例如C点可能表示+2价的碳的氧化物,请回答:
(1)A点所表示的物质是天然气的主要成分,其化学式为__________。
(2)B点对应的物质类别是__________。
(3)D和水反应能生成E,化学方程式为__________,该反应属于基本反应类型中的__________。
(4)若F点表示的物质为含有4种元素的钠盐,该盐的用途有__________(任写一种)。
(5)查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则CO可能具有的性质是__________。
24.?(10分)某溶液中可能含有盐酸、硫酸,硝酸钠、氯化铜中的一种或几种,为了探究其组成,取一定质量的该溶液,向其中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。请回答下列问题。
(1)该溶液中一定含有的溶质是__________,可能含有的溶质是__________。(均填化学式)
(2)请写出上述过程中发生中和反应的化学方程式:__________。
(3)当滴加氢氧化钡溶液至图中b点时,溶液中一定含有的溶质是__________。(填化学式)
(4)所取溶液中含有氯化铜的质量为__________。
25.?(8分)有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、NaCO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定含有__________;可能含有__________;一定不含有__________。
(2)写出步骤②中发生反应的化学方程式:__________。
26.?(12分)波尔多液是一种农药,由Ca(OH)2溶液和CuSO4溶液混合而成。某农场需要大量的波尔多液,农场工人就地取材,利用农场废弃的铜渣(只含有铜和一定量的铁)和附近的石灰石来制作波尔多液。下面是制作波尔多液的工艺流程图:
请回答下列问题:
(1)CaO的俗名是__________,写出由CaO生成Ca(OH)2的化学方程式:__________;
(2)请说出如何由铜渣得到纯净的铜:__________;
(3)B物质是__________,写出由B物质生成CuSO4的化学方程式:__________
(4)将铜渣与Zn按质量比10:1的比例分别加人足量的盐酸溶液中,产生H2的质量恰好相等,铜渣中铜的质量分数是__________。(精确到0.1%)
三、解答题(本部分共有4道题,共42分)
27.?(12分)在探究课上,老师给同学们一包黑色粉末,该粉末是由铁粉和氧化铜粉末中的一种或两种组成。为了确定该粉末的成分,同学们进行如下探究。请回答下列问题:
【猜想假设】(1)黑色粉末是铁粉;
(2)黑色粉末是氧化铜粉末;
(3)黑色粉末是铁粉和氧化铜粉末;
【设计方案】取少量黑色粉末,放入硬质玻璃管中,通人一氧化碳气体,片刻后加热充分反应。(实验装置如图所示)
请填写下表空白:(不考虑铁粉和氧化铜粉末可能发生反应)
【实验结论】经过分析实验现象,确认猜想(3)成立。
【反思评价】
(1)实验完毕后,先停止加热,继续通入一氧化碳直至玻璃管冷却至室温。继续通人一氧化碳的目的是___________________________。
(2)从环保角度上看,上述设置有不足之处,改进措施是______________________。
(3)猜想(2)玻璃管中发生反应的化学方程式是________________________。
28.?(8分)已知:草酸钠固体(化学式为Na2C2O4)加热分解生成碳酸钠和CO。小陆同学利用该反应制取CO,并用CO还原氧化铁。他设计的实验装置如图:
(1)一氧化碳的发生装置可以选择上述所给装置中的_______(填序号)。写出该反应的化学方程式:____________。
(2)L型的硬质玻璃管中的反应现象是_________。
(3)该装置中锥形瓶(足量澄清石灰水)的作用是:
I.检验并吸收生成的CO2
Ⅱ.___________________________。
29.?(12分)实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3·3H2O。其主要实验过程如图:
已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为_________和________。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有____(填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤I”只进行“过滤Ⅱ”____(填“能”或“否”),理由是________________。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是________________________。
30.?(10分)钢铁在生产、生活中有着广泛的应用。
(1)钢铁属于_______(填“纯净物”或“混合物”);钢铁在空气中锈蚀是铁跟空气中的水蒸气和_______共同作用的结果。为了防止钢铁的锈蚀,人们除采用在其表面涂油漆的方法外,还可________(任填一种方法);工业上用稀盐酸除去铁锈(主要成分为Fe2O3),写出该反应的化学方程式:_____________________。
(2)某钢铁厂为分析赤铁矿看中Fe2O3的质量分数:准确称取20g样品,在高温条件下用足量CO气体还原,充分反应(假设其他杂质不与CO反应)后冷却、称重,质量为15.2g。计算该赤铁矿石样品中Fe2O3的质量分数。(写出计算过程)
参考答案
满分162分
一、单选(本部分共有20道题,共60分)
1.?(3分)D
2.?(3分)D
3.?(3分)D
4.?(3分)A
5.?(3分)A
6.?(3分)B
7.?(3分)C
8.?(3分)D
9.?(3分)A
10.?(3分)C
11.?(3分)A
12.?(3分)D
13.?(3分)B
14.?(3分)A
15.?(3分)C
16.?(3分)C
17.?(3分)C
18.?(3分)A
19.?(3分)C
20.?(3分)D
二、填空(本部分共有6道题,共60分)
21.?(6分)(1)生铁 (2)氧化铝或 Al2O3 (3)硝酸钠、硝酸锌
22.?(12分)(1)氢元素;2H2+O2=点燃2H2O (2)碳元素、氧元素2CO+O2=点燃2CO2 (3)碳元素、氢元素;C
23.?(12分)(1)CH4 (2)单质 (3)CO2+H2O==H2CO3;化合反应 (4)治疗胃酸过多或用作发酵粉等(5)既具有氧化性,又具有还原性
24.?(10分)(1)HCl、CuCl2;NaNO3 (2)2HCl+Ba(OH)2==BaCl2+2H2O (3)BaCl2 (4)13.5g
25.?(8分)(1)氢氧化钡、碳酸钠硝酸钾硫酸钠和氯化铁 (2) BaCO3+2HCl==BaCl2+CO2↑十H2O
26.?(12分)(1)生石灰;CaO+H2O==Ca(OH)2 (2)加入足量的稀硫酸,过滤 (3)CuO;CuO+H2SO4==CuSO4+H2O (4)91.4%
三、解答题(本部分共有4道题,共42分)
27.?(12分)
[反思评价](1)防止生成的铜再次被氧化(合理说法均可)(2)在b处放一只燃着的酒精灯(或安装尾气处理装置或在b处导管处绑一个小气球等) (3)CO+CuO=ΔCu+CO2
28.?(8分)(1)C;Na2C2O4=ΔNa2CO3+CO↑ (2)红色粉末变成黑色? (3)收集二氧化碳,防止污染空气
29.?(12分)(1)MgO+H2SO4==MgSO4+H2O MgCO3+H2SO4==MgSO4+H2O+CO2↑(2)Na+;SO42-、CO32-(3)否导致产品不纯(4)避免制备产品消耗更多的碳酸钠
30.?(10分)(1)混合物;氧气;制成合金;FeO3+6HCl==2FeCl3+3H2O (2)80%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
