初中化学人教版九年级上册第五单元课题3利用化学方程式的简单计算练习题-普通用卷(含解析)
文档属性
| 名称 | 初中化学人教版九年级上册第五单元课题3利用化学方程式的简单计算练习题-普通用卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 115.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-05 18:03:39 | ||
图片预览




文档简介
初中化学人教版九年级上册第五单元课题3利用化学方程式的简单计算练习题
一、单选题
在“”的反应中,已知8g?物质A完全反应生成11g?物质C和9g物质若A的相对分子质量为32,则物质B的相对分子质量
A.
64
B.
48
C.
32
D.
16
某和组成的混合物中钾元素的质量分数为,将该混合物加热至固体质量不再改变,下列有关说法错误的是
A.
加热后固体中钾元素的质量分数增加
B.
共生成氧气
C.
加热后,剩余固体的质量为
D.
原混合物中的质量为
制取71克五氧化二磷,需要磷_______克,需要烧氧气_______克
A.
30克?30克
B.
30克40克
C.
31克40克
D.
40克31克
将氯酸钾和二氧化锰均匀混合物分成两份,第一份14g加热至完全反应后,得固体,第二份21g加热一段时间后,测得剩余固体中二氧化锰占可得氧气质量是
A.
B.
C.
D.
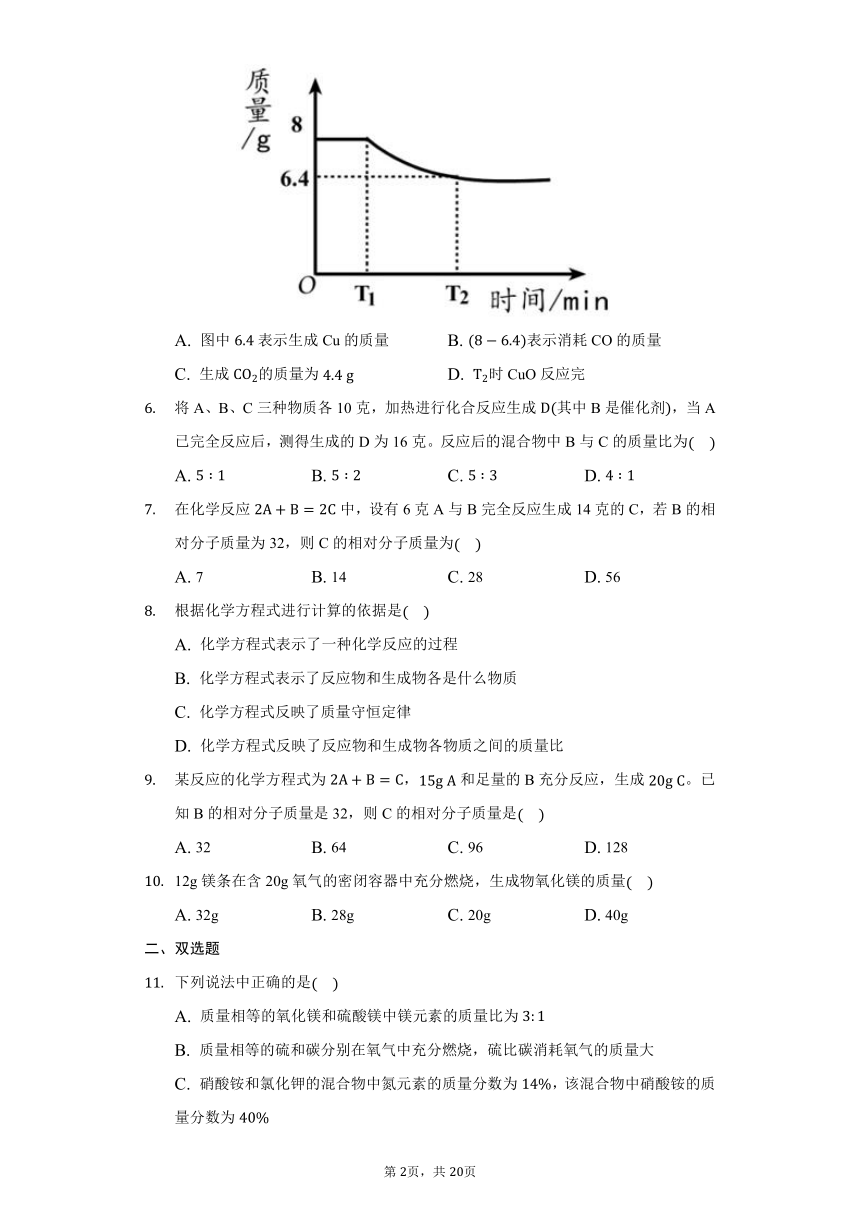
已知:。若被CO完全反应,有关量的变化如下图,下列分析不正确的是?
?
A.
图中表示生成Cu的质量
B.
表示消耗CO的质量
C.
生成的质量为
D.
时CuO反应完
将A、B、C三种物质各10克,加热进行化合反应生成其中B是催化剂,当A已完全反应后,测得生成的D为16克。反应后的混合物中B与C的质量比为
A.
B.
C.
D.
在化学反应中,设有6克A与B完全反应生成14克的C,若B的相对分子质量为32,则C的相对分子质量为
A.
7
B.
14
C.
28
D.
56
根据化学方程式进行计算的依据是
A.
化学方程式表示了一种化学反应的过程
B.
化学方程式表示了反应物和生成物各是什么物质
C.
化学方程式反映了质量守恒定律
D.
化学方程式反映了反应物和生成物各物质之间的质量比
某反应的化学方程式为,和足量的B充分反应,生成。已知B的相对分子质量是32,则C的相对分子质量是
A.
32
B.
64
C.
96
D.
128
12g镁条在含20g氧气的密闭容器中充分燃烧,生成物氧化镁的质量
A.
32g
B.
28g
C.
20g
D.
40g
二、双选题
下列说法中正确的是
A.
质量相等的氧化镁和硫酸镁中镁元素的质量比为
B.
质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大
C.
硝酸铵和氯化钾的混合物中氮元素的质量分数为,该混合物中硝酸铵的质量分数为
D.
质量和质量分数均相等的氢氧化钠溶液和稀硫酸充分反应后,向所得溶液中滴加硫酸铜溶液,不会出现蓝色沉淀
在如图所示的密闭容器中有一个理想活塞滑动自如,且密封性绝对可靠,处在容器体积的处;其中,的部分充的是空气,另的部分充的是和的混合气体;当后者用电火花点燃引爆时,活塞先被冲到左边;而当容器内的气体逐渐恢复到原来的温度时,活塞渐渐向右边移动,最终停在容器容积的处,则原来的氢气和氧气的体积比可能是
A.
8:1
B.
7:2
C.
4:5
D.
2:7
下列说法正确的是
A.
质量和质量分数均相等的氢氧化钠溶液与稀硫酸充分反应,所得溶液呈酸性
B.
等质量的二氧化硫和三氧化硫中硫元素的质量比为5:4
C.
硝酸镁样品只含有一种杂质溶于水,与足量的氢氧化钠溶液充分反应后生成沉淀,则样品中可能含有的杂质是硫酸镁
D.
向一定量的氧化铁与氧化铜的混合物中加入100g质量分数为稀硫酸,恰好完全反应,则原混合物中氧元素的质量是
有和的混合溶液,先向其中滴加溶液,再滴加的NaOH溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是?
???
A.
a点溶液呈中性
B.
段只发生了1个反应
C.
c点对应的沉淀有2种,
D.
原混合溶液中铁、硫元素质量比是
有Mg、Fe、Zn的混合物共,与足量盐酸反应,生成的质量可能是
A.
B.
C.
D.
三、填空题
乙醇可作燃料。现有一定量的乙醇与一定量的氧气混合于密闭容器内,在一定条件下反应生成水,同时得到一氧化碳和二氧化碳的混合物,参加反应的乙醇的质量为_________g,混合物中一氧化碳与二氧化碳的质量比为_____________填最简比。
碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为
______________?。充分加热含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为,则该反应生成水和二氧化碳的质量之和为
______________???g。
我国化学家侯德榜所发明的侯氏制碱法,为世界制碱事业发展做出重大贡献,其反应原理如下:。请计算:
碳酸氢钠中原子的个数比:H:C:为____________。
碳酸氢钠中钠元素的质量分数为____________。结果保留
要生产吨碳酸氢钠,理论上需要氯化钠的质量是多少吨写出计算过程
在反应中,已知A和B的相对分子质量之比为,当与一定量B恰好完余反应后,生成,则生成C的质量为_____g。
四、计算题
有一种石灰石样品的成分是碳酸钙和二氧化硅,某课外小组同学将200克盐酸分5次加入到70克石灰石样品中已知不与盐酸反应,得到如下部分数据和图象。
次数
第1次
第2次
第3次
加入盐酸的质量
40
40
40
剩余固体的质量
60
a
40
请计算:
的值为
______
。
求反应后生成二氧化碳的质量。
将由木炭粉和氧化铜组成的混合物充分加热,其中木炭完全反应,反应结束后将剩余物冷却,称得固体质量为已知生成物只有二氧化碳和铜,请计算:反应前混合物中氧化铜的质量分数为多少?结果准确到
长征五号,于2016年11月3日20时43分在文昌卫星发射中心成功发射升空,成为我国运载能力最大的火箭.“长征五号”运载火箭也称“冰箭”,因为火箭肚子里装了满满的深低温液氢、液氧燃料.请计算每1千克液态氢充分燃烧需要的助燃剂液态氧的质量是多少
向装有36g过氧化氢溶液的烧杯中加入二氧化锰,充分反应后,烧杯内物质的质量为,则
生成的氧气的质量是多少?
参加反应的过氧化氢质量为多少?
答案和解析
1.【答案】C
【解析】
【分析】
本题是考查质量守恒定律的应用,根据质量守恒定律求算生成的B的质量,进而根据A、B的质量以及A的相对分子质量和对应化学方程式求算B的相对分子质量。
【解答】
依据质量守恒定律可知参加反应的B的质量是,
设B的相对分子质量是x,
?
?
?3x
?
?8g?
12g
?
?,
故C正确。
故选C。
2.【答案】B
【解析】解:反应前后钾元素的质量不变,混合物的质量加热后减少,所以加热后固体中钾元素的质量分数增加,故A正确;
B.混合物中氯酸钾的质量为:,
设氯酸钾完全反应生成氧气的质量为x。
?245?
?
?
?
?
?
?
?
?
?
?
?
96
?
?
?
?
?
?
?
?
?
?
?x
故B错误;
C.加热后,剩余固体的质量为:,故C正确;
D.原混合物中的质量为:,故D正确。
故选:B。
本题考查化学方程式的有关计算,根据特定元素的守恒进行灵活的计算,难度中等。
3.【答案】C
【解析】解:设参加反应的磷的质量为x,消耗的氧气的质量为y
124???
160?????
284
x????????
y?????????
71g
故选:C。
根据生成的五氧化二磷的质量和对应的化学方程式求算磷和氧气的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.【答案】C
【解析】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变。
将氯酸钾和二氧化锰均匀混合物分成两份,第一份14g加热至完全反应后,得固体,由质量守恒定律,生成氧气的质量为。
设14g混合物中氯酸钾的质量为x
?
245???????????????????????
?96
??
x???????????????????????????
???????
二氧化锰的质量分数为。
21g混合物中二氧化锰的质量为:。
所剩固体的质量为。
根据质量守恒定律生成的质量是:。
故选:C。
根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,由质量守恒定律,计算出第一份生成氧气的质量,进而计算出二氧化锰的质量分数,由二氧化锰作催化剂反应前后质量不变,进行分析解答。
本题难度不大,明确二氧化锰作催化剂反应前后质量不变、掌握化学方程式的有关计算是正确解答本题的关键。
5.【答案】B
【解析】
【分析】
本题考查了一氧化碳还原氧化铜的实验以及根据化学方程式的计算,完成此题,可以依据已有的知识结合反应的化学方程式进行。
【解答】
A.设生成铜的质量为x,则:
?
?
?
?
?80
?
?
?64
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??
?
?
?
?
8g
?
?
?
x
即8g氧化铜被完全还原后得到铜的质量为,故正确;
B.由可知固体减少的质量为氧化铜中氧的质量,而不是消耗CO的质量,故错误;
C.设生成的质量为y,则:
?
?
?
?
?80
?
?
?
?
?
?
?
44?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
8g
?
?
?
?
?
?
?
?
y
故正确;
D.时固体质量不再减少,说明反应已经停止,CuO反应完,故正确。
故选B。
6.【答案】B
【解析】解:根据质量守恒定律可知,由于B是催化剂,所以参加反应的A、C的总质量等于生成的D的质量,也就是又因为A完全反应,所以反应掉的C的质量,即C剩余,则反应后的混合物中C的质量为4g,故反应后的混合物中B与C的质量比为:10g::2。
故选:B。
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。催化剂不参与反应,化学反应前后质量不变。
本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力。
7.【答案】C
【解析】解:由质量守恒定律可知,6克A与B完全反应生成14克的C,则B的质量为:;
设C的相对分子质量为x
?
?
?
?
?
?
?
?8g?14g
?
解得:
故选:C。
根据质量守恒定律可知反应物B的质量,进而确定了B和C的质量关系,然后依据化学反应中物质之间的质量比等于其相对分子质量与计量数的乘积之比求解即可;
本题主要考查学生运用质量守恒定律进行推断的能力,需认真分析,找出质量关系,就可以求解.
8.【答案】D
【解析】解:化学方程式反映出一种化学反应的过程、反应物和生成物各是什么物质、质量守恒定律以及反应物和生成物各物质之间的质量比,根据化学方程式计算的依据是:化学方程式所体现的反应物、生成物之间的质量比。
故选:D。
根据化学方程式的意义以及计算的方法来分析解答。
本题考查了化学方程式的意义,难度不大。
9.【答案】D
【解析】解:根据质量守恒定律可知15gA和B充分反应生成20gC时,参加反应的B质量应为;
设C的相对分子质量是x,则
?????
????
解得。
故选:D。
依据质量守恒定律可知反应物B的质量,进而确定了B和C的质量关系,然后依据化学反应中物质之间的质量比等于其相对分子质量和的比求解即可。
此题是对化学方程式计算的考查,解题的关键是把质量守恒定律的内容和化学方程式结合起来进行分析、判断。
10.【答案】C
【解析】
【分析】
本题难度不大,根据质量守恒定律以及化学方程式计算分析解答即可。
【解答】
镁和氧气反应的化学方程式为:
2MgO
?48?
?
?32?
?
?
?
?
80
在此反应中镁、氧气和氧化镁的质量关系48:32:80,如果镁条与氧气的质量比:32,则刚好生成物氧化镁的质量等于镁条和氧气的质量和,但是12g镁条与20g氧气反应,根据质量比可知,氧气过量,计算时按照镁条完全燃烧进行计算,生成的氧化镁的质量为;
故选C。
11.【答案】AC
【解析】
【分析】
本题考查化学式和化学方程式的计算,解答本题的关键是利用相关知识进行解答。
【解答】
A.质量相等设该质量为的氧化镁和硫酸镁中镁元素的质量比为:
:1,故A正确;
B.质量相等设该质量为的硫和碳分别在氧气中充分燃烧,硫消耗的氧气为x,碳消耗的氧气的质量为y
32??32
mg
?x
12
?32
硫比碳消耗氧气的质量小,而不是大,故B错误;
C.硝酸铵和氯化钾的混合物中氮元素质最分数为,由于硝酸铵中氮元素的质量分数为
,则该混合物中硝酸铵的质量分数为,故C正确;
D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸即溶质相等,设质量均为
设质量为mg的氢氧化钠完全反应消耗的硫酸的质量为x
80
?
?
?
?
?
?
98
mg
?
?
?
?
?
?x
所以应该是氢氧化钠有剩余,充分反应后,向所得溶液中滴加硫酸铜溶液,氢氧化钠与硫酸铜反应生成蓝色沉淀,故D错误。
故选AC。
12.【答案】BC
【解析】解:根据氢气和氧气反应的化学方程式:可知
设氢气和氧气的体积分别为x,设装置的体积为相同状态下,气体的体积之比等于计量系数之比
第一种情况,假设氢气完全反应,剩余的是氧气
2?
?
?
?
1
x?
?
?
?
x::5。
第二种情况,氧气完全反应
2?
?
?
?1
2y?
?
?y
?
x::2
?故选BC
由题意可知,活塞最终停在容器体积的处,可知反应后剩余的气体与原先空气的体积一致,即氢气和氧气的混合气体由原来的占密闭容器的,反应后剩余气体是原体积的.
理解反应后气体的体积的变化是解决本题的关键.
13.【答案】BD
【解析】解:
A、
80???????????
98
由于质量和质量分数均相等的氢氧化钠溶液与稀硫酸充分反应,即氢氧化钠和硫酸的质量相等,假设都是98g,则氢氧化钠有剩余,则溶液呈碱性。错误;
B、等质量设为的二氧化硫和三氧化硫中硫元素的质量比为::正确;
C、假设样品为纯净的硝酸镁。设生成的氢氧化镁的质量为x
148????????????????????????????????????????????
58
?????????????????????????????????????????
x
说明杂质的含镁量小于硝酸镁。
和的每个分子都含有一个镁离子,而其相对分子质量分别为148和120,所以硫酸镁中镁元素的质量分数更大,所以不可能含有硫酸镁。错误;
?D、设氧化物中氧元素的质量为y
根据氧元素守恒和氢元素守恒可得关系式为:
金属氧化物中的O∽∽∽∽∽∽∽∽
?????????????????????
16????????????????????????
98
???????????????????????
y????????????????????????
,正确;
故选:BD。
A、根据对应的化学方程式求算反应的氢氧化钠和硫酸的质量进而判断溶液的酸碱性;
B、根据二氧化硫和三氧化硫的化学式求算硫元素的质量比;
C、假设样品为纯净的硝酸镁结合对应的化学方程式求算氢氧化镁的质量,进而确定对应样品的含镁元素的质量分数高低,进而确定是否含有硫酸镁;
D、根据氢元素和氧元素守恒求算氧化物中氧元素的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
14.【答案】CD
【解析】
【分析】
本题主要考查常见化学反应中物质质量的关系,仔细分析化学反应与图象的关系。完成此题,可以依据已有的知识进行分析解答。
【解答】
滴加氯化钡溶液时,发生的反应有:,;滴加氢氧化钠溶液时,发生的反应有:,。
A.a点时溶液中含有的溶质是HCl和,溶液显酸性,A错误;
B.段发生的是和两个反应,B错误;
C.c点得到的沉淀有和两种,根据图示可知,生成的质量为,生成的质量为,则铁元素的质量为,设由硫酸铁生成硫酸钡的质量为x,生成的氢氧化铁消耗氢氧化钠的质量为y,则有:
112?
?
?
?
?
?
?
?
?
?
?
?
?699?
?
?
?
?
?
?
?
?
?
?
?
?
?240
?
?
?
?
?
?
?
?
?
?
?
?
?x?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
y
可解得,;氯化钡与硫酸反应生成硫酸钡的质量为,设氯化钡与硫酸反应生成的盐酸消耗氢氧化钠的质量为z,则有:
233?
?
?
?
?
73?
?
?
?
80
?
?
?
?
?
?
?
?
?
?
z
可解得;参加反应的氢氧化钠的总质量为,c点消耗氢氧化钠溶液的质量为,所以,C正确;
D.有上述分析可知,铁元素的质量为;硫元素的质量为;原混合溶液中铁元素和硫元素的质量比为,D正确。
故选CD。
15.【答案】BC
【解析】解:设镁完全反应生成的氢气质量为x
Mg-----,
24??????
2
???
x
???
解得:
设铝完全反应生成的氢气质量为y
2Al------,
54??????
?
?6
?????
?y
???
解得:
设锌完全反应生成的氢气质量为z
Zn-----,
65?????
2
??
?z
??
解得:
由于金属是镁、铝和锌的混合物,由计算的数据可知,得到氢气的质量在到之间,符合题意的是BC
故选:BC。
根据镁、铝、锌都会与盐酸反应生成氢气,可以采用极值法分别计算三种纯金属制取的氢气质量,然后进行分析。
本题主要考查学生利用化学方程式进行计算和分析的能力,注意极值法的应用。
16.【答案】;
【解析】
【分析】
本题考查质量守恒定律的应用和根据化学式进行的相关计算,掌握相关知识即可解答。
【解答】
一定量的乙醇与一定量的氧气恰好完全反应,生成的水,水中氢元素的质量为,根据质量守恒定律,水中氢元素的质量等于乙醇中氢元素的质量,则乙醇的质量为,则乙醇中的碳元素质量为设生成一氧化碳的质量为xg,生成二氧化碳的质量为yg,
根据碳元素质量守恒可知,,,解得,,则混合物中一氧化碳与二氧化碳的质量比为:。
17.【答案】;5
【解析】
【分析】
本题主要考查根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
根据给出的信息可知碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,书写对应的化学方程式;根据充分加热后剩余固体为氧化铜,进而确定反应前的铜的质量分数,求算出加热后固体的总质量,进而求算生成的水和二氧化碳的质量。
【解答】
根据碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,对应的化学方程式为:;
由铜元素反应前后质量守恒,可得:
,,
再由:可得:差量的内容为:水和二氧化碳的质量之和,即:
。
故答案为:;5。
18.【答案】
解:设理论上需要氯化钠的质量为x
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
84
x?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
答:理论上需要氯化钠的质量为。
【解析】
【分析】
本题考查化学式的相关计算,利用化学方程式的计算,掌握化学式中各原子的个数比,某元素质量分数的计算方法,会利用化学方程式进行简单计算是解题的关键。
【解答】
根据碳酸氢钠的化学式,可知一个碳酸氢钠分子是由一个钠原子、一个氢原子、一个碳原子、三个氧原子构成,故碳酸氢钠中原子的个数比:H:C:为,故答案是:;
化合物中某元素的质量分数,故碳酸氢钠中钠元素的质量分数为,
故答案是:;
根据化学方程式,知道碳酸氢钠的质量,列比例式可求出氯化钠的质量。
19.【答案】
【解析】
【分析】
本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,题目难度一般。
【解答】
由A和B的相对质量分数比为7:8,已知和一定量的B完全反应,
设参加反应的B的质量为x,则
?
?
?
?7?
?
?
?
?
x
?,
解得,
根据守恒定律可知,C的质量为。
故答案为:。
20.【答案】
【解析】解:根据表格可以看出,加入第一个40g盐酸固体减少了10个,而加入到第三个40g时,固体减少了30g,确定每40g盐酸消耗掉碳酸钙10g,所以可知。
根据曲线图可知,加入盐酸为160g时气体质量达到最大,也就是160g盐酸对应40g碳酸钙。即参加反应的碳酸钙的质量为40g。
设40g碳酸钙完全反应生成的二氧化碳的质量为x。
100????????????????????????????????????
44
40?g????????????????????????????????????x
答:的值为
50。
反应后生成的二氧化碳的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
21.【答案】解:依据质量守恒定律可知生成的质量为;
设混合物中碳的质量为x,
12?
?
?
?
?
?
?
?
?
?44??
x?
?
?
?
?
?
?
?
?
?
??
12
x
44
所以原混合物中氧化铜的质量为,反应前混合物中CuO的质量分数为
,
答:反应前混合物中氧化铜的质量分数为。
【解析】
【分析】
本题考查利用化学方程式的计算,依据化学方程式计算要把握好三点:一是书写正确的化学方程式,二是代入正确的数据,三是计算格式要规范完整。
【解答】
因为碳完全反应所以反应前后固体的质量之差即为碳与氧化铜反应生成的二氧化碳质量,利用该值即可依据方程式求出混合物中碳的质量,进而可求氧化铜的质量以及氧化铜的质量分数。
22.【答案】解:设每1千克液态氢充分燃烧需要的助燃剂液氧的质量为x。
?4?
?
?32
1kg?
?
x
答:每1千克液态氢充分燃烧需要的助燃剂液氧的质量为8kg。
【解析】
【分析】
本题考查依据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
【解答】
根据氢气的质量和化学方程式计算需要氧气的质量。
23.【答案】生成的氧气的质量
解:设参加反应的过氧化氢质量为x
?68?
?
?
?
?
?
?
?
?
?
?
?
?
?32
?x?
?
?
?
?
?
?
?
?
?
?
?
?
?
答:参加反应的过氧化氢质量为。
【解析】
【分析】
本题主要考查了根据化学方程式来计算有关的量,从而使学生来认识化学反应的本质,代入化学方程式计算的数据必须是纯净物的质量才行。
【解答】
根据质量守恒定律可知,反应前后的质量差就是生成气体的质量,生成的氧气的质量,故生成的氧气的质量是;
代入化学方程式计算的数据必须是纯净物的质量才行,知道氧气的质量是,利用化学方程式列比例式可求出参加反应的过氧化氢质量。
第2页,共2页
第1页,共1页
一、单选题
在“”的反应中,已知8g?物质A完全反应生成11g?物质C和9g物质若A的相对分子质量为32,则物质B的相对分子质量
A.
64
B.
48
C.
32
D.
16
某和组成的混合物中钾元素的质量分数为,将该混合物加热至固体质量不再改变,下列有关说法错误的是
A.
加热后固体中钾元素的质量分数增加
B.
共生成氧气
C.
加热后,剩余固体的质量为
D.
原混合物中的质量为
制取71克五氧化二磷,需要磷_______克,需要烧氧气_______克
A.
30克?30克
B.
30克40克
C.
31克40克
D.
40克31克
将氯酸钾和二氧化锰均匀混合物分成两份,第一份14g加热至完全反应后,得固体,第二份21g加热一段时间后,测得剩余固体中二氧化锰占可得氧气质量是
A.
B.
C.
D.
已知:。若被CO完全反应,有关量的变化如下图,下列分析不正确的是?
?
A.
图中表示生成Cu的质量
B.
表示消耗CO的质量
C.
生成的质量为
D.
时CuO反应完
将A、B、C三种物质各10克,加热进行化合反应生成其中B是催化剂,当A已完全反应后,测得生成的D为16克。反应后的混合物中B与C的质量比为
A.
B.
C.
D.
在化学反应中,设有6克A与B完全反应生成14克的C,若B的相对分子质量为32,则C的相对分子质量为
A.
7
B.
14
C.
28
D.
56
根据化学方程式进行计算的依据是
A.
化学方程式表示了一种化学反应的过程
B.
化学方程式表示了反应物和生成物各是什么物质
C.
化学方程式反映了质量守恒定律
D.
化学方程式反映了反应物和生成物各物质之间的质量比
某反应的化学方程式为,和足量的B充分反应,生成。已知B的相对分子质量是32,则C的相对分子质量是
A.
32
B.
64
C.
96
D.
128
12g镁条在含20g氧气的密闭容器中充分燃烧,生成物氧化镁的质量
A.
32g
B.
28g
C.
20g
D.
40g
二、双选题
下列说法中正确的是
A.
质量相等的氧化镁和硫酸镁中镁元素的质量比为
B.
质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大
C.
硝酸铵和氯化钾的混合物中氮元素的质量分数为,该混合物中硝酸铵的质量分数为
D.
质量和质量分数均相等的氢氧化钠溶液和稀硫酸充分反应后,向所得溶液中滴加硫酸铜溶液,不会出现蓝色沉淀
在如图所示的密闭容器中有一个理想活塞滑动自如,且密封性绝对可靠,处在容器体积的处;其中,的部分充的是空气,另的部分充的是和的混合气体;当后者用电火花点燃引爆时,活塞先被冲到左边;而当容器内的气体逐渐恢复到原来的温度时,活塞渐渐向右边移动,最终停在容器容积的处,则原来的氢气和氧气的体积比可能是
A.
8:1
B.
7:2
C.
4:5
D.
2:7
下列说法正确的是
A.
质量和质量分数均相等的氢氧化钠溶液与稀硫酸充分反应,所得溶液呈酸性
B.
等质量的二氧化硫和三氧化硫中硫元素的质量比为5:4
C.
硝酸镁样品只含有一种杂质溶于水,与足量的氢氧化钠溶液充分反应后生成沉淀,则样品中可能含有的杂质是硫酸镁
D.
向一定量的氧化铁与氧化铜的混合物中加入100g质量分数为稀硫酸,恰好完全反应,则原混合物中氧元素的质量是
有和的混合溶液,先向其中滴加溶液,再滴加的NaOH溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是?
???
A.
a点溶液呈中性
B.
段只发生了1个反应
C.
c点对应的沉淀有2种,
D.
原混合溶液中铁、硫元素质量比是
有Mg、Fe、Zn的混合物共,与足量盐酸反应,生成的质量可能是
A.
B.
C.
D.
三、填空题
乙醇可作燃料。现有一定量的乙醇与一定量的氧气混合于密闭容器内,在一定条件下反应生成水,同时得到一氧化碳和二氧化碳的混合物,参加反应的乙醇的质量为_________g,混合物中一氧化碳与二氧化碳的质量比为_____________填最简比。
碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为
______________?。充分加热含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为,则该反应生成水和二氧化碳的质量之和为
______________???g。
我国化学家侯德榜所发明的侯氏制碱法,为世界制碱事业发展做出重大贡献,其反应原理如下:。请计算:
碳酸氢钠中原子的个数比:H:C:为____________。
碳酸氢钠中钠元素的质量分数为____________。结果保留
要生产吨碳酸氢钠,理论上需要氯化钠的质量是多少吨写出计算过程
在反应中,已知A和B的相对分子质量之比为,当与一定量B恰好完余反应后,生成,则生成C的质量为_____g。
四、计算题
有一种石灰石样品的成分是碳酸钙和二氧化硅,某课外小组同学将200克盐酸分5次加入到70克石灰石样品中已知不与盐酸反应,得到如下部分数据和图象。
次数
第1次
第2次
第3次
加入盐酸的质量
40
40
40
剩余固体的质量
60
a
40
请计算:
的值为
______
。
求反应后生成二氧化碳的质量。
将由木炭粉和氧化铜组成的混合物充分加热,其中木炭完全反应,反应结束后将剩余物冷却,称得固体质量为已知生成物只有二氧化碳和铜,请计算:反应前混合物中氧化铜的质量分数为多少?结果准确到
长征五号,于2016年11月3日20时43分在文昌卫星发射中心成功发射升空,成为我国运载能力最大的火箭.“长征五号”运载火箭也称“冰箭”,因为火箭肚子里装了满满的深低温液氢、液氧燃料.请计算每1千克液态氢充分燃烧需要的助燃剂液态氧的质量是多少
向装有36g过氧化氢溶液的烧杯中加入二氧化锰,充分反应后,烧杯内物质的质量为,则
生成的氧气的质量是多少?
参加反应的过氧化氢质量为多少?
答案和解析
1.【答案】C
【解析】
【分析】
本题是考查质量守恒定律的应用,根据质量守恒定律求算生成的B的质量,进而根据A、B的质量以及A的相对分子质量和对应化学方程式求算B的相对分子质量。
【解答】
依据质量守恒定律可知参加反应的B的质量是,
设B的相对分子质量是x,
?
?
?3x
?
?8g?
12g
?
?,
故C正确。
故选C。
2.【答案】B
【解析】解:反应前后钾元素的质量不变,混合物的质量加热后减少,所以加热后固体中钾元素的质量分数增加,故A正确;
B.混合物中氯酸钾的质量为:,
设氯酸钾完全反应生成氧气的质量为x。
?245?
?
?
?
?
?
?
?
?
?
?
?
96
?
?
?
?
?
?
?
?
?
?
?x
故B错误;
C.加热后,剩余固体的质量为:,故C正确;
D.原混合物中的质量为:,故D正确。
故选:B。
本题考查化学方程式的有关计算,根据特定元素的守恒进行灵活的计算,难度中等。
3.【答案】C
【解析】解:设参加反应的磷的质量为x,消耗的氧气的质量为y
124???
160?????
284
x????????
y?????????
71g
故选:C。
根据生成的五氧化二磷的质量和对应的化学方程式求算磷和氧气的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
4.【答案】C
【解析】解:氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变。
将氯酸钾和二氧化锰均匀混合物分成两份,第一份14g加热至完全反应后,得固体,由质量守恒定律,生成氧气的质量为。
设14g混合物中氯酸钾的质量为x
?
245???????????????????????
?96
??
x???????????????????????????
???????
二氧化锰的质量分数为。
21g混合物中二氧化锰的质量为:。
所剩固体的质量为。
根据质量守恒定律生成的质量是:。
故选:C。
根据氯酸钾在二氧化锰的催化作用下、在加热条件下生成氯化钾和氧气,由质量守恒定律,计算出第一份生成氧气的质量,进而计算出二氧化锰的质量分数,由二氧化锰作催化剂反应前后质量不变,进行分析解答。
本题难度不大,明确二氧化锰作催化剂反应前后质量不变、掌握化学方程式的有关计算是正确解答本题的关键。
5.【答案】B
【解析】
【分析】
本题考查了一氧化碳还原氧化铜的实验以及根据化学方程式的计算,完成此题,可以依据已有的知识结合反应的化学方程式进行。
【解答】
A.设生成铜的质量为x,则:
?
?
?
?
?80
?
?
?64
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??
?
?
?
?
8g
?
?
?
x
即8g氧化铜被完全还原后得到铜的质量为,故正确;
B.由可知固体减少的质量为氧化铜中氧的质量,而不是消耗CO的质量,故错误;
C.设生成的质量为y,则:
?
?
?
?
?80
?
?
?
?
?
?
?
44?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
8g
?
?
?
?
?
?
?
?
y
故正确;
D.时固体质量不再减少,说明反应已经停止,CuO反应完,故正确。
故选B。
6.【答案】B
【解析】解:根据质量守恒定律可知,由于B是催化剂,所以参加反应的A、C的总质量等于生成的D的质量,也就是又因为A完全反应,所以反应掉的C的质量,即C剩余,则反应后的混合物中C的质量为4g,故反应后的混合物中B与C的质量比为:10g::2。
故选:B。
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。催化剂不参与反应,化学反应前后质量不变。
本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力。
7.【答案】C
【解析】解:由质量守恒定律可知,6克A与B完全反应生成14克的C,则B的质量为:;
设C的相对分子质量为x
?
?
?
?
?
?
?
?8g?14g
?
解得:
故选:C。
根据质量守恒定律可知反应物B的质量,进而确定了B和C的质量关系,然后依据化学反应中物质之间的质量比等于其相对分子质量与计量数的乘积之比求解即可;
本题主要考查学生运用质量守恒定律进行推断的能力,需认真分析,找出质量关系,就可以求解.
8.【答案】D
【解析】解:化学方程式反映出一种化学反应的过程、反应物和生成物各是什么物质、质量守恒定律以及反应物和生成物各物质之间的质量比,根据化学方程式计算的依据是:化学方程式所体现的反应物、生成物之间的质量比。
故选:D。
根据化学方程式的意义以及计算的方法来分析解答。
本题考查了化学方程式的意义,难度不大。
9.【答案】D
【解析】解:根据质量守恒定律可知15gA和B充分反应生成20gC时,参加反应的B质量应为;
设C的相对分子质量是x,则
?????
????
解得。
故选:D。
依据质量守恒定律可知反应物B的质量,进而确定了B和C的质量关系,然后依据化学反应中物质之间的质量比等于其相对分子质量和的比求解即可。
此题是对化学方程式计算的考查,解题的关键是把质量守恒定律的内容和化学方程式结合起来进行分析、判断。
10.【答案】C
【解析】
【分析】
本题难度不大,根据质量守恒定律以及化学方程式计算分析解答即可。
【解答】
镁和氧气反应的化学方程式为:
2MgO
?48?
?
?32?
?
?
?
?
80
在此反应中镁、氧气和氧化镁的质量关系48:32:80,如果镁条与氧气的质量比:32,则刚好生成物氧化镁的质量等于镁条和氧气的质量和,但是12g镁条与20g氧气反应,根据质量比可知,氧气过量,计算时按照镁条完全燃烧进行计算,生成的氧化镁的质量为;
故选C。
11.【答案】AC
【解析】
【分析】
本题考查化学式和化学方程式的计算,解答本题的关键是利用相关知识进行解答。
【解答】
A.质量相等设该质量为的氧化镁和硫酸镁中镁元素的质量比为:
:1,故A正确;
B.质量相等设该质量为的硫和碳分别在氧气中充分燃烧,硫消耗的氧气为x,碳消耗的氧气的质量为y
32??32
mg
?x
12
?32
硫比碳消耗氧气的质量小,而不是大,故B错误;
C.硝酸铵和氯化钾的混合物中氮元素质最分数为,由于硝酸铵中氮元素的质量分数为
,则该混合物中硝酸铵的质量分数为,故C正确;
D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸即溶质相等,设质量均为
设质量为mg的氢氧化钠完全反应消耗的硫酸的质量为x
80
?
?
?
?
?
?
98
mg
?
?
?
?
?
?x
所以应该是氢氧化钠有剩余,充分反应后,向所得溶液中滴加硫酸铜溶液,氢氧化钠与硫酸铜反应生成蓝色沉淀,故D错误。
故选AC。
12.【答案】BC
【解析】解:根据氢气和氧气反应的化学方程式:可知
设氢气和氧气的体积分别为x,设装置的体积为相同状态下,气体的体积之比等于计量系数之比
第一种情况,假设氢气完全反应,剩余的是氧气
2?
?
?
?
1
x?
?
?
?
x::5。
第二种情况,氧气完全反应
2?
?
?
?1
2y?
?
?y
?
x::2
?故选BC
由题意可知,活塞最终停在容器体积的处,可知反应后剩余的气体与原先空气的体积一致,即氢气和氧气的混合气体由原来的占密闭容器的,反应后剩余气体是原体积的.
理解反应后气体的体积的变化是解决本题的关键.
13.【答案】BD
【解析】解:
A、
80???????????
98
由于质量和质量分数均相等的氢氧化钠溶液与稀硫酸充分反应,即氢氧化钠和硫酸的质量相等,假设都是98g,则氢氧化钠有剩余,则溶液呈碱性。错误;
B、等质量设为的二氧化硫和三氧化硫中硫元素的质量比为::正确;
C、假设样品为纯净的硝酸镁。设生成的氢氧化镁的质量为x
148????????????????????????????????????????????
58
?????????????????????????????????????????
x
说明杂质的含镁量小于硝酸镁。
和的每个分子都含有一个镁离子,而其相对分子质量分别为148和120,所以硫酸镁中镁元素的质量分数更大,所以不可能含有硫酸镁。错误;
?D、设氧化物中氧元素的质量为y
根据氧元素守恒和氢元素守恒可得关系式为:
金属氧化物中的O∽∽∽∽∽∽∽∽
?????????????????????
16????????????????????????
98
???????????????????????
y????????????????????????
,正确;
故选:BD。
A、根据对应的化学方程式求算反应的氢氧化钠和硫酸的质量进而判断溶液的酸碱性;
B、根据二氧化硫和三氧化硫的化学式求算硫元素的质量比;
C、假设样品为纯净的硝酸镁结合对应的化学方程式求算氢氧化镁的质量,进而确定对应样品的含镁元素的质量分数高低,进而确定是否含有硫酸镁;
D、根据氢元素和氧元素守恒求算氧化物中氧元素的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
14.【答案】CD
【解析】
【分析】
本题主要考查常见化学反应中物质质量的关系,仔细分析化学反应与图象的关系。完成此题,可以依据已有的知识进行分析解答。
【解答】
滴加氯化钡溶液时,发生的反应有:,;滴加氢氧化钠溶液时,发生的反应有:,。
A.a点时溶液中含有的溶质是HCl和,溶液显酸性,A错误;
B.段发生的是和两个反应,B错误;
C.c点得到的沉淀有和两种,根据图示可知,生成的质量为,生成的质量为,则铁元素的质量为,设由硫酸铁生成硫酸钡的质量为x,生成的氢氧化铁消耗氢氧化钠的质量为y,则有:
112?
?
?
?
?
?
?
?
?
?
?
?
?699?
?
?
?
?
?
?
?
?
?
?
?
?
?240
?
?
?
?
?
?
?
?
?
?
?
?
?x?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
y
可解得,;氯化钡与硫酸反应生成硫酸钡的质量为,设氯化钡与硫酸反应生成的盐酸消耗氢氧化钠的质量为z,则有:
233?
?
?
?
?
73?
?
?
?
80
?
?
?
?
?
?
?
?
?
?
z
可解得;参加反应的氢氧化钠的总质量为,c点消耗氢氧化钠溶液的质量为,所以,C正确;
D.有上述分析可知,铁元素的质量为;硫元素的质量为;原混合溶液中铁元素和硫元素的质量比为,D正确。
故选CD。
15.【答案】BC
【解析】解:设镁完全反应生成的氢气质量为x
Mg-----,
24??????
2
???
x
???
解得:
设铝完全反应生成的氢气质量为y
2Al------,
54??????
?
?6
?????
?y
???
解得:
设锌完全反应生成的氢气质量为z
Zn-----,
65?????
2
??
?z
??
解得:
由于金属是镁、铝和锌的混合物,由计算的数据可知,得到氢气的质量在到之间,符合题意的是BC
故选:BC。
根据镁、铝、锌都会与盐酸反应生成氢气,可以采用极值法分别计算三种纯金属制取的氢气质量,然后进行分析。
本题主要考查学生利用化学方程式进行计算和分析的能力,注意极值法的应用。
16.【答案】;
【解析】
【分析】
本题考查质量守恒定律的应用和根据化学式进行的相关计算,掌握相关知识即可解答。
【解答】
一定量的乙醇与一定量的氧气恰好完全反应,生成的水,水中氢元素的质量为,根据质量守恒定律,水中氢元素的质量等于乙醇中氢元素的质量,则乙醇的质量为,则乙醇中的碳元素质量为设生成一氧化碳的质量为xg,生成二氧化碳的质量为yg,
根据碳元素质量守恒可知,,,解得,,则混合物中一氧化碳与二氧化碳的质量比为:。
17.【答案】;5
【解析】
【分析】
本题主要考查根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
根据给出的信息可知碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,书写对应的化学方程式;根据充分加热后剩余固体为氧化铜,进而确定反应前的铜的质量分数,求算出加热后固体的总质量,进而求算生成的水和二氧化碳的质量。
【解答】
根据碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,对应的化学方程式为:;
由铜元素反应前后质量守恒,可得:
,,
再由:可得:差量的内容为:水和二氧化碳的质量之和,即:
。
故答案为:;5。
18.【答案】
解:设理论上需要氯化钠的质量为x
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
84
x?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
答:理论上需要氯化钠的质量为。
【解析】
【分析】
本题考查化学式的相关计算,利用化学方程式的计算,掌握化学式中各原子的个数比,某元素质量分数的计算方法,会利用化学方程式进行简单计算是解题的关键。
【解答】
根据碳酸氢钠的化学式,可知一个碳酸氢钠分子是由一个钠原子、一个氢原子、一个碳原子、三个氧原子构成,故碳酸氢钠中原子的个数比:H:C:为,故答案是:;
化合物中某元素的质量分数,故碳酸氢钠中钠元素的质量分数为,
故答案是:;
根据化学方程式,知道碳酸氢钠的质量,列比例式可求出氯化钠的质量。
19.【答案】
【解析】
【分析】
本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,题目难度一般。
【解答】
由A和B的相对质量分数比为7:8,已知和一定量的B完全反应,
设参加反应的B的质量为x,则
?
?
?
?7?
?
?
?
?
x
?,
解得,
根据守恒定律可知,C的质量为。
故答案为:。
20.【答案】
【解析】解:根据表格可以看出,加入第一个40g盐酸固体减少了10个,而加入到第三个40g时,固体减少了30g,确定每40g盐酸消耗掉碳酸钙10g,所以可知。
根据曲线图可知,加入盐酸为160g时气体质量达到最大,也就是160g盐酸对应40g碳酸钙。即参加反应的碳酸钙的质量为40g。
设40g碳酸钙完全反应生成的二氧化碳的质量为x。
100????????????????????????????????????
44
40?g????????????????????????????????????x
答:的值为
50。
反应后生成的二氧化碳的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
21.【答案】解:依据质量守恒定律可知生成的质量为;
设混合物中碳的质量为x,
12?
?
?
?
?
?
?
?
?
?44??
x?
?
?
?
?
?
?
?
?
?
??
12
x
44
所以原混合物中氧化铜的质量为,反应前混合物中CuO的质量分数为
,
答:反应前混合物中氧化铜的质量分数为。
【解析】
【分析】
本题考查利用化学方程式的计算,依据化学方程式计算要把握好三点:一是书写正确的化学方程式,二是代入正确的数据,三是计算格式要规范完整。
【解答】
因为碳完全反应所以反应前后固体的质量之差即为碳与氧化铜反应生成的二氧化碳质量,利用该值即可依据方程式求出混合物中碳的质量,进而可求氧化铜的质量以及氧化铜的质量分数。
22.【答案】解:设每1千克液态氢充分燃烧需要的助燃剂液氧的质量为x。
?4?
?
?32
1kg?
?
x
答:每1千克液态氢充分燃烧需要的助燃剂液氧的质量为8kg。
【解析】
【分析】
本题考查依据化学方程式的计算,根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
【解答】
根据氢气的质量和化学方程式计算需要氧气的质量。
23.【答案】生成的氧气的质量
解:设参加反应的过氧化氢质量为x
?68?
?
?
?
?
?
?
?
?
?
?
?
?
?32
?x?
?
?
?
?
?
?
?
?
?
?
?
?
?
答:参加反应的过氧化氢质量为。
【解析】
【分析】
本题主要考查了根据化学方程式来计算有关的量,从而使学生来认识化学反应的本质,代入化学方程式计算的数据必须是纯净物的质量才行。
【解答】
根据质量守恒定律可知,反应前后的质量差就是生成气体的质量,生成的氧气的质量,故生成的氧气的质量是;
代入化学方程式计算的数据必须是纯净物的质量才行,知道氧气的质量是,利用化学方程式列比例式可求出参加反应的过氧化氢质量。
第2页,共2页
第1页,共1页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
