人教版(2019)化学 选择性必修3 第三章 实验活动1 乙酸乙酯的制备与性质 课件(11张ppt)
文档属性
| 名称 | 人教版(2019)化学 选择性必修3 第三章 实验活动1 乙酸乙酯的制备与性质 课件(11张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 426.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-05 00:00:00 | ||
图片预览



文档简介
实验活动1:乙酸乙酯的制备与性质
【实验目的】
1.学习制备乙酸乙酯的方法。
2.加深对酯化反应和酯的水解的认识。
【实验器材及试剂】
1.器材:试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。
2.试剂:乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸馏水、3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液。
【实验过程和结论】
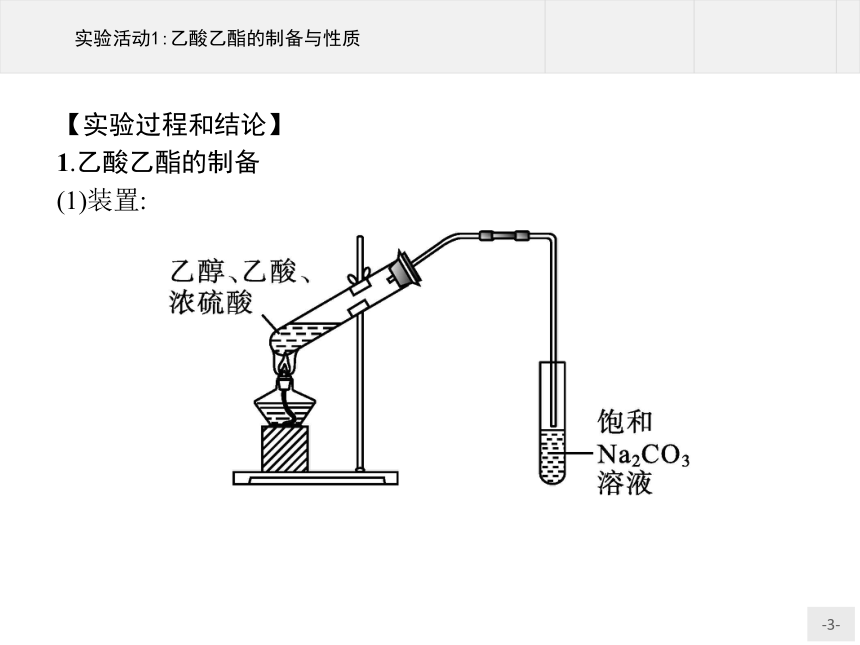
1.乙酸乙酯的制备
(1)装置:
(2)实验步骤与现象:
实验步骤
①
在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和Na2CO3溶液。如图所示连接装置
②
用小火加热试管里的混合物,将产生的蒸气经导管通到饱和Na2CO3溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有Na2CO3溶液的试管,并停止加热
③
振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察、并注意闻气味
实验
现象
①饱和Na2CO3溶液的液面上有油状液体生成
②闻到香味
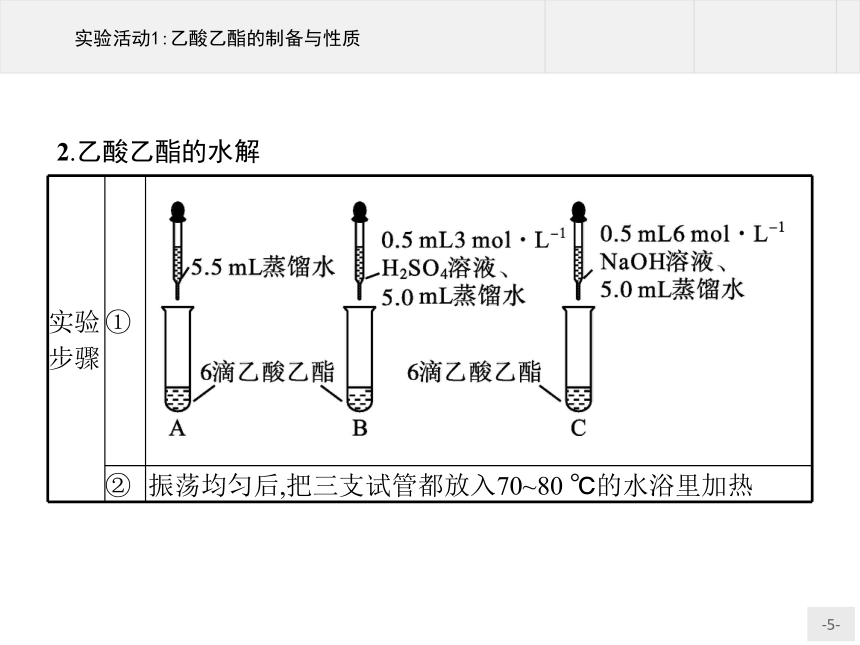
实验步骤
①
?
②
振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热
2.乙酸乙酯的水解
实验
现象
A中液体仍然分层,气味不消失
B中液体酯层逐渐消失,气味渐渐消失
C中液体酯层和气味消失得比B快
实验
结论
乙酸乙酯在酸性和碱性条件下发生水解,在碱性条件下水解得更快
【拓展实验】
实验室某次制取乙酸乙酯的装置如图所示:
(烧杯、夹持装置、温度计已略去)
实验步骤
问题讨论
①
先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7
(1)浓硫酸的主要作用是催化剂和吸水剂
(2)用饱和Na2CO3溶液洗涤粗酯的目的是
吸收乙酸、溶解乙醇,降低乙酸乙酯的溶解度
②
加热油浴保温约135~145 ℃
③
将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成
实验步骤
问题讨论
④
保持油浴温度一段时间,至不再有液体馏出后,停止加热
(3)如果用NaOH溶液代替Na2CO3溶液将引起的后果是使乙酸乙酯水解而使实验失败
(4)用饱和CaCl2溶液洗涤粗酯的目的是除去乙醇
(5)步骤⑧所得的粗酯里还含有的杂质是水
⑤
取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止
⑥
将⑤的液体混合物分液,弃去水层
⑦
将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)
⑧
分液漏斗里得到的是初步提纯的乙酸乙酯粗品
【问题讨论】
1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯在不同条件下水解速率的差异?
提示可以向三个试管中加入等量的重铬酸钾,通过比较颜色变化判断相同时间内产生乙醇量的多少。
2.乙酸乙酯在酸性和碱性条件下水解速率和程度不同的原因是什么?
提示乙酸乙酯水解产生乙酸和乙醇的反应是可逆的,如果是在酸性环境中,产物不断堆积,水解就会受到抑制,速度就慢了;如果在碱性环境中,则反应进行比较彻底,因为产生的产物乙酸和碱反应,可使反应不断进行下去。
3.酯化反应中加热温度为何不宜过高?
提示为了尽量减少乙酸、乙醇的挥发,提高乙酸、乙醇的转化率。
4.酯化反应中哪些措施可以提高乙酸的转化率?
提示增加乙醇的量,适当加热使生成的乙酸乙酯及时蒸出,及时移走生成的水都可以提高乙酸的转化率。
【实验目的】
1.学习制备乙酸乙酯的方法。
2.加深对酯化反应和酯的水解的认识。
【实验器材及试剂】
1.器材:试管、试管夹、烧杯、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、酒精灯、火柴、秒表、碎瓷片。
2.试剂:乙醇、乙酸、浓硫酸、饱和Na2CO3溶液、乙酸乙酯、蒸馏水、3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液。
【实验过程和结论】
1.乙酸乙酯的制备
(1)装置:
(2)实验步骤与现象:
实验步骤
①
在一支试管中加入2 mL乙醇,然后边振荡试管边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。在另一支试管中加入3 mL饱和Na2CO3溶液。如图所示连接装置
②
用小火加热试管里的混合物,将产生的蒸气经导管通到饱和Na2CO3溶液的上方约0.5 cm处,注意观察试管内的变化。反应一段时间后,取下盛有Na2CO3溶液的试管,并停止加热
③
振荡盛有Na2CO3溶液的试管,静置。待溶液分层后,观察、并注意闻气味
实验
现象
①饱和Na2CO3溶液的液面上有油状液体生成
②闻到香味
实验步骤
①
?
②
振荡均匀后,把三支试管都放入70~80 ℃的水浴里加热
2.乙酸乙酯的水解
实验
现象
A中液体仍然分层,气味不消失
B中液体酯层逐渐消失,气味渐渐消失
C中液体酯层和气味消失得比B快
实验
结论
乙酸乙酯在酸性和碱性条件下发生水解,在碱性条件下水解得更快
【拓展实验】
实验室某次制取乙酸乙酯的装置如图所示:
(烧杯、夹持装置、温度计已略去)
实验步骤
问题讨论
①
先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7
(1)浓硫酸的主要作用是催化剂和吸水剂
(2)用饱和Na2CO3溶液洗涤粗酯的目的是
吸收乙酸、溶解乙醇,降低乙酸乙酯的溶解度
②
加热油浴保温约135~145 ℃
③
将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成
实验步骤
问题讨论
④
保持油浴温度一段时间,至不再有液体馏出后,停止加热
(3)如果用NaOH溶液代替Na2CO3溶液将引起的后果是使乙酸乙酯水解而使实验失败
(4)用饱和CaCl2溶液洗涤粗酯的目的是除去乙醇
(5)步骤⑧所得的粗酯里还含有的杂质是水
⑤
取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止
⑥
将⑤的液体混合物分液,弃去水层
⑦
将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)
⑧
分液漏斗里得到的是初步提纯的乙酸乙酯粗品
【问题讨论】
1.乙酸乙酯的水解实验,除了通过乙酸乙酯气味消失的快慢来比较酯的水解速率外,还有什么方法可用来比较乙酸乙酯在不同条件下水解速率的差异?
提示可以向三个试管中加入等量的重铬酸钾,通过比较颜色变化判断相同时间内产生乙醇量的多少。
2.乙酸乙酯在酸性和碱性条件下水解速率和程度不同的原因是什么?
提示乙酸乙酯水解产生乙酸和乙醇的反应是可逆的,如果是在酸性环境中,产物不断堆积,水解就会受到抑制,速度就慢了;如果在碱性环境中,则反应进行比较彻底,因为产生的产物乙酸和碱反应,可使反应不断进行下去。
3.酯化反应中加热温度为何不宜过高?
提示为了尽量减少乙酸、乙醇的挥发,提高乙酸、乙醇的转化率。
4.酯化反应中哪些措施可以提高乙酸的转化率?
提示增加乙醇的量,适当加热使生成的乙酸乙酯及时蒸出,及时移走生成的水都可以提高乙酸的转化率。
