人教版九年级化学上册 第五单元化学方程式 复习课件(共25张PPT)
文档属性
| 名称 | 人教版九年级化学上册 第五单元化学方程式 复习课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-06 21:15:06 | ||
图片预览





文档简介
(共22张PPT)
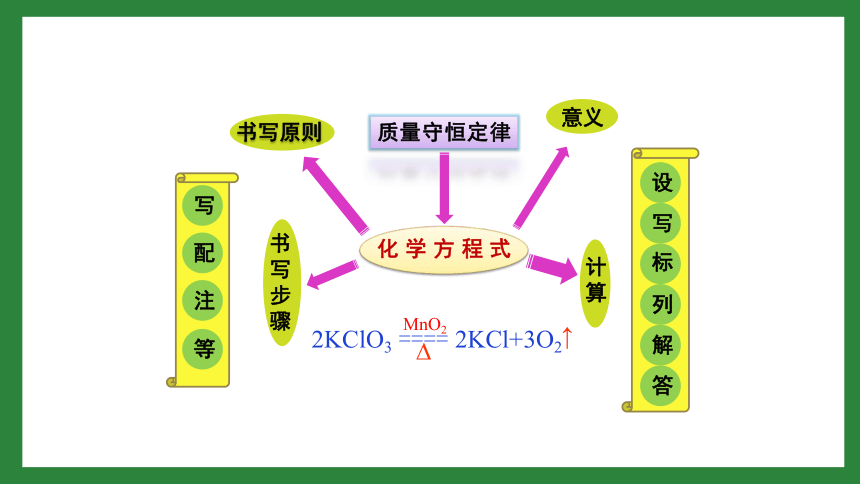
第五单元
化学方程式
小结与复习
化学方程式
书写步骤
书写原则
计算
意义
写
等
配
注
答
解
列
标
设
写
2KClO3
====
2KCl+3O2
MnO2
?
↑
考点一
质量守恒定律
1.质量守恒定律:参加化学反应的各物质________总和,________反应后生成的各物质的质量总和。
等于
质量
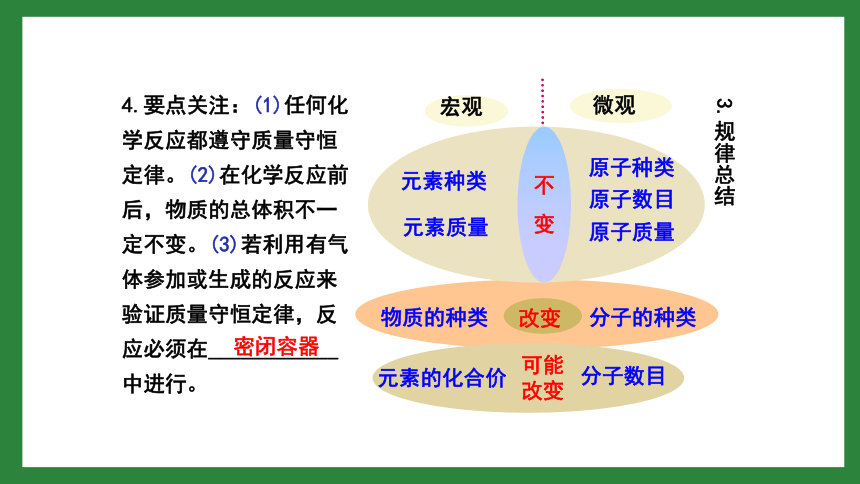
2.解释:化学反应的过程,实际上就是参加反应的各物质所含的______重新组合生成其他物质的过程,因此在化学反应前后原子的_____没有改变,原子的_____没有增减,原子的_____也没有改变(原子三不变),所以物质的总质量在反应前后保持不变。
原子
种类
数目
质量
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
3.规律总结
4.要点关注:(1)任何化学反应都遵守质量守恒定律。(2)在化学反应前后,物质的总体积不一定不变。(3)若利用有气体参加或生成的反应来验证质量守恒定律,反应必须在____________中进行。
密闭容器
【例1】(湖北黄冈中考)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是(
)
物
质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
x
24
3
A.
x
的值等于0.5
B.
甲一定是化合物
C.
丙和丁的质量变化比为8:1
D.
该反应是化合反应
解析思路:根据质量守恒定律,x=50+0.5-23-24-3=0.5。由此可见乙的质量不变,而甲的质量减少,丙、丁的质量增加。由此判断该反应是分解反应。那么,甲一定是化合物。同时根据质量守恒定律,甲质量减少(50-23)g,丙生成24g,丁生成3g,可知是甲、丙、丁的质量比是27:24:3=9:8:1。
D
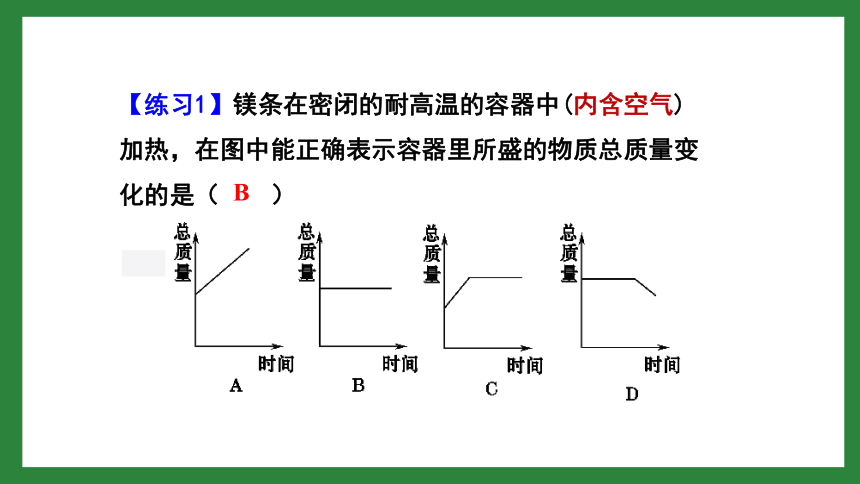
【练习1】镁条在密闭的耐高温的容器中(内含空气)加热,在图中能正确表示容器里所盛的物质总质量变化的是(
)
B
考点二
化学方程式
1.概念:用__________表示化学反应的式子。
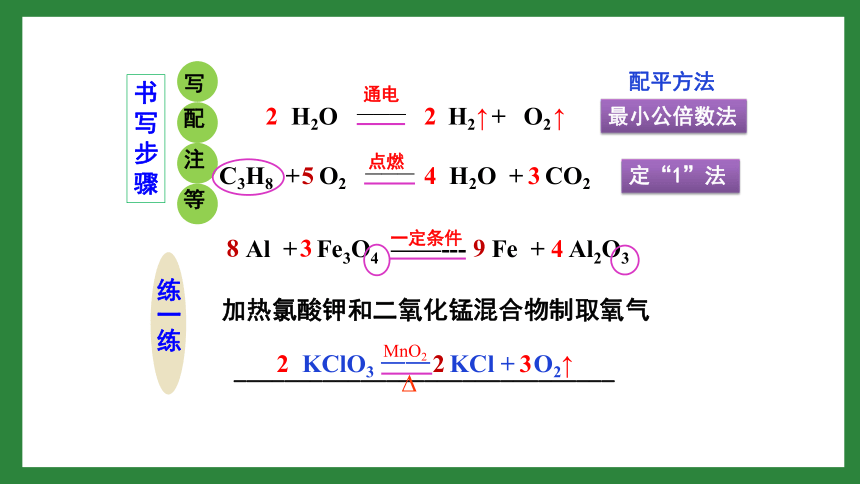
2.书写
①必须以_____________为基础,绝不能
凭空臆造。
②遵守_____________,即化学方程式
两边各种原子的总数要相等。
化学式
客观事实
质量守恒定律
(1)原则
(2)步骤
写、配、注、等
H2O
———
O2
H2
+
加热氯酸钾和二氧化锰混合物制取氧气
______________________________
↑
通电
2
2
↑
C3H8
+
O2
———
CO2
Al
+
Fe3O4
——---
Fe
+
Al2O3
H2O
+
4
3
5
点燃
最小公倍数法
定“1”法
书写步骤
练一练
一定条件
配平方法
9
3
8
4
KClO3
——
KCl
+
O2
3
2
2
↑
MnO2
?
写
等
配
注
【例2】关于化学方程式CH4+2O2====
CO2+2H2O的描述正确的是( )
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个水分子
D.1
g
甲烷和2
g
氧气在点燃条件下,生成
1
g
二氧化碳和2
g
水
点燃
化学方程式可表示:反应物和生成物的种类、反应的条件、反应物和生成物的微观粒子个数比、反应物和生成物的质量比等。但要注意读化学方程式时,“+”应读作“和”,“===”应读作“生成”。
解题思路:
C
【例3】3Cu+8HNO3
==3Cu(NO3)2+2X↑+4
H2O,
X的化学式为
。
Cu
H
N
O
左边
右边
3
8
8
24
3
8
6
22
—
2
2
2
1
1
NO
减法
短除法
列出元素
【例4】下图为某反应的微观示意图,
和
分别代表
不同元素的原子,该反应可能是(
)
解题思路:先从生成物和反应物中划去相同的粒子。
B
【例5】(贵州黔南州中考)汽车尾气排放的有毒气体可在“催化转化器”中转化为无污染的气体。下图为微观反应示意图,请回答:
(1)该微观反应过程中出现了_______种氧化物;
(2)该反应的化学方程式为_______________________;
(3)该反应前后原子的种类和个数均________(选填“减少”、“不变”或“增加”)。
不变
2NO+2CO====
2CO2+N2
3
催化剂
【练习2】(湖北荆州中考)根据化学方程式不能获得的信息有( )
A.化学反应发生的条件
B.化学反应的快慢
C.反应物和生成物的质量比
D.化学反应的反应物和生成物
B
【练习3】现有化学反应X+Y===Z,若将a
g
X和b
g
Y在一定条件下充分反应,生成Z的质量(
)
A.等于(a+b)
g
B.大于(a+b)
g
C.小于(a+b)
g
D.不大于(a+b)
g
D
考点三
根据化学方程式的简单计算
2.解题步骤
(1)设:根据题意设未知量。
(2)写:正确书写有关反应的化学方程式。
(3)标:上标相关物质的质量比,下标已知量和未知量
(4)列:列出比例式
(5)解:
求解
(6)答:简明地写出答案。
1.依据:
___________定律。
质量守恒
【例6】
加热分解6.3g高锰酸钾,可以得到多少克氧气?
1.设未知量
设:可以得到氧气的质量为x
___
2.写出化学方程式
KMnO4
K2MnO4
+MnO2
+
O2
2
2×(39+55+16×4)
6.3g
4.列比例式
x
32
2×158
6.3g
x
_______
=
x
=
0.6g
6.简明地写出答案
Δ
5.求解
16×2
3.标出相关物质质量比
及已知量、未知量
答:可以得到0.6g氧气。
【例7】以H2O2溶液为原料制取4kg氧气,需要H2O2的质量是多少?
2H2O2
2H2O
+
O2
解:设需要过氧化氢的质量为x
4kg
答:需要8.5kg的过氧化氢。
x=8.5kg
2×34
32
已知量带单位
配平化学方程式
计算结果要有单位
MnO2
=
68
x
4kg
x
32
未知量x不带单位
带着单位进行运算
上下对齐
2不要丢掉哦!
【例8】(新疆乌鲁木齐中考)碳酸氢钠用于焙制糕点,在270℃时分解的化学方程式为
2NaHCO3===Na2CO3+H2O+CO2↑。现取NaHCO3
16.8g,在敞口容器中加热到质量不再改变。计算容器中剩余固体物质的质量(计算结
果保留一位小数)。
?
解题思路:正确理解“加热到质量不再改变”的含义是解题的关键。
配平下列化学方程式:
(1)
CuSO4+
NaOH
===
Cu(OH)2↓+
Na2SO4;
(2)
P+
O
2=====
P2O5;
(3)
Fe2O3+
CO
=====
Fe+
CO2;
(4)
C2H4+
O2
=====
CO2+
H2O。
高温
点燃
点燃
2
1
3
2
3
1
2
5
4
1
2
1
1
2
3
【化学方程式专项练习1】
现有下列物质:水、铁丝、氧气、硫磺、氢气,从中选出物质,各写一个符合下列要求的化学方程式。
(1)物质燃烧生成黑色固体
;
(2)有两种单质气体生成
;
(3)生成有刺激性气味的体
;
(4)最轻的气体燃烧
。
【化学方程式专项练习2】
3Fe+2O2=====Fe3O4
2H2O=====2H2↑+O2↑
通电
S+O2=====SO2
2H2+O2=====2H2O
点燃
点燃
点燃
哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料。加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液态),因而产生巨大的推动力。试写出其中涉及的化学方程式:
(1)铝粉被氧气氧化成氧化铝:___________________;
(2)高氯酸铵受热分解
___________________________________________。
【化学方程式专项练习3】
2NH4ClO4
==N2↑+2O2↑+Cl2↑+4H2O↑
?
4Al+3O2=====2Al2O3
?
易错点归纳
1.质量守恒定律理解有误:①对物理变化无意义;②体积、分子数目不守恒;③不能把“参加反应的各物质”简单地理解为“反应物”(例如例1中甲)。
2.化学方程式书写错误:①错写化学式;②臆造不存在的反应;③没有配平;④错写或漏写反应条件;⑤错标或漏标生成物状态符号。
3.化学方程式计算格式不规范,代入化学方程式计算的量不是纯净物的质量。
第五单元
化学方程式
小结与复习
化学方程式
书写步骤
书写原则
计算
意义
写
等
配
注
答
解
列
标
设
写
2KClO3
====
2KCl+3O2
MnO2
?
↑
考点一
质量守恒定律
1.质量守恒定律:参加化学反应的各物质________总和,________反应后生成的各物质的质量总和。
等于
质量
2.解释:化学反应的过程,实际上就是参加反应的各物质所含的______重新组合生成其他物质的过程,因此在化学反应前后原子的_____没有改变,原子的_____没有增减,原子的_____也没有改变(原子三不变),所以物质的总质量在反应前后保持不变。
原子
种类
数目
质量
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
3.规律总结
4.要点关注:(1)任何化学反应都遵守质量守恒定律。(2)在化学反应前后,物质的总体积不一定不变。(3)若利用有气体参加或生成的反应来验证质量守恒定律,反应必须在____________中进行。
密闭容器
【例1】(湖北黄冈中考)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是(
)
物
质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
x
24
3
A.
x
的值等于0.5
B.
甲一定是化合物
C.
丙和丁的质量变化比为8:1
D.
该反应是化合反应
解析思路:根据质量守恒定律,x=50+0.5-23-24-3=0.5。由此可见乙的质量不变,而甲的质量减少,丙、丁的质量增加。由此判断该反应是分解反应。那么,甲一定是化合物。同时根据质量守恒定律,甲质量减少(50-23)g,丙生成24g,丁生成3g,可知是甲、丙、丁的质量比是27:24:3=9:8:1。
D
【练习1】镁条在密闭的耐高温的容器中(内含空气)加热,在图中能正确表示容器里所盛的物质总质量变化的是(
)
B
考点二
化学方程式
1.概念:用__________表示化学反应的式子。
2.书写
①必须以_____________为基础,绝不能
凭空臆造。
②遵守_____________,即化学方程式
两边各种原子的总数要相等。
化学式
客观事实
质量守恒定律
(1)原则
(2)步骤
写、配、注、等
H2O
———
O2
H2
+
加热氯酸钾和二氧化锰混合物制取氧气
______________________________
↑
通电
2
2
↑
C3H8
+
O2
———
CO2
Al
+
Fe3O4
——---
Fe
+
Al2O3
H2O
+
4
3
5
点燃
最小公倍数法
定“1”法
书写步骤
练一练
一定条件
配平方法
9
3
8
4
KClO3
——
KCl
+
O2
3
2
2
↑
MnO2
?
写
等
配
注
【例2】关于化学方程式CH4+2O2====
CO2+2H2O的描述正确的是( )
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个水分子
D.1
g
甲烷和2
g
氧气在点燃条件下,生成
1
g
二氧化碳和2
g
水
点燃
化学方程式可表示:反应物和生成物的种类、反应的条件、反应物和生成物的微观粒子个数比、反应物和生成物的质量比等。但要注意读化学方程式时,“+”应读作“和”,“===”应读作“生成”。
解题思路:
C
【例3】3Cu+8HNO3
==3Cu(NO3)2+2X↑+4
H2O,
X的化学式为
。
Cu
H
N
O
左边
右边
3
8
8
24
3
8
6
22
—
2
2
2
1
1
NO
减法
短除法
列出元素
【例4】下图为某反应的微观示意图,
和
分别代表
不同元素的原子,该反应可能是(
)
解题思路:先从生成物和反应物中划去相同的粒子。
B
【例5】(贵州黔南州中考)汽车尾气排放的有毒气体可在“催化转化器”中转化为无污染的气体。下图为微观反应示意图,请回答:
(1)该微观反应过程中出现了_______种氧化物;
(2)该反应的化学方程式为_______________________;
(3)该反应前后原子的种类和个数均________(选填“减少”、“不变”或“增加”)。
不变
2NO+2CO====
2CO2+N2
3
催化剂
【练习2】(湖北荆州中考)根据化学方程式不能获得的信息有( )
A.化学反应发生的条件
B.化学反应的快慢
C.反应物和生成物的质量比
D.化学反应的反应物和生成物
B
【练习3】现有化学反应X+Y===Z,若将a
g
X和b
g
Y在一定条件下充分反应,生成Z的质量(
)
A.等于(a+b)
g
B.大于(a+b)
g
C.小于(a+b)
g
D.不大于(a+b)
g
D
考点三
根据化学方程式的简单计算
2.解题步骤
(1)设:根据题意设未知量。
(2)写:正确书写有关反应的化学方程式。
(3)标:上标相关物质的质量比,下标已知量和未知量
(4)列:列出比例式
(5)解:
求解
(6)答:简明地写出答案。
1.依据:
___________定律。
质量守恒
【例6】
加热分解6.3g高锰酸钾,可以得到多少克氧气?
1.设未知量
设:可以得到氧气的质量为x
___
2.写出化学方程式
KMnO4
K2MnO4
+MnO2
+
O2
2
2×(39+55+16×4)
6.3g
4.列比例式
x
32
2×158
6.3g
x
_______
=
x
=
0.6g
6.简明地写出答案
Δ
5.求解
16×2
3.标出相关物质质量比
及已知量、未知量
答:可以得到0.6g氧气。
【例7】以H2O2溶液为原料制取4kg氧气,需要H2O2的质量是多少?
2H2O2
2H2O
+
O2
解:设需要过氧化氢的质量为x
4kg
答:需要8.5kg的过氧化氢。
x=8.5kg
2×34
32
已知量带单位
配平化学方程式
计算结果要有单位
MnO2
=
68
x
4kg
x
32
未知量x不带单位
带着单位进行运算
上下对齐
2不要丢掉哦!
【例8】(新疆乌鲁木齐中考)碳酸氢钠用于焙制糕点,在270℃时分解的化学方程式为
2NaHCO3===Na2CO3+H2O+CO2↑。现取NaHCO3
16.8g,在敞口容器中加热到质量不再改变。计算容器中剩余固体物质的质量(计算结
果保留一位小数)。
?
解题思路:正确理解“加热到质量不再改变”的含义是解题的关键。
配平下列化学方程式:
(1)
CuSO4+
NaOH
===
Cu(OH)2↓+
Na2SO4;
(2)
P+
O
2=====
P2O5;
(3)
Fe2O3+
CO
=====
Fe+
CO2;
(4)
C2H4+
O2
=====
CO2+
H2O。
高温
点燃
点燃
2
1
3
2
3
1
2
5
4
1
2
1
1
2
3
【化学方程式专项练习1】
现有下列物质:水、铁丝、氧气、硫磺、氢气,从中选出物质,各写一个符合下列要求的化学方程式。
(1)物质燃烧生成黑色固体
;
(2)有两种单质气体生成
;
(3)生成有刺激性气味的体
;
(4)最轻的气体燃烧
。
【化学方程式专项练习2】
3Fe+2O2=====Fe3O4
2H2O=====2H2↑+O2↑
通电
S+O2=====SO2
2H2+O2=====2H2O
点燃
点燃
点燃
哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料。加热铝粉使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液态),因而产生巨大的推动力。试写出其中涉及的化学方程式:
(1)铝粉被氧气氧化成氧化铝:___________________;
(2)高氯酸铵受热分解
___________________________________________。
【化学方程式专项练习3】
2NH4ClO4
==N2↑+2O2↑+Cl2↑+4H2O↑
?
4Al+3O2=====2Al2O3
?
易错点归纳
1.质量守恒定律理解有误:①对物理变化无意义;②体积、分子数目不守恒;③不能把“参加反应的各物质”简单地理解为“反应物”(例如例1中甲)。
2.化学方程式书写错误:①错写化学式;②臆造不存在的反应;③没有配平;④错写或漏写反应条件;⑤错标或漏标生成物状态符号。
3.化学方程式计算格式不规范,代入化学方程式计算的量不是纯净物的质量。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
