盐类水解考点突破
图片预览






文档简介
(共19张PPT)
盐类水解知识运用考点分析
考点一:确定盐溶液的离子种类和数目
考点二:解释平衡体系移动的方向
考点三:判断及比较溶液的酸碱性和pH值
考点四:涉及盐的实际用途
考点五:某些盐不能用蒸发方法结晶
考点六:某些活泼金属(如Mg)与水解产生H+的
盐溶液作用产生氢气
考点七:有关实验设计及现象解释
考点八:某些离子方程式的正误判断
考点九:某些离子大量共存问题
考点十:判断酸中和碱至pH=7时酸碱的用量
考点十一:判断中和反应、中和滴定达到“中和点”
时溶液的pH值
考点十三:比较盐溶液中离子浓度大小
考点十二:实验室贮存试剂、制备物质、物质的检验
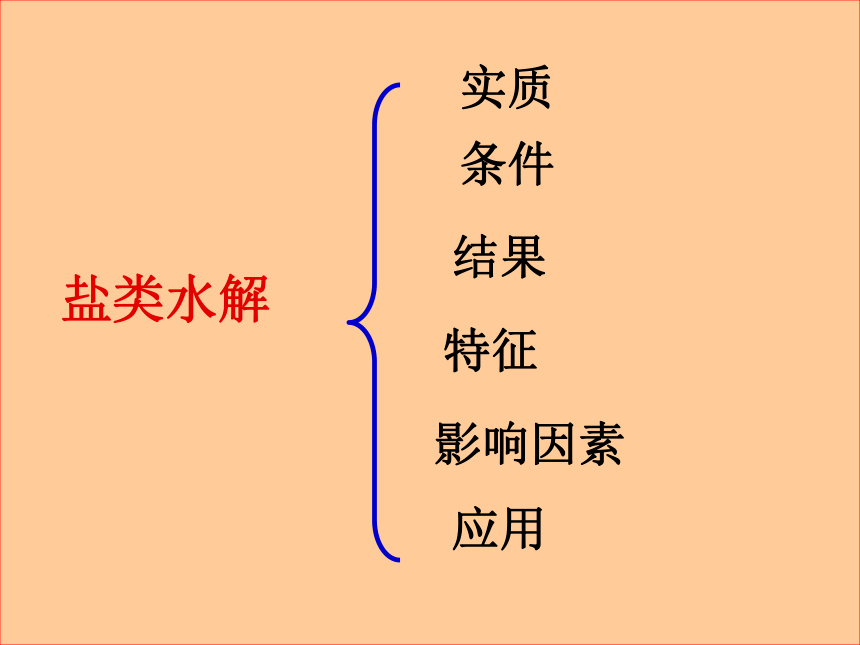
盐类水解
实质
条件
结果
特征
影响因素
应用
1.下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是 ( )
A. Na2HPO4 B. NaHSO4 C. (NH4)2SO4 D. K2S
2. 在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是( )
A. ①=④>③=② B. ④=①>③>②
C. ①>④>③>② D. ④>①>③>②
3.NH4Cl溶于重水(D2O)生成一水合氨分子和水合氢离子的化学式是 ( )
A. NH3 ·D2O和HD2O+ B. NH3·HDO和D3O+
C. NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
B
B
D
1.当Mg(OH)2在水中达到溶解平衡时:
Mg(OH)2 Mg2++2OH- 要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是
A. NH4Cl B. NaOH C. Na2CO3 D. 干冰
2.下列物质的水溶液在加热时pH值变小的是 ( )
A. 氯化铁 B. 氯化钠 C. 盐酸 D. 碳酸钠
3.盛有0.1 mol / L的NaHCO3溶液和酚酞试液的试管,在室温时,溶液为无色,加热时为粉红色,这是因为
A. NaHCO3在加热时变成碱性更强的Na2CO3
B. 水分蒸发使NaHCO3的浓度增大
C. 加热促进NaHCO3的水解,碱性增强
D. NaHCO3在加热时变成红色
AD
A
C
1.下列化合物中,其水溶液由于水解而显酸性的是 ( )
A. NaHCO3 B. NaHSO4 C. HCl D. NH4Cl
2.物质的量浓度相等的下列溶液pH值由大到小的顺序是( )
A. Na2CO3、NaHCO3、NaCl、NH4Cl
B. Na2CO3、NaHCO3、NH4Cl、NaCl、
C. Na2CO3、NaCl、NH4Cl、NaHCO3
D. Na2CO3、NH4Cl、NaHCO3、NaCl、
A
D
小资料
在《李自成》这本书中,写到士兵在行军途中,要造饭,
“这里没有白矾(明矾),无法使浑水澄清,他们就只好用这样的泥水饮马、做饭。”问题:这里用白矾使浑水澄清,用的是什么原理。
小知识
“焊药”—金属焊接时用于除去金属表面氧化膜的溶液。请解释为什么NH4Cl、ZnCl2溶液能用作焊药,用离子方程式表示.
Al3++3H2O Al(OH)3 + 3H+
Zn2+ + 2H2O Zn (OH)2 + 2H+
NH4+ + H2O NH3 H2O + H+
生活小常识:炸油条或油饼时必须要放明矾与纯碱,请解释原理。
2Al3++3CO32- +3H2O = 2Al(OH)3↓+3CO2↑
溶液蒸干 固体物质
Na2CO3型
FeCl3 型
(NH4)2CO3或NH4HCO3 型
Ca(HCO3)2型
Mg(HCO3)2、MgCO3
(NH4)2SO4
Na2SO3
FeCl3和Fe(OH)3
Fe2O3
Mg(OH)2
Na2CO3
CaCO3
Na2SO4
(NH4)2SO4
完全分解
1.下列物质能跟镁反应并生成氢气的是
A. 甲酸溶液 B. 氢氧化钠溶液
C. 氯化铵溶液 D. 碳酸钠溶液
2.将镁粉加入到氯化铁溶液中有大量气体和红褐色沉淀生成,为什么?根据这一现象推断,镁粉加入到氯化铵溶液中,有何现象产生?并写出有关的离子方程式。
AC
因在FeCl3 溶液中Fe3+ 发生了如下水解:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ,向其中加入Mg粉后,Mg粉与 H+ 反应产生H2 ,从而打破解了其水解平衡,使水解平衡向正向移动,就产生了红褐色的Fe(OH)3沉淀。Mg 粉加到NH4Cl 溶液中有大量气体及白色沉淀产生。NH4+ + H2O NH3 ·H2O + H+ ;2H+ +Mg =Mg2+ + H2↑;Mg2+ + 2NH3·H2O = Mg(OH)2↓+ NH4+ 。
.限用下列试剂:酚酞、石蕊、稀硝酸、CH3COONa晶体、浓盐酸、Ca(OH)2粉末、CH3COONH4 晶体和蒸镏水。根据:①弱酸在水中存在电离平衡;②弱酸根阴离子会破坏水的电离平衡。这两个平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两个实验方案证明CH3COOH是弱酸,请简述实验方法及现象。
(1)应用根据①的实验方法及现象 。
(2)应用根据②的实验方法及现象 。
(1)取少量CH3COOH溶液,滴加石蕊试液,溶液呈红色,然后向其中加入CH3COONH4晶体、振荡,可看到红色变浅,说明CH3COOH中存在电离平衡,既CH3COOH为弱酸。
(2)取少量CH3COONa 晶体溶于水,滴加酚酞试液,溶液呈红色,即CH3COO― 水解,破坏了水的电离平衡,说明CH3COOH是弱酸。
.下列离子方程式不正确的是 ( )
A. 氨气通入稀硫酸溶液中 NH3+H+=
B. 二氧化碳通入碳酸钠溶液中
CO2+
+H2O=2
C. 硫酸铝溶液跟偏铝酸钠溶液反应
Al3++3 +6H2O=4Al(OH)3↓
D. 氯气通入冷的氢氧化钠溶液中
2Cl2+2OH-=3Cl-+ClO-+H2O
D
下列各环境下的离子组合能过大量共存的是( )
A. 中性溶液中:Mg2+ 、Fe3+ 、SO42― 、Cl―
B. pH=0的溶液中:Al3+ 、NH4+ 、Ca2+ 、SO42―
C. c(H+)=10-14 mol·L-1 的溶液中:
Na+ 、AlO2- 、S2- 、SO32-
D. pH试纸变红的溶液中:Fe2+ 、I- 、NO3- 、ClO-
C
用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时 ( )
A. 醋酸和氢氧化钠物质的量相等
B. 醋酸和氢氧化钠恰好中和
C. 氢氧化钠过量
D. 醋酸有剩余
D
常温下把氨水滴到盐酸中,当c =c Cl- 时,混合液的pH值 ( )
A. 等于7 B. 大于7 C. 小于7 D. 无法判断
将下列0.01 mol / L的A组酸溶液各10 mL与相对的同浓度同体积的B组碱溶液混合得溶液C。C溶液pH值由大到小的顺序正确的是 ( )
A. b>c>d>a B. c>b>d>a
C. b>c>a>d D. c>b>a>d
a b c d
[A组] 酸 硫酸 盐酸 盐酸 盐酸
[B组] 碱 氢氧化钠 氢氧化钠 氢氧化钡 氨水
A
B
1.不用其它试剂,限用化学方法区别下列两组内的四种溶液:① FeCl3、BaCl2、MgSO4 Al2(SO4)3;② Al2(SO4)3、盐酸、BaCl2 K2CO3 ( )
A. 只有①组可以 B. 只有②组可以
C. 两组都可以 D. 两组都不可以
2.为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是 ( )
A. 稀释 B. 加稀硫酸 C. 加NaOH溶液 D. 加热
B
B
1.某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 ( )
A. c NH4+ >c Cl- >c OH- >c H+
B. c NH4+ > c Cl- >c OH- > c H+
C. c c Cl- >c NH4+ > c H+ >c OH-
D. c NH4+ +c H+ =c Cl- + OH-
2.pH=11的NaOH溶液和pH=3的醋酸溶液以等体积混合后,所得溶液中c Na+ c CHCOO- 的正确关系是 ( )
A. c Na+ >c CHCOO- B. c Na+ =c CHCOO-
C. c Na+ <c CHCOO- D. 不能确定
AD
C
盐类水解知识运用考点分析
考点一:确定盐溶液的离子种类和数目
考点二:解释平衡体系移动的方向
考点三:判断及比较溶液的酸碱性和pH值
考点四:涉及盐的实际用途
考点五:某些盐不能用蒸发方法结晶
考点六:某些活泼金属(如Mg)与水解产生H+的
盐溶液作用产生氢气
考点七:有关实验设计及现象解释
考点八:某些离子方程式的正误判断
考点九:某些离子大量共存问题
考点十:判断酸中和碱至pH=7时酸碱的用量
考点十一:判断中和反应、中和滴定达到“中和点”
时溶液的pH值
考点十三:比较盐溶液中离子浓度大小
考点十二:实验室贮存试剂、制备物质、物质的检验
盐类水解
实质
条件
结果
特征
影响因素
应用
1.下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是 ( )
A. Na2HPO4 B. NaHSO4 C. (NH4)2SO4 D. K2S
2. 在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是( )
A. ①=④>③=② B. ④=①>③>②
C. ①>④>③>② D. ④>①>③>②
3.NH4Cl溶于重水(D2O)生成一水合氨分子和水合氢离子的化学式是 ( )
A. NH3 ·D2O和HD2O+ B. NH3·HDO和D3O+
C. NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
B
B
D
1.当Mg(OH)2在水中达到溶解平衡时:
Mg(OH)2 Mg2++2OH- 要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是
A. NH4Cl B. NaOH C. Na2CO3 D. 干冰
2.下列物质的水溶液在加热时pH值变小的是 ( )
A. 氯化铁 B. 氯化钠 C. 盐酸 D. 碳酸钠
3.盛有0.1 mol / L的NaHCO3溶液和酚酞试液的试管,在室温时,溶液为无色,加热时为粉红色,这是因为
A. NaHCO3在加热时变成碱性更强的Na2CO3
B. 水分蒸发使NaHCO3的浓度增大
C. 加热促进NaHCO3的水解,碱性增强
D. NaHCO3在加热时变成红色
AD
A
C
1.下列化合物中,其水溶液由于水解而显酸性的是 ( )
A. NaHCO3 B. NaHSO4 C. HCl D. NH4Cl
2.物质的量浓度相等的下列溶液pH值由大到小的顺序是( )
A. Na2CO3、NaHCO3、NaCl、NH4Cl
B. Na2CO3、NaHCO3、NH4Cl、NaCl、
C. Na2CO3、NaCl、NH4Cl、NaHCO3
D. Na2CO3、NH4Cl、NaHCO3、NaCl、
A
D
小资料
在《李自成》这本书中,写到士兵在行军途中,要造饭,
“这里没有白矾(明矾),无法使浑水澄清,他们就只好用这样的泥水饮马、做饭。”问题:这里用白矾使浑水澄清,用的是什么原理。
小知识
“焊药”—金属焊接时用于除去金属表面氧化膜的溶液。请解释为什么NH4Cl、ZnCl2溶液能用作焊药,用离子方程式表示.
Al3++3H2O Al(OH)3 + 3H+
Zn2+ + 2H2O Zn (OH)2 + 2H+
NH4+ + H2O NH3 H2O + H+
生活小常识:炸油条或油饼时必须要放明矾与纯碱,请解释原理。
2Al3++3CO32- +3H2O = 2Al(OH)3↓+3CO2↑
溶液蒸干 固体物质
Na2CO3型
FeCl3 型
(NH4)2CO3或NH4HCO3 型
Ca(HCO3)2型
Mg(HCO3)2、MgCO3
(NH4)2SO4
Na2SO3
FeCl3和Fe(OH)3
Fe2O3
Mg(OH)2
Na2CO3
CaCO3
Na2SO4
(NH4)2SO4
完全分解
1.下列物质能跟镁反应并生成氢气的是
A. 甲酸溶液 B. 氢氧化钠溶液
C. 氯化铵溶液 D. 碳酸钠溶液
2.将镁粉加入到氯化铁溶液中有大量气体和红褐色沉淀生成,为什么?根据这一现象推断,镁粉加入到氯化铵溶液中,有何现象产生?并写出有关的离子方程式。
AC
因在FeCl3 溶液中Fe3+ 发生了如下水解:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ,向其中加入Mg粉后,Mg粉与 H+ 反应产生H2 ,从而打破解了其水解平衡,使水解平衡向正向移动,就产生了红褐色的Fe(OH)3沉淀。Mg 粉加到NH4Cl 溶液中有大量气体及白色沉淀产生。NH4+ + H2O NH3 ·H2O + H+ ;2H+ +Mg =Mg2+ + H2↑;Mg2+ + 2NH3·H2O = Mg(OH)2↓+ NH4+ 。
.限用下列试剂:酚酞、石蕊、稀硝酸、CH3COONa晶体、浓盐酸、Ca(OH)2粉末、CH3COONH4 晶体和蒸镏水。根据:①弱酸在水中存在电离平衡;②弱酸根阴离子会破坏水的电离平衡。这两个平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两个实验方案证明CH3COOH是弱酸,请简述实验方法及现象。
(1)应用根据①的实验方法及现象 。
(2)应用根据②的实验方法及现象 。
(1)取少量CH3COOH溶液,滴加石蕊试液,溶液呈红色,然后向其中加入CH3COONH4晶体、振荡,可看到红色变浅,说明CH3COOH中存在电离平衡,既CH3COOH为弱酸。
(2)取少量CH3COONa 晶体溶于水,滴加酚酞试液,溶液呈红色,即CH3COO― 水解,破坏了水的电离平衡,说明CH3COOH是弱酸。
.下列离子方程式不正确的是 ( )
A. 氨气通入稀硫酸溶液中 NH3+H+=
B. 二氧化碳通入碳酸钠溶液中
CO2+
+H2O=2
C. 硫酸铝溶液跟偏铝酸钠溶液反应
Al3++3 +6H2O=4Al(OH)3↓
D. 氯气通入冷的氢氧化钠溶液中
2Cl2+2OH-=3Cl-+ClO-+H2O
D
下列各环境下的离子组合能过大量共存的是( )
A. 中性溶液中:Mg2+ 、Fe3+ 、SO42― 、Cl―
B. pH=0的溶液中:Al3+ 、NH4+ 、Ca2+ 、SO42―
C. c(H+)=10-14 mol·L-1 的溶液中:
Na+ 、AlO2- 、S2- 、SO32-
D. pH试纸变红的溶液中:Fe2+ 、I- 、NO3- 、ClO-
C
用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时 ( )
A. 醋酸和氢氧化钠物质的量相等
B. 醋酸和氢氧化钠恰好中和
C. 氢氧化钠过量
D. 醋酸有剩余
D
常温下把氨水滴到盐酸中,当c =c Cl- 时,混合液的pH值 ( )
A. 等于7 B. 大于7 C. 小于7 D. 无法判断
将下列0.01 mol / L的A组酸溶液各10 mL与相对的同浓度同体积的B组碱溶液混合得溶液C。C溶液pH值由大到小的顺序正确的是 ( )
A. b>c>d>a B. c>b>d>a
C. b>c>a>d D. c>b>a>d
a b c d
[A组] 酸 硫酸 盐酸 盐酸 盐酸
[B组] 碱 氢氧化钠 氢氧化钠 氢氧化钡 氨水
A
B
1.不用其它试剂,限用化学方法区别下列两组内的四种溶液:① FeCl3、BaCl2、MgSO4 Al2(SO4)3;② Al2(SO4)3、盐酸、BaCl2 K2CO3 ( )
A. 只有①组可以 B. 只有②组可以
C. 两组都可以 D. 两组都不可以
2.为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是 ( )
A. 稀释 B. 加稀硫酸 C. 加NaOH溶液 D. 加热
B
B
1.某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 ( )
A. c NH4+ >c Cl- >c OH- >c H+
B. c NH4+ > c Cl- >c OH- > c H+
C. c c Cl- >c NH4+ > c H+ >c OH-
D. c NH4+ +c H+ =c Cl- + OH-
2.pH=11的NaOH溶液和pH=3的醋酸溶液以等体积混合后,所得溶液中c Na+ c CHCOO- 的正确关系是 ( )
A. c Na+ >c CHCOO- B. c Na+ =c CHCOO-
C. c Na+ <c CHCOO- D. 不能确定
AD
C
