电解池
图片预览




文档简介
(共11张PPT)
思考回忆
1、电解质是指在_____________能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
水溶液或熔融状态下
水溶液
熔融
自由移动离子
把化学能转化为电能
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
一、电解原理
演示试验
实验微观解释
结论:电解质通电前在水溶液中自由移动的阴、阳离子作______________运动;在外电源的作用下(直流电),改作_________移动而导电。在导电的同时,在阳、阴两极发生氧化—还原反应,即被电解,电离是__________的前题。
自由
定向
电解
电极反应式
阳极:2 CI- - 2e- = CI2 (氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
总反应:CuCI2 Cu +CI2↑
电解
1、电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
2、电解池(电解槽):把电能转化为化学能的装置。
思考???
在溶液中存在Cu2+ 、CI-、H+、OH-四种离子,为何发生氧化还原反应的是Cu2+ 、CI- ?
电解质在水溶液中放电规律
讨论:比较电解池和原电池的异同~~~~~~
例如:电解硫酸钠溶液
装置
原电池
电解池
实例
原理
形成条
电极名称
电子流向
电流方向
电极反应
能量转化
应用
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定
正极:流入电子 负极:流出电子
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源负极→阴极→阳极→电源正极
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn - 2e- =Zn2+(氧化反应)
正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 CI- - 2e- = CI2 ↑(氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
二、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
2、电镀
电极反应式
阳极:
2Cl - -2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
总反应:
2NaCl+2H2O 2NaOH +Cl2↑+H2 ↑
电镀铜原理
铜片
待镀件
硫酸铜溶液
阳极:镀层金属
电镀液:含有镀层金
属的电解质
阴极:待镀金属制品
电镀应用于铜的电解精练
电解铜原理演示
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
Zn - 2e- = Zn2+ Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥
3、电冶金
制取金属钠
电解熔融状态的氯化钠。
阳极:
2Cl - -2e- == Cl2↑
阴极:
2Na+ + 2e- == 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解熔融氯化钠制钠
思考交流
试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
小结
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1、电源、电极、电极反应关系
2、电解原理的应用:氯碱工业、电镀、电冶金
练习
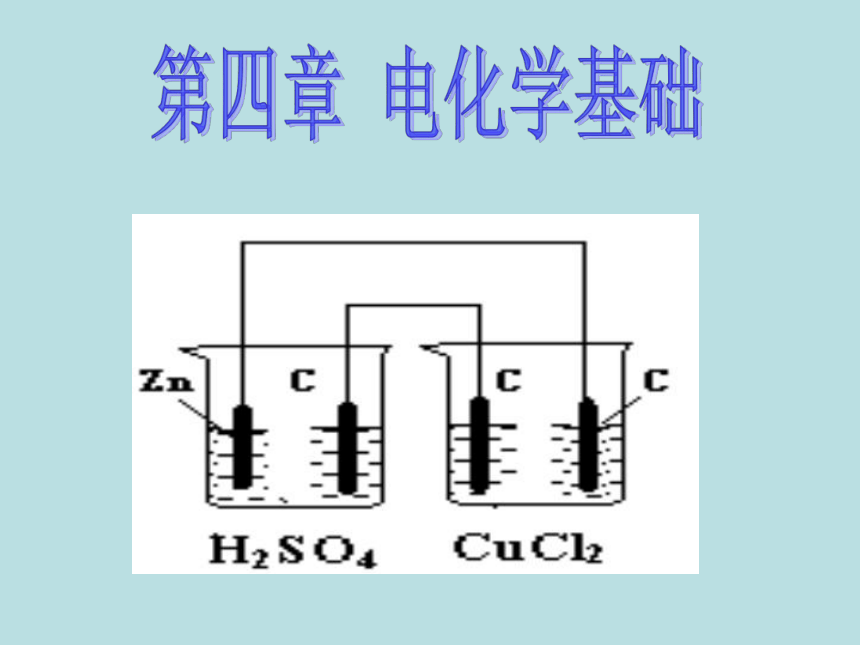
分析下图,哪个是原电池,哪个是电解池。
1.下列说法或实验现象的描述不正确的是( )。
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快
D.与电源负极相连的是电解槽的阴极
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )。
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保持不变的是( )。
A.HCl B.NaOH C.Na2SO4 D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
思考回忆
1、电解质是指在_____________能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
水溶液或熔融状态下
水溶液
熔融
自由移动离子
把化学能转化为电能
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
一、电解原理
演示试验
实验微观解释
结论:电解质通电前在水溶液中自由移动的阴、阳离子作______________运动;在外电源的作用下(直流电),改作_________移动而导电。在导电的同时,在阳、阴两极发生氧化—还原反应,即被电解,电离是__________的前题。
自由
定向
电解
电极反应式
阳极:2 CI- - 2e- = CI2 (氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
总反应:CuCI2 Cu +CI2↑
电解
1、电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
2、电解池(电解槽):把电能转化为化学能的装置。
思考???
在溶液中存在Cu2+ 、CI-、H+、OH-四种离子,为何发生氧化还原反应的是Cu2+ 、CI- ?
电解质在水溶液中放电规律
讨论:比较电解池和原电池的异同~~~~~~
例如:电解硫酸钠溶液
装置
原电池
电解池
实例
原理
形成条
电极名称
电子流向
电流方向
电极反应
能量转化
应用
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定
正极:流入电子 负极:流出电子
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源负极→阴极→阳极→电源正极
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn - 2e- =Zn2+(氧化反应)
正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 CI- - 2e- = CI2 ↑(氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
二、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
2、电镀
电极反应式
阳极:
2Cl - -2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
总反应:
2NaCl+2H2O 2NaOH +Cl2↑+H2 ↑
电镀铜原理
铜片
待镀件
硫酸铜溶液
阳极:镀层金属
电镀液:含有镀层金
属的电解质
阴极:待镀金属制品
电镀应用于铜的电解精练
电解铜原理演示
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
Zn - 2e- = Zn2+ Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥
3、电冶金
制取金属钠
电解熔融状态的氯化钠。
阳极:
2Cl - -2e- == Cl2↑
阴极:
2Na+ + 2e- == 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解熔融氯化钠制钠
思考交流
试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
小结
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1、电源、电极、电极反应关系
2、电解原理的应用:氯碱工业、电镀、电冶金
练习
分析下图,哪个是原电池,哪个是电解池。
1.下列说法或实验现象的描述不正确的是( )。
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快
D.与电源负极相连的是电解槽的阴极
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )。
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保持不变的是( )。
A.HCl B.NaOH C.Na2SO4 D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时,铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
