高中化学人教版第一章第二节化学中常用的物理量—— 物质的量 课件(共33张ppt)
文档属性
| 名称 | 高中化学人教版第一章第二节化学中常用的物理量—— 物质的量 课件(共33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-07 21:02:42 | ||
图片预览










文档简介
(共33张PPT)
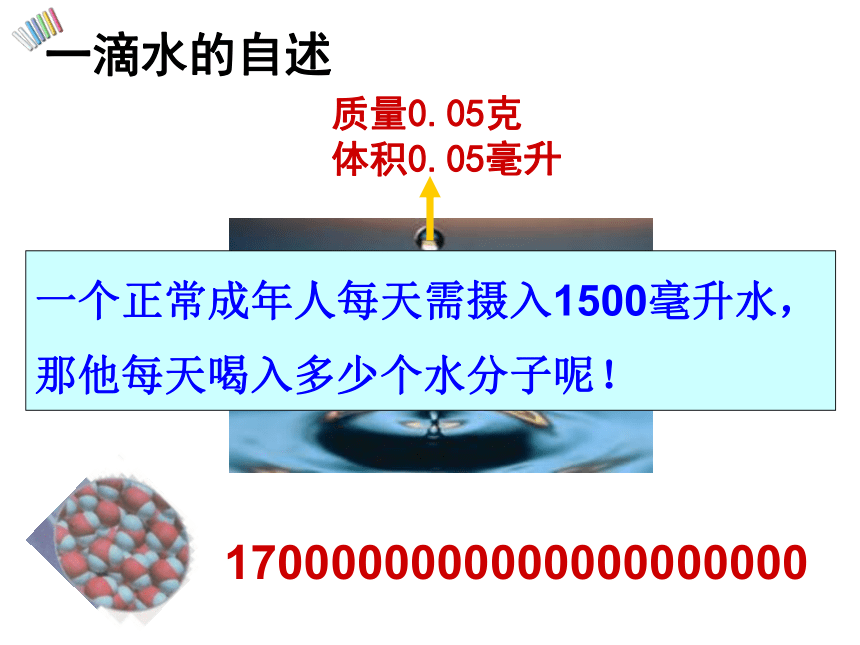
质量0.05克
体积0.05毫升
1700000000000000000000
一滴水的自述
一个正常成年人每天需摄入1500毫升水,
那他每天喝入多少个水分子呢!
一.物质的量及其单位
1.物质的量:表示含有一定微粒数目微粒的集合体。符号:n
国际单位制中七种基本物理量及其单位
物理量
长度
质量
时间
电流强度
热力学温度
物质的量
发光强度
米
m
千克(公斤)
kg
秒
s
安[培]
A
开[尔文]
K
cd
坎[德拉]
单位
单位符号
摩尔
mol
?
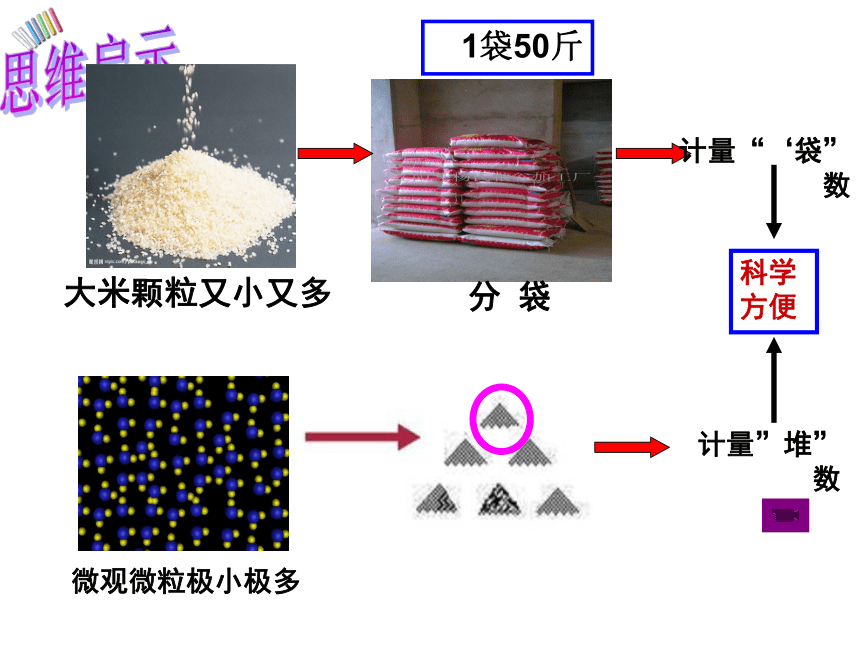
大米颗粒又小又多
分
袋
微观微粒极小极多
计量“‘袋”数
计量”堆”数
科学方便
1袋50斤
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:
NA=6.02×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次。
如果把
6.02×1023
粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:NA=6.02×1023mol-1
注意:①只适用于微观粒子,如分子、原子、离子、电子、
质子、中子等。
②使用时必须指明微粒名称,且可以用小数或分数表示。
判断下列说法是否正确?
×
1mol小米(
)
1molH2
(
)
1mol氧(
)
1molH2O
(
)
1molNa+
(
)
×
√
√
√
牛刀小试
1molH含有
个氢原子;
1molO2含有
个氧分子,有
个氧原子;
1molH2O含有
个水分子,有
个氢原子,有
个氧原子。
6.02×1023
6.02×1023
1.204×1024
1.204×1024
6.02×1023
6.02×1023
牛刀小试
(1)0.5mol
Al
所含Al原子的个数为
,
2mol
Al所含Al原子的个数为
。
(2)9.03×1023个H2O的物质的量为
,
所含H的物质的量为
,所含氧原子的
物质的量为
.
3.01×1023
1.204×1024
1.5mol
3mol
1.5mol
学以
致用
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:NA=6.02×1023mol-1
注意:①只适用于微观粒子,如分子、原子、离子、电子、
质子、中子等。
②使用时必须指明微粒名称,且可以用小数或分数表示。
3.物质的量、微粒数与阿伏伽德罗常数的关系:
1molH2O中有
mol的H;有
mol
的O
2
1
迁移●
应用
6.02×1023H2O
1molH2O
个H
个O
molH
molO
1.204×1024
6.02×1023
2
1
1个H2O中有
个H;有
个的O
2
1
化学式中:
角码比=个数比=物质的量比
2H2
+
O2
=
2H2O
2
1
2
2NA
NA
2NA
2mol
1mol
2mol
化学方程式中:
计量数比=物质的量比
18克水
27克铝
交流·研讨1
1mol几种物质的质量
1mol任何物质(粒子)的质量,以克单位时,在数值上等于它的相对原子质量或相对分子质量。
发现规律:
1mol物质的质量在数值上有什么特点?
①
O2的摩尔质量是
,1molO2质量
g,2mol
O2质量
g。
②H2O的摩尔质量是___
___;
90gH2O的物质的量是_____mol;
2molH2O的质量是
g,含有
个H2O
.
③2mol碳原子质量
g,60g碳原子物质的量为
mol
32g·mol-1
32
64
24
5
1.摩尔质量:
①概念:单位物质的量的物质所具有的质量
②公式:
摩尔质量以g·mol-1为单位时,数值上
等于其相对原子质量或相对分子质量
36
18
g·
mol-1
5
1.204×1024
二.摩尔质量和气体摩尔体积
单位:
g·mol-1
物质的量(n)
质量(m)
符号:M
0.4molNaCl的质量为
g。
64g氧气的物质的量为
mol。
2.5molCu2+的质量为
g。
31gNO3-的物质的量为
mol。
2molCO2中含氧元素的质量为
g。
gNa2SO4中含有0.5molSO42-。
1.5molSO2与 gSO3含有相同质量的氧元素。
0.04mol某物质的质量为7.2g,则该物质的摩尔质量为
,其相对分子质量为
。
23.4
2
160
0.5
64
71
80
180g·mol-1
180
【判断正误】
由于Na的相对原子质量为23,所以1molNa的质量为23。
1molCO的质量为28g,是因为CO的相对分子质量为28。
由于Na的相对原子质量为23,所以Na的摩尔质量也为23。
H2SO4的相对分子质量为98,所以H2SO4的摩尔质量为98
g·mol-1
。
23gNa的物质的量为1mol。
1molNa+的质量为23g。
SO42-的摩尔质量为96
g·mol-1,1molSO42-的质量为96g
。
√
√
√
√
√
×
×
46
0.5
⑴2molNa的质量为
g;
⑵49gH2SO4的物质的量为
mol。
科学探究
探究电解水实验
⑴电解水产生的H2
和
O2体积比约为多少?
(2)电解1.8水,计算产生的H2
和
O2
质量
物质的量
H2
O2
0.1
mol
0.05
mol
0.2
g
1.6
g
发现规律:
在相同温度和压强下,H2和O2的体积比等于物质的量比。
在相同温度和压强下,H2和O2的物质的量相同时,体积相同
标准状况
(0℃、101
kPa)下
1
mol气体的体积
物质
状态
质量
密度
体积
O2
气体
1.429
g/L
H2
气体
0.0899
g/L
体积
密度
质量
状态
物质
1.83
g/cm3
98
g
液体
H2SO4
0.998
g
/cm3
18
g
液体
H2O
2.70
g/cm3
27
g
固体
Al
7.86
g/cm3
56
g
固体
Fe
计算20℃
时1
mol
固体、液体的体积
7.1
cm3
10
cm3
18
cm3
53.6
cm3
32
g
2.016
g
22.4L
22.4
L
科学探究
计算1mol不同物质的体积
N、V气关系探究
发现规律:
①在相同的温度和压强下,
1mol固体或液体的体积不同;1mol任何气体所占体积在数值上近似相等。
②
1mol物质,固体液体体积远小于气体体积
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
固体、液体
分子直径
气体物质
分子间的平均距离
想一想:
当粒子之间距离很大时,粒子本身的大小对物质的体积影响还很大吗?
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
固体、液体
气体
气体分子间的距离和什么有关?
(温度、压强)
发现规律:
同温同压时,任何气体粒子之间的距离可以看成时相等的。因此,同温同压时,粒子数相同的任何气体都具有相同的体积
在同温同压下,相同体积的任何气体
都含有相同数目的粒子。
①概念:在一定的温度和压强下,单位物质
的量的气体所占的体积
标准状况下(0℃
101kPa):
Vm=22.4
L·mol-1(STP)
2.气体摩尔体积:
③单位:L·mol-1
②符号:Vm
n、V
关系探究
V气
利用规律:
√
1.标准状况下,1mol任何物质的体积都是22.4L。
2.
20℃,101kPa时,1mol
O2的体积是22.4L。
3.标准状况下,任何气体的摩尔体积都约为22.4L
4.标准状况下,1mol
O2和N2混合气体的体积为22.4L。
使用气体摩尔体积时注意:
①条件;
②物质的状态;③要注意单位,不要与体积单位混淆。
标准状况下,1molO2的体积为
,2molO2的体积为
。
标准状况下,44.8LH2的物质的量为
。
22.4
L
44.8
L
2
mol
物质的量(n)
气体体积(V气)
n、V
关系探究
V气
利用规律:
公式:
下列说法是否正确?为什么?在使用气体摩尔体
积时应该注意哪些问题?
(1)1mol任何气体的体积都约为22.4L。
(2)1molH2O在标况下的体积约为22.4L。
(3)标准状况下,0.4molN2和0.6molO2的混合气体的
体积约为22.4
L。
(4)标准状况下,任何气体的体积都约为22.4L。
(5)只有在标准状况时气体摩尔体积才约为22.4L·mol-1
×
√
×
×
×
牛刀小试
阿伏加德罗定律的几个推论
推论1:
同
T、P:
V1
V2
N1
N2
=
n1
n2
=
同温同压下,相同体积的下列气体中,质量最大的是(
)
A
氯气
B
氢气
C
氧气
D
氮气
A
阿伏伽德罗定律:
在同温同压下,相同体积的任何气体都含有相同数目的分子。
推论2:
P1
n1
P2
n2
——
=
—
T、V相同
阿伏加德罗定律的几个推论
2、同温同体积同质量的下列气体,产生压强最大的(
)
A、CO2
B、H2
C、O2
D、N2
B
推论3:
阿伏加德罗定律的几个推论
3、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(
)
①CO2
②H2
③Cl2
④HCl
⑤N2
①③④
同
T、P:
?1
?2
=
M1
M2
【课堂小结】
化学常用物理量,
三个概念来帮忙;
适用范围要记牢。
连接微观宏观桥,
质量0.05克
体积0.05毫升
1700000000000000000000
一滴水的自述
一个正常成年人每天需摄入1500毫升水,
那他每天喝入多少个水分子呢!
一.物质的量及其单位
1.物质的量:表示含有一定微粒数目微粒的集合体。符号:n
国际单位制中七种基本物理量及其单位
物理量
长度
质量
时间
电流强度
热力学温度
物质的量
发光强度
米
m
千克(公斤)
kg
秒
s
安[培]
A
开[尔文]
K
cd
坎[德拉]
单位
单位符号
摩尔
mol
?
大米颗粒又小又多
分
袋
微观微粒极小极多
计量“‘袋”数
计量”堆”数
科学方便
1袋50斤
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:
NA=6.02×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次。
如果把
6.02×1023
粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:NA=6.02×1023mol-1
注意:①只适用于微观粒子,如分子、原子、离子、电子、
质子、中子等。
②使用时必须指明微粒名称,且可以用小数或分数表示。
判断下列说法是否正确?
×
1mol小米(
)
1molH2
(
)
1mol氧(
)
1molH2O
(
)
1molNa+
(
)
×
√
√
√
牛刀小试
1molH含有
个氢原子;
1molO2含有
个氧分子,有
个氧原子;
1molH2O含有
个水分子,有
个氢原子,有
个氧原子。
6.02×1023
6.02×1023
1.204×1024
1.204×1024
6.02×1023
6.02×1023
牛刀小试
(1)0.5mol
Al
所含Al原子的个数为
,
2mol
Al所含Al原子的个数为
。
(2)9.03×1023个H2O的物质的量为
,
所含H的物质的量为
,所含氧原子的
物质的量为
.
3.01×1023
1.204×1024
1.5mol
3mol
1.5mol
学以
致用
一.物质的量及其单位
1.物质的量:表示物质所含微粒数目多少的物理量。符号:n
2.摩尔:是物质的量的单位,简称摩,符号:mol
标准:0.012kg12C所含的碳原子数
阿伏伽德罗常数:NA=6.02×1023mol-1
注意:①只适用于微观粒子,如分子、原子、离子、电子、
质子、中子等。
②使用时必须指明微粒名称,且可以用小数或分数表示。
3.物质的量、微粒数与阿伏伽德罗常数的关系:
1molH2O中有
mol的H;有
mol
的O
2
1
迁移●
应用
6.02×1023H2O
1molH2O
个H
个O
molH
molO
1.204×1024
6.02×1023
2
1
1个H2O中有
个H;有
个的O
2
1
化学式中:
角码比=个数比=物质的量比
2H2
+
O2
=
2H2O
2
1
2
2NA
NA
2NA
2mol
1mol
2mol
化学方程式中:
计量数比=物质的量比
18克水
27克铝
交流·研讨1
1mol几种物质的质量
1mol任何物质(粒子)的质量,以克单位时,在数值上等于它的相对原子质量或相对分子质量。
发现规律:
1mol物质的质量在数值上有什么特点?
①
O2的摩尔质量是
,1molO2质量
g,2mol
O2质量
g。
②H2O的摩尔质量是___
___;
90gH2O的物质的量是_____mol;
2molH2O的质量是
g,含有
个H2O
.
③2mol碳原子质量
g,60g碳原子物质的量为
mol
32g·mol-1
32
64
24
5
1.摩尔质量:
①概念:单位物质的量的物质所具有的质量
②公式:
摩尔质量以g·mol-1为单位时,数值上
等于其相对原子质量或相对分子质量
36
18
g·
mol-1
5
1.204×1024
二.摩尔质量和气体摩尔体积
单位:
g·mol-1
物质的量(n)
质量(m)
符号:M
0.4molNaCl的质量为
g。
64g氧气的物质的量为
mol。
2.5molCu2+的质量为
g。
31gNO3-的物质的量为
mol。
2molCO2中含氧元素的质量为
g。
gNa2SO4中含有0.5molSO42-。
1.5molSO2与 gSO3含有相同质量的氧元素。
0.04mol某物质的质量为7.2g,则该物质的摩尔质量为
,其相对分子质量为
。
23.4
2
160
0.5
64
71
80
180g·mol-1
180
【判断正误】
由于Na的相对原子质量为23,所以1molNa的质量为23。
1molCO的质量为28g,是因为CO的相对分子质量为28。
由于Na的相对原子质量为23,所以Na的摩尔质量也为23。
H2SO4的相对分子质量为98,所以H2SO4的摩尔质量为98
g·mol-1
。
23gNa的物质的量为1mol。
1molNa+的质量为23g。
SO42-的摩尔质量为96
g·mol-1,1molSO42-的质量为96g
。
√
√
√
√
√
×
×
46
0.5
⑴2molNa的质量为
g;
⑵49gH2SO4的物质的量为
mol。
科学探究
探究电解水实验
⑴电解水产生的H2
和
O2体积比约为多少?
(2)电解1.8水,计算产生的H2
和
O2
质量
物质的量
H2
O2
0.1
mol
0.05
mol
0.2
g
1.6
g
发现规律:
在相同温度和压强下,H2和O2的体积比等于物质的量比。
在相同温度和压强下,H2和O2的物质的量相同时,体积相同
标准状况
(0℃、101
kPa)下
1
mol气体的体积
物质
状态
质量
密度
体积
O2
气体
1.429
g/L
H2
气体
0.0899
g/L
体积
密度
质量
状态
物质
1.83
g/cm3
98
g
液体
H2SO4
0.998
g
/cm3
18
g
液体
H2O
2.70
g/cm3
27
g
固体
Al
7.86
g/cm3
56
g
固体
Fe
计算20℃
时1
mol
固体、液体的体积
7.1
cm3
10
cm3
18
cm3
53.6
cm3
32
g
2.016
g
22.4L
22.4
L
科学探究
计算1mol不同物质的体积
N、V气关系探究
发现规律:
①在相同的温度和压强下,
1mol固体或液体的体积不同;1mol任何气体所占体积在数值上近似相等。
②
1mol物质,固体液体体积远小于气体体积
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
固体、液体
分子直径
气体物质
分子间的平均距离
想一想:
当粒子之间距离很大时,粒子本身的大小对物质的体积影响还很大吗?
分析影响物质体积有因素有哪些?
微粒间的距离
影响物质体积的因素:
微粒数目的多少
微粒本身的大小
固体、液体
气体
气体分子间的距离和什么有关?
(温度、压强)
发现规律:
同温同压时,任何气体粒子之间的距离可以看成时相等的。因此,同温同压时,粒子数相同的任何气体都具有相同的体积
在同温同压下,相同体积的任何气体
都含有相同数目的粒子。
①概念:在一定的温度和压强下,单位物质
的量的气体所占的体积
标准状况下(0℃
101kPa):
Vm=22.4
L·mol-1(STP)
2.气体摩尔体积:
③单位:L·mol-1
②符号:Vm
n、V
关系探究
V气
利用规律:
√
1.标准状况下,1mol任何物质的体积都是22.4L。
2.
20℃,101kPa时,1mol
O2的体积是22.4L。
3.标准状况下,任何气体的摩尔体积都约为22.4L
4.标准状况下,1mol
O2和N2混合气体的体积为22.4L。
使用气体摩尔体积时注意:
①条件;
②物质的状态;③要注意单位,不要与体积单位混淆。
标准状况下,1molO2的体积为
,2molO2的体积为
。
标准状况下,44.8LH2的物质的量为
。
22.4
L
44.8
L
2
mol
物质的量(n)
气体体积(V气)
n、V
关系探究
V气
利用规律:
公式:
下列说法是否正确?为什么?在使用气体摩尔体
积时应该注意哪些问题?
(1)1mol任何气体的体积都约为22.4L。
(2)1molH2O在标况下的体积约为22.4L。
(3)标准状况下,0.4molN2和0.6molO2的混合气体的
体积约为22.4
L。
(4)标准状况下,任何气体的体积都约为22.4L。
(5)只有在标准状况时气体摩尔体积才约为22.4L·mol-1
×
√
×
×
×
牛刀小试
阿伏加德罗定律的几个推论
推论1:
同
T、P:
V1
V2
N1
N2
=
n1
n2
=
同温同压下,相同体积的下列气体中,质量最大的是(
)
A
氯气
B
氢气
C
氧气
D
氮气
A
阿伏伽德罗定律:
在同温同压下,相同体积的任何气体都含有相同数目的分子。
推论2:
P1
n1
P2
n2
——
=
—
T、V相同
阿伏加德罗定律的几个推论
2、同温同体积同质量的下列气体,产生压强最大的(
)
A、CO2
B、H2
C、O2
D、N2
B
推论3:
阿伏加德罗定律的几个推论
3、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(
)
①CO2
②H2
③Cl2
④HCl
⑤N2
①③④
同
T、P:
?1
?2
=
M1
M2
【课堂小结】
化学常用物理量,
三个概念来帮忙;
适用范围要记牢。
连接微观宏观桥,
