2011版初中化学新课标同步授课课件:13碱的性质(鲁教版九年级全一册 五四制23ppt
文档属性
| 名称 | 2011版初中化学新课标同步授课课件:13碱的性质(鲁教版九年级全一册 五四制23ppt |

|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-07 22:21:48 | ||
图片预览







文档简介
(共23张PPT)
第2课时 碱的性质
1、氢氧化钠和氢氧化钙
认识氢氧化钠和氢氧化钙
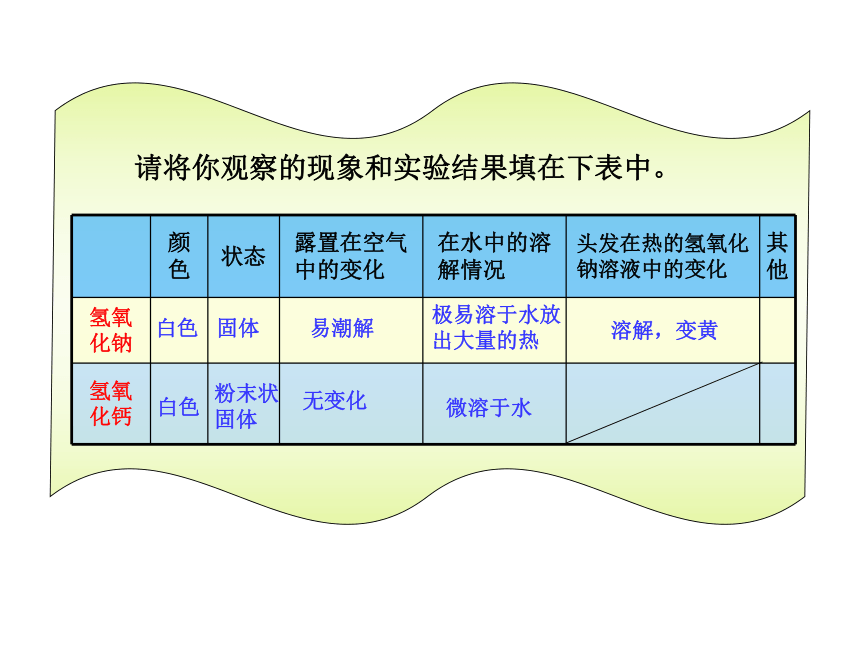
观察固体氢氧化钠和氢氧化钙的颜色、状态,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。在两只小烧杯中分别加一些固体氢氧化钠和氢氧化钙,加入水,振荡,观察它们的溶解过程,并摸一摸试管,感觉溶液温度的变化。将适量的头发(主要成分是蛋白质)放入浓氢氧化钠溶液中加热。观察头发在热的氢氧化钠溶液中的变化。
请将你观察的现象和实验结果填在下表中。
颜色 状态 露置在空气中的变化 在水中的溶解情况 头发在热的氢氧化钠溶液中的变化 其他
氢氧化钠
氢氧化钙
白色
固体
粉末状固体
白色
微溶于水
极易溶于水放出大量的热
易潮解
无变化
溶解,变黄
氢氧化钙(Ca(OH)2)
氢氧化钠(NaOH)
(1)俗名:熟石灰、消石灰
(1)暴露在空气中易潮解,因此应密封保存。
(2)俗称苛性钠、火碱或烧碱,有强烈的腐蚀性。若不慎沾到皮肤上,应立即用大量水冲洗,再涂上硼酸溶液。
CaO + H2O = Ca(OH)2
生石灰 熟石灰
反应的过程中放出大量的热。
工业上通过高温煅烧石灰石生产生石灰:
高温
CaCO3====CaO+CO2↑
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
除氢氧化钠( NaOH ) 、氢氧化钙{ Ca(OH)2 }外,常用的碱还有氢氧化钾( KOH )、氢氧化钡
{ Ba(OH)2 }、氨水( NH3·H2O )等。
(2)氢氧化钙的制备
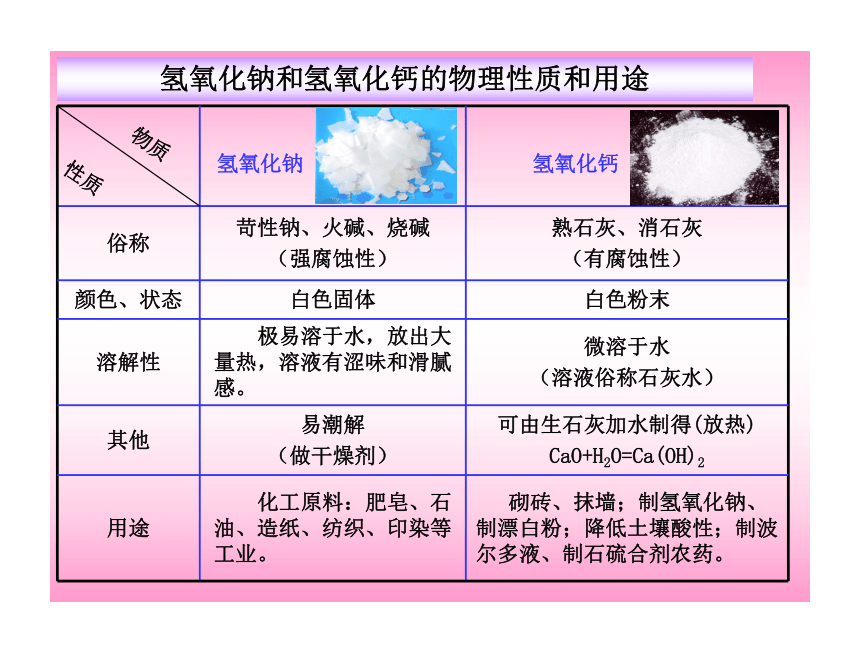
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感。 微溶于水
(溶液俗称石灰水)
其他 易潮解
(做干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液、制石硫合剂农药。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
氢氧化钠和氢氧化钙的化学性质
(1)在3支试管中分别加入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钠溶液。观察并记录实验现象。
(2)在3支试管中分别加入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钙溶液。
2、碱的化学性质
观察并记录实验现象。完成下列表格。
生锈铁钉 氯化铜溶液 碳酸钠溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无变化
无变化
蓝色沉淀
蓝色沉淀
无变化
白色沉淀
(2)氢氧化钠和非金属氧化物反应
(1)氢氧化钠和酸碱指示剂反应
2NaOH+CO2=Na2CO3+H2O
必须密封保存
(隔绝水蒸气和二氧化碳)
2NaOH+SO2=Na2SO3+H2O
亚硫酸钠
氢氧化钠和氢氧化钙的化学性质----NaOH
(3)氢氧化钠和酸反应
(4)氢氧化钠和某些盐反应
NaOH+HNO3=NaNO3+H2O
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
3NaOH+FeCl3=3NaCl+Fe(OH)3↓
生成蓝色沉淀
生成红褐色沉淀
(2)氢氧化钙和非金属氧化物反应
(3)氢氧化钙和酸反应
(4)氢氧化钙和某些盐反应
(1)氢氧化钙和酸碱指示剂反应
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Ca(OH)2+CO2=CaCO3↓+H2O
鉴别二氧化碳气体、用石灰砂浆砌砖抹墙
改良酸性土壤
制造氢氧化钠
氢氧化钠和氢氧化钙的化学性质----Ca(OH)2
碱的通性
由于碱溶液中都有OH-,因此他们具有相似的化学性质。
(2)碱与某些非金属氧化物反应
碱 + 非金属氧化物→盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O
Ca(OH)2 + CO2 == CaCO3↓+ H2O
(1)碱与酸碱指示剂的作用
紫色石蕊试液遇到碱溶液变蓝色;
无色酚酞试液遇到碱溶液变红色。
(4)碱与某些盐反应
碱 + 盐 → 新碱 + 新盐
如: CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓
Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓
(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH+ HCl==NaCl+ H2O
Ca(OH)2+H2SO4==CaSO4 +2H2O
碱的通性
2.碱+非金属氧化物=盐+水
3.碱+酸=盐+水
(中和反应)
4.碱+盐=新盐+新碱
1. 碱溶液能和酸碱指示剂反应
(酸的通性)
2.酸+金属=盐+氢气
3.酸+金属氧化物=盐+水
4.酸+碱=盐+水
(中和反应)
5.酸+盐=新盐+新酸
1. 酸溶液能和酸碱指示剂反应
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Cu(OH)2 + H2SO4 == CuSO4 + H2O
BaCl2 + H2SO4 == BaSO4↓ + 2HCl
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
(H2CO3)
CuCl2 + 2NaOH == 2NaCl + Cu(OH)2↓
讨论:请观察下面的化学方程式有什么特点,请 归纳出它们的一些规律。
化合物
化合物
化合物
化合物
1、复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
2、复分解反应的条件:
有沉淀↓析出或有气体↑放出或有水(H2O)生成。
3、特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
4、属于复分解反应的几种情况:
AB + CD
AB + CD
C
A
AB + CD
可表示为:
1.碱溶液有相似的化学性质的原因是碱溶液中都含有
( )
A.氢离子 B.氢氧根离子 C.金属离子 D.酸根离子
2.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液 B.紫色石蕊试液 C.水 D.pH试纸
3.下列物质中常用来改良土壤酸性的是( )
A.石灰石 B.熟石灰 C.干冰 D.烧碱
B
BD
B
课外作业
4.保存NaOH溶液时,下列方法中不正确的是( )
A.不避光 B.玻璃瓶配玻璃塞 C.塑料瓶装 D.密封
5.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的( )
A.稀盐酸 B.CaCl2溶液 C.CO2气体 D.澄清石灰水
B
D
7、下列物质敞口放置在空气中一段时间后,发生质变的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.氯化钠溶液
8、下列物质与盐酸反应后所得的溶液中,加入氢氧化钠溶液,能产生红褐色沉淀的是( )
A.Fe B.Fe2O3 C.CuO D.FeO
B
C
9、下列物质中,既能与盐酸反应又能跟水反应的是
( )
A.硫酸 B.生石灰
C.碳酸钙 D.熟石灰
B
10、浓硫酸、氢氧化钠固体和生石灰都能吸收空气中的水分,他们发生的变化分别属于 、 、 (填序号)
A.溶解 B.潮解 C.化合 D.吸水
D
B
C
a
X
Y
11、右图广口瓶分别装入下列各组中气体,滴管分别滴入各组中液体
①氢气、浓硫酸
②氮气、苛性钠溶液
③氯化氢、水
④二氧化碳、烧碱溶液
(1)玻璃管下端所系气球能鼓起来的
是 (填序号)
(2)若发生化学反应的请写出化学方程式:
③④
2NaOH+CO2=Na2CO3+H2O
第2课时 碱的性质
1、氢氧化钠和氢氧化钙
认识氢氧化钠和氢氧化钙
观察固体氢氧化钠和氢氧化钙的颜色、状态,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。在两只小烧杯中分别加一些固体氢氧化钠和氢氧化钙,加入水,振荡,观察它们的溶解过程,并摸一摸试管,感觉溶液温度的变化。将适量的头发(主要成分是蛋白质)放入浓氢氧化钠溶液中加热。观察头发在热的氢氧化钠溶液中的变化。
请将你观察的现象和实验结果填在下表中。
颜色 状态 露置在空气中的变化 在水中的溶解情况 头发在热的氢氧化钠溶液中的变化 其他
氢氧化钠
氢氧化钙
白色
固体
粉末状固体
白色
微溶于水
极易溶于水放出大量的热
易潮解
无变化
溶解,变黄
氢氧化钙(Ca(OH)2)
氢氧化钠(NaOH)
(1)俗名:熟石灰、消石灰
(1)暴露在空气中易潮解,因此应密封保存。
(2)俗称苛性钠、火碱或烧碱,有强烈的腐蚀性。若不慎沾到皮肤上,应立即用大量水冲洗,再涂上硼酸溶液。
CaO + H2O = Ca(OH)2
生石灰 熟石灰
反应的过程中放出大量的热。
工业上通过高温煅烧石灰石生产生石灰:
高温
CaCO3====CaO+CO2↑
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
除氢氧化钠( NaOH ) 、氢氧化钙{ Ca(OH)2 }外,常用的碱还有氢氧化钾( KOH )、氢氧化钡
{ Ba(OH)2 }、氨水( NH3·H2O )等。
(2)氢氧化钙的制备
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感。 微溶于水
(溶液俗称石灰水)
其他 易潮解
(做干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液、制石硫合剂农药。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
氢氧化钠和氢氧化钙的化学性质
(1)在3支试管中分别加入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钠溶液。观察并记录实验现象。
(2)在3支试管中分别加入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量的氢氧化钙溶液。
2、碱的化学性质
观察并记录实验现象。完成下列表格。
生锈铁钉 氯化铜溶液 碳酸钠溶液
加入氢氧化钠溶液后的现象
加入氢氧化钙溶液后的现象
无变化
无变化
蓝色沉淀
蓝色沉淀
无变化
白色沉淀
(2)氢氧化钠和非金属氧化物反应
(1)氢氧化钠和酸碱指示剂反应
2NaOH+CO2=Na2CO3+H2O
必须密封保存
(隔绝水蒸气和二氧化碳)
2NaOH+SO2=Na2SO3+H2O
亚硫酸钠
氢氧化钠和氢氧化钙的化学性质----NaOH
(3)氢氧化钠和酸反应
(4)氢氧化钠和某些盐反应
NaOH+HNO3=NaNO3+H2O
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
3NaOH+FeCl3=3NaCl+Fe(OH)3↓
生成蓝色沉淀
生成红褐色沉淀
(2)氢氧化钙和非金属氧化物反应
(3)氢氧化钙和酸反应
(4)氢氧化钙和某些盐反应
(1)氢氧化钙和酸碱指示剂反应
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Ca(OH)2+CO2=CaCO3↓+H2O
鉴别二氧化碳气体、用石灰砂浆砌砖抹墙
改良酸性土壤
制造氢氧化钠
氢氧化钠和氢氧化钙的化学性质----Ca(OH)2
碱的通性
由于碱溶液中都有OH-,因此他们具有相似的化学性质。
(2)碱与某些非金属氧化物反应
碱 + 非金属氧化物→盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O
Ca(OH)2 + CO2 == CaCO3↓+ H2O
(1)碱与酸碱指示剂的作用
紫色石蕊试液遇到碱溶液变蓝色;
无色酚酞试液遇到碱溶液变红色。
(4)碱与某些盐反应
碱 + 盐 → 新碱 + 新盐
如: CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓
Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓
(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH+ HCl==NaCl+ H2O
Ca(OH)2+H2SO4==CaSO4 +2H2O
碱的通性
2.碱+非金属氧化物=盐+水
3.碱+酸=盐+水
(中和反应)
4.碱+盐=新盐+新碱
1. 碱溶液能和酸碱指示剂反应
(酸的通性)
2.酸+金属=盐+氢气
3.酸+金属氧化物=盐+水
4.酸+碱=盐+水
(中和反应)
5.酸+盐=新盐+新酸
1. 酸溶液能和酸碱指示剂反应
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Cu(OH)2 + H2SO4 == CuSO4 + H2O
BaCl2 + H2SO4 == BaSO4↓ + 2HCl
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
(H2CO3)
CuCl2 + 2NaOH == 2NaCl + Cu(OH)2↓
讨论:请观察下面的化学方程式有什么特点,请 归纳出它们的一些规律。
化合物
化合物
化合物
化合物
1、复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
2、复分解反应的条件:
有沉淀↓析出或有气体↑放出或有水(H2O)生成。
3、特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
4、属于复分解反应的几种情况:
AB + CD
AB + CD
C
A
AB + CD
可表示为:
1.碱溶液有相似的化学性质的原因是碱溶液中都含有
( )
A.氢离子 B.氢氧根离子 C.金属离子 D.酸根离子
2.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液 B.紫色石蕊试液 C.水 D.pH试纸
3.下列物质中常用来改良土壤酸性的是( )
A.石灰石 B.熟石灰 C.干冰 D.烧碱
B
BD
B
课外作业
4.保存NaOH溶液时,下列方法中不正确的是( )
A.不避光 B.玻璃瓶配玻璃塞 C.塑料瓶装 D.密封
5.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的( )
A.稀盐酸 B.CaCl2溶液 C.CO2气体 D.澄清石灰水
B
D
7、下列物质敞口放置在空气中一段时间后,发生质变的是( )
A.浓硫酸 B.浓盐酸
C.氢氧化钠溶液 D.氯化钠溶液
8、下列物质与盐酸反应后所得的溶液中,加入氢氧化钠溶液,能产生红褐色沉淀的是( )
A.Fe B.Fe2O3 C.CuO D.FeO
B
C
9、下列物质中,既能与盐酸反应又能跟水反应的是
( )
A.硫酸 B.生石灰
C.碳酸钙 D.熟石灰
B
10、浓硫酸、氢氧化钠固体和生石灰都能吸收空气中的水分,他们发生的变化分别属于 、 、 (填序号)
A.溶解 B.潮解 C.化合 D.吸水
D
B
C
a
X
Y
11、右图广口瓶分别装入下列各组中气体,滴管分别滴入各组中液体
①氢气、浓硫酸
②氮气、苛性钠溶液
③氯化氢、水
④二氧化碳、烧碱溶液
(1)玻璃管下端所系气球能鼓起来的
是 (填序号)
(2)若发生化学反应的请写出化学方程式:
③④
2NaOH+CO2=Na2CO3+H2O
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
