九年级下册实验活动5一定溶质质量分数的氯化钠溶液的配制同步练习(含解析答案)
文档属性
| 名称 | 九年级下册实验活动5一定溶质质量分数的氯化钠溶液的配制同步练习(含解析答案) |  | |
| 格式 | docx | ||
| 文件大小 | 68.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-08 17:35:31 | ||
图片预览



文档简介
实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、单选题
1.???以下是同学们设计的几个实验方案,你认为能达到预期目的的是( )
A.?用12mL蒸馏水和20mL酒精配制32mL酒精溶液
B.?用红色或蓝色的石蕊试纸均可以验证醋酸具有酸性
C.?用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照读出待测液的pH
D.?用天平、烧杯、玻璃棒、量筒、胶头滴管、药匙等仪器配制一定温度下16%的硝酸钾溶液
2.???下列有关溶液的说法错误的是( )
A.?均一、稳定的液体一定是溶液
B.?溶液中的溶质可以是固体,也可以是液体或气体
C.?硝酸铵溶解过程中扩散过程吸收的热量大于水合过程放出的热量
D.?用量筒量取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大
3.???配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.?烧杯??????????????????????B.?量筒???????????????????????C.?铁架台??????????????????????D.?玻璃棒
4.???实验室用氯化钠固体配制50g溶质质量分数为5%的氯化钠溶液。下列说法正确的是( )
A.?所配制溶液中溶质和溶剂的质量比为1:20
B.?将称量好的氯化钠固体放入50mL量筒中溶解
C.?量取水时,仰视读数可能导致所配制溶液的溶质质量分数偏小
D.?溶解过程中用玻璃棒搅拌的目的是增大氯化钠在水中的溶解度
5.???回顾基础实验“配制50g溶质质量分数为6%的氯化钠溶液”。下列做法不正确的是( )
A.?计算:需要氯化钠的质量为3g,需要水的体积为47mL
B.?称取氯化钠:用药匙往托盘天平左盘的纸片上加氯化钠,当发现指针向左偏转,应该将砝码向右移动
C.?量取水:量取水时仰视读数,会导致配制的溶液质量分数偏小
D.?溶解、转移:用玻璃棒搅拌至氯化钠完全溶解,将配好的溶液倒入细口瓶中,盖紧瓶塞,贴上标签
6.???要配制50g质量分数为10%的氯化钠溶液,下列说法错误的是( )
A.?需称量的氯化钠固体为5g????????????????????????????????????????
B.?在烧杯中配制溶液????????????????????????????????????????
C.?把配制好的溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签????????????????????
D.?俯视读数导致溶质质量分数偏大
二、简答题
7.???回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要______g氯化钠固体.
①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是如图的______(填字母).
②下列仪器中,量取水时需要用到d和______仪器(填序号),溶解时需要用到e和______仪器(填序号).
a.烧杯
b.10mL量筒
c.100mL量筒
d.滴管
e.玻璃棒
f.药匙
g.蒸发皿
(2)在实验室配制溶液时,常涉及以下过程:
①称量、量取;
②过滤;
③蒸发结晶、干燥;
④计算;
⑤溶解.
用氯化钠和蒸馏水配制100g 10%的氯化钠溶液,正确的操作顺序是______(用以上序号填空).
8.???在实验室里配制10溶质质量分数为10%的NaCl溶液。
(1)用NaCl固体和蒸馏水配制溶液时,到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______;
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后______的质量保持不变;
(3)下列配制方法可以达到上述实验目的的是______。(填序号)
A.将10g NaCl固体与100g水混合溶解
B.向50g溶质质量分数为20%的NaCl溶液中加入50g水
C.向20g溶质质量分数为20%的NaCl溶液中加入80g溶质质量分数为7.5%的NaCl溶液
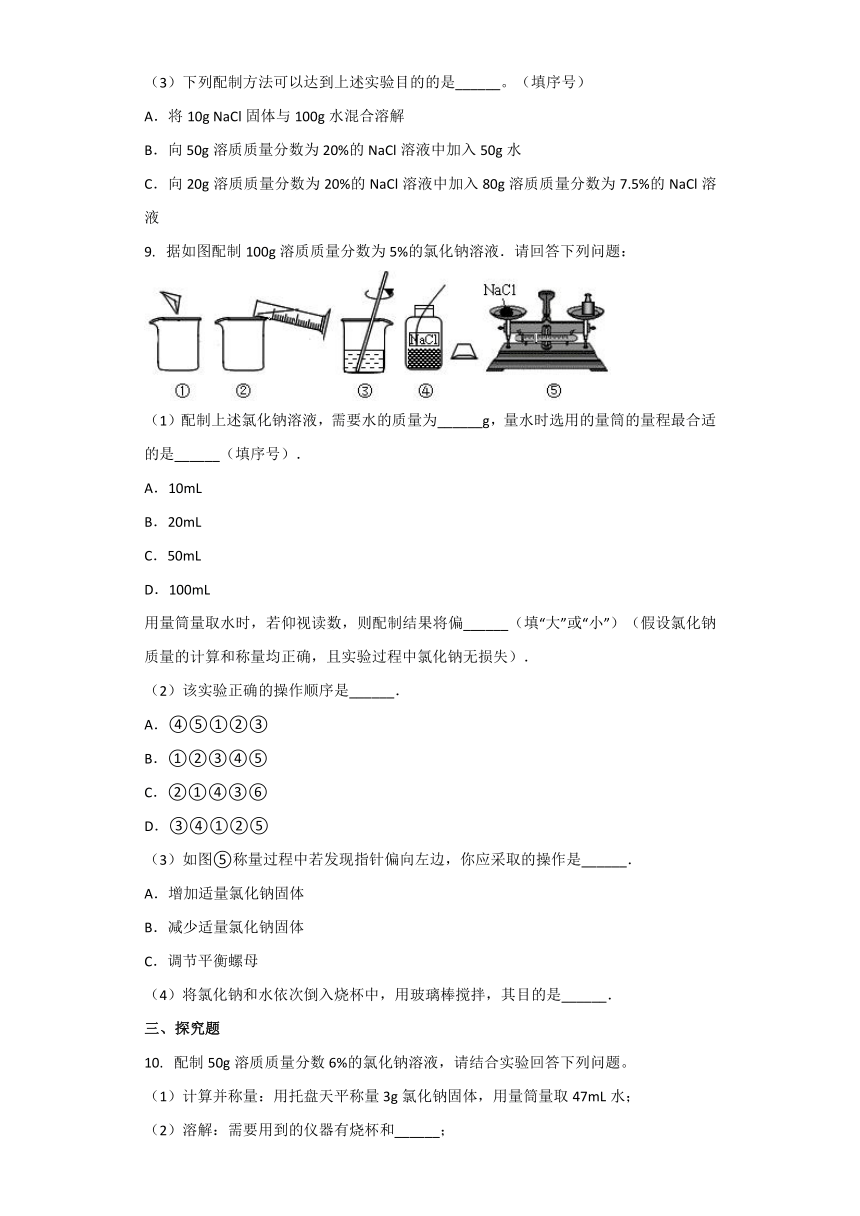
9.???据如图配制100g溶质质量分数为5%的氯化钠溶液.请回答下列问题:
(1)配制上述氯化钠溶液,需要水的质量为______g,量水时选用的量筒的量程最合适的是______(填序号).
A.10mL
B.20mL
C.50mL
D.100mL
用量筒量取水时,若仰视读数,则配制结果将偏______(填“大”或“小”)(假设氯化钠质量的计算和称量均正确,且实验过程中氯化钠无损失).
(2)该实验正确的操作顺序是______.
A.④⑤①②③
B.①②③④⑤
C.②①④③⑥
D.③④①②⑤
(3)如图⑤称量过程中若发现指针偏向左边,你应采取的操作是______.
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是______.
三、探究题
10.???配制50g溶质质量分数6%的氯化钠溶液,请结合实验回答下列问题。
(1)计算并称量:用托盘天平称量3g氯化钠固体,用量筒量取47mL水;
(2)溶解:需要用到的仪器有烧杯和______;
(3)下列实验操作中,会引起溶质质量分数偏差的有______;
A.称量药品时药品和砝码放反
B.量取水时俯视读数
C.装瓶时洒出少量溶液
(4)用25%的氯化钠溶液______g和适量的水混合也可以配制50g质量分数6%的氯化钠溶液。
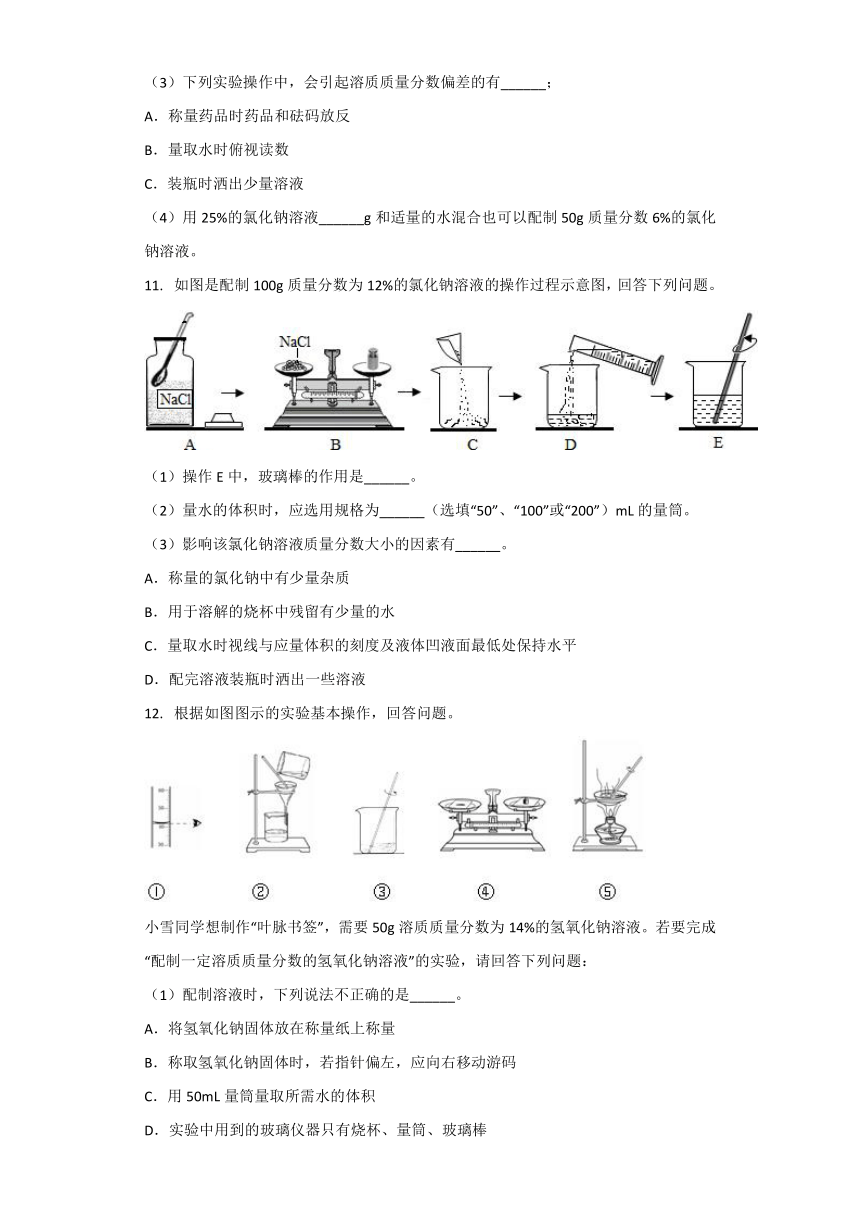
11.???如图是配制100g质量分数为12%的氯化钠溶液的操作过程示意图,回答下列问题。
(1)操作E中,玻璃棒的作用是______。
(2)量水的体积时,应选用规格为______(选填“50”、“100”或“200”)mL的量筒。
(3)影响该氯化钠溶液质量分数大小的因素有______。
A.称量的氯化钠中有少量杂质
B.用于溶解的烧杯中残留有少量的水
C.量取水时视线与应量体积的刻度及液体凹液面最低处保持水平
D.配完溶液装瓶时洒出一些溶液
???根据如图图示的实验基本操作,回答问题。
小雪同学想制作“叶脉书签”,需要50g溶质质量分数为14%的氢氧化钠溶液。若要完成“配制一定溶质质量分数的氢氧化钠溶液”的实验,请回答下列问题:
(1)配制溶液时,下列说法不正确的是______。
A.将氢氧化钠固体放在称量纸上称量
B.称取氢氧化钠固体时,若指针偏左,应向右移动游码
C.用50mL量筒量取所需水的体积
D.实验中用到的玻璃仪器只有烧杯、量筒、玻璃棒
(2)在用量筒量取所需水的过程中,小明俯视读数,这样配得的溶液溶质质量分数会______(填“偏低”、“偏高”或“无影响”)。
实验活动5 一定溶质质量分数的氯化钠溶液的配制
【答案】
1.??D???????2.??A???????3.??C???????4.??C???????5.??B???????
6.??C???????
7.??10? B? c? a? ④①⑤???????
8.??量筒? 溶质? BC???????
9.??95? D? 小? A? B? 加快溶解速率???????
10.??玻璃棒? AB? 12???????
11.??搅拌,加快溶解速率? 100? AB???????
12.??ABD? 偏高???????
【解析】
1.??
解:A、分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,12mL蒸馏水和20mL酒精配制的酒精溶液的体积小于32mL,故选项实验不能达到预期目的。
B、可用蓝色的石蕊试纸可以验证醋酸具有酸性,不能使用红色的石蕊试纸,故选项实验不能达到预期目的。
C、用pH试纸测定溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把试纸显示的颜色与标准比色卡对比来确定pH.不能用水湿润pH试纸,若溶液显酸性或碱性,则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故选项实验不能达到预期目的。
D、配制一定温度下16%的硝酸钾溶液的操作步骤分别是:计算、称量、溶解,药匙用于取用硝酸钾,托盘天平用于称取固体硝酸钾、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,故选项实验能达到预期目的。
故选:D。
A、根据分子间有间隔,进行分析判断。
B、根据酸的化学性质,进行分析判断。
C、根据用pH试纸测定溶液的pH的方法进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
2.??
解:A、均一、稳定的液体不一定是溶液,如水,故选项说法错误。
B、溶液中的溶质可以是固体,也可以是液体或气体,故选项说法正确。
C、硝酸铵溶解过程中扩散过程吸收的热量大于水合过程放出的热量,整体表现出吸热,故选项说法正确。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
故选:A.
A、根据溶液是均一稳定的混合物,进行分析判断。
B、根据溶质的状态,进行分析判断。
C、根据硝酸铵溶于水吸热,进行分析判断。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
本题难度不大,判断错误操作对溶剂的影响、了解溶液是均一稳定的混合物、硝酸铵溶于水吸热等是正确解答本题的关键。
3.??
解:A、配制50g质量分数为6%的氯化钠溶液,烧杯用于完成溶解操作,故A错误;
B、配制50g质量分数为6%的氯化钠溶液,量筒用于准确量取水,故B错误;
C、配制50g质量分数为6%的氯化钠溶液,配制溶液的过程中不需要使用铁架台,故C正确;
D、配制50g质量分数为6%的氯化钠溶液,玻璃棒用于搅拌,加速氯化钠的溶解,故D错误。
故选:C。
根据实验室配制50g质量分数为6%的氯化钠溶液的操作步骤分别是:计算、称量、溶解,结合各操作所需要使用的仪器,判断所列仪器是否需要。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需的仪器是正确解答本题的关键。
4.??
解:A.5%的氯化钠溶液中,溶质和溶剂的质量比为5:95=1:19,选项说法错误;
B.量筒只能用于量取一定体积的液体,不能用于溶液的配制,配制溶液应在烧杯中进行,选项说法错误;
C.量取水时,仰视读数导致量取的水偏多,造成所配制溶液的溶质质量分数偏小,选项说法正确;
D.溶解过程中用玻璃棒搅拌的目的是加快氯化钠的溶解速率,不能增大氯化钠的溶解度,选项说法错误。
故选:C。
A.根据溶质的质量分数来分析;
B.根据仪器的用途来分析;
C.根据量筒的读数方法以及溶质的质量分数来分析;
D.根据玻璃棒搅拌的目的来分析。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、所需的仪器是正确解答本题的关键。
5.??
解:A、溶质质量=溶液质量×溶质的质量分数,配制50g溶质质量分数为6%的氯化钠溶液,需氯化钠的质量=50g×6%=3g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-3g=47g(合47mL),故选项说法正确。
B、用药匙往托盘天平左盘的纸片上加氯化钠,当发现指针向左偏转,说明药品的质量大于砝码的质量,应减少药品,故选项说法错误。
C、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法正确。
D、用玻璃棒搅拌至氯化钠完全溶解,将配好的溶液倒入细口瓶中,盖紧瓶塞,贴上标签,故选项说法正确。
故选:B。
A、利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
6.??
解:A、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为10%的氯化钠溶液,需氯化钠的质量=50g×10%=5g,故选项说法正确。
B、溶解操作在烧杯中进行,故选项说法正确。
C、刚用蒸馏水润洗过的试剂瓶中含有水,把配制好的溶液倒入刚用蒸馏水润洗过的试剂瓶中,相当于稀释了溶液,溶质质量分数偏小,故选项说法错误。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
故选:C。
A、利用溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、刚用蒸馏水润洗过的试剂瓶中含有水,进行分析判断。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
7.??
解:需溶质质量为:100g×10%=10g,
①用质量为23.1g的烧杯盛放10g固体,在托盘天平上已放30g的砝码,游码应为3.1g,游码的左侧与3.1g处相齐;
②由于水需要100g-10g=90g,体积为90mL,选取量筒时选取比90大且最接近的,所以选取100mL的量筒,溶解时用到烧杯,还需要用玻璃棒搅拌,加速溶解.
(2)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.所以甲同学的配制顺序为④①⑤;
故答案为:(1)10;
①B;
②c;a;
(2)④①⑤。
(1)根据溶质质量=溶液质量×溶质质量分数进行解答;
①根据游码的读法进行分析;
②根据量筒量程的选取原则进行分析;根据溶解的过程考虑所用仪器进行分析.
(2)根据配制溶液的基本步骤来考虑操作顺序,分析解答.
通过解答本题知道了溶质、溶剂质量的计算方法,用天平称量时游码的使用方法和注意事项,掌握了量筒的选取方法和溶解的注意事项.
8.??
解:(1)用NaCl固体和蒸馏水配制溶液时,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和量筒;
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后溶质的质量保持不变;
(3)A.将10gNaCl固体与100g水混合溶解,所得溶液中溶质的质量分数为:10/(10+100)*100%<10%,故错误;
B.向50g溶质的质量分数为20%的NaCl溶液中加入50g,所得溶液中溶质的质量分数为:50*20%/(50+50)*100%=10%,且溶液的质量为100g,故正确。
C、向20g溶质质量分数为20%的NaCl溶液中加入80g溶质质量分数为7.5%的NaCl溶液,所得溶液中溶质的质量分数为10%,且溶液的质量为100g,故正确;
故选:BC。
故答案为:(1)量筒;(2)溶质;(3)BC.
(1)根据配制溶液所需仪器来分析;
(2)根据溶液稀释过程中溶质的质量不变来分析;
(3)根据溶质质量分数的计算方法来分析。
掌握溶质的质量分数的计算式并会进行应用解决相关问题,了解溶液配制的注意事项等是解决此题的关键因素。
9.??
解:(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g(合95mL).应用规格为100mL的量筒量取水的体积.
用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。
(2)配制100g5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,该实验正确的操作顺序是④⑤①②③。
(3)使用托盘天平称量药品时应遵循“左物右码”,称量过程中发现指针偏左,说明药品质量大于砝码质量,说明氢氧化钠的质量大于砝码质量,应减少氢氧化钠,直至天平平衡。
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是加快溶解速率。
故答案为:
(1)95;D;小;
(2)A;
(3)B;
(4)加快溶解速率。
(1)利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析解答.
(2)根据配制溶质质量分数一定的溶液的基本步骤,进行分析解答.
(3)使用托盘天平称量药品时应遵循“左物右码”,称量过程中发现指针偏左,说明药品质量大于砝码质量,进行分析解答。
(4)根据溶解操作中搅拌的作用,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键.
10.??
解:(2)溶解过程中需要用到的仪器是烧杯和玻璃棒。玻璃棒的作用是搅拌,加快氯化钠的溶解速率;
(3)A.称量药品时药品和砝码放反,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故错误。
B.量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故错误。
C.溶于具有均一性,装瓶时洒出少量溶液,溶质质量分数不变,故正确。
(4)设用25%的氢氧化钠溶液的质量为x,根据溶液稀释前后溶质的质量不变,
则50g×6%=x×25%????? ?x=12g。
故答案为:(2)玻璃棒;
(3)AB;
(4)12。
(1)利用溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶解操作所需的仪器,进行分析解答。
(3)溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因进行分析解答。
(4)根据溶液稀释前后溶质的质量不变,结合溶质质量=溶液质量×溶质的质量分数,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、注意事项等是正确解答本题的关键。
11.??
解:(1)操作E是溶解操作,玻璃棒的作用是搅拌,加快溶解速率。
(2)溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为12%的氯化钠溶液,需氯化钠的质量=100g×12%=12g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-12g=88g(合88mL);应用规格为100mL的量筒量取水的体积.
(3)A.称量的氯化钠中有少量杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
B.用于溶解的烧杯中残留有少量的水,会造成实际取的水的体积偏大,则使溶质质量分数偏小。
C.量取水时视线与应量体积的刻度及液体凹液面最低处保持水平,是正确的操作,不会影响该氯化钠溶液质量分数大小。
D.配完溶液装瓶时洒出一些溶液,溶液具有均一性,溶质质量分数不变。
故答案为:
(1)搅拌,加快溶解速率;
(2)100;
(3)AB。
(1)操作E是溶解操作,进行分析解答。
(2)利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析解答.
(3)根据溶质质量偏小(或偏大)或溶剂质量偏大(或偏小),分析出可能造成这两个方面错误的原因,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键.
12.??
解:(1)A.氢氧化钠具有腐蚀性,不能将氢氧化钠固体放在称量纸上称量,应放在玻璃器皿中称量,故选项说法错误。
B.称取氢氧化钠固体时,若指针偏左,说明药品的质量大于砝码质量,应减少药品,直至天平平衡,故选项说法错误。
C.配制50g溶质质量分数为14%的氢氧化钠溶液,需氢氧化钠的质量=50g×14%=7g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7g=43g(合43mL)。可用50mL量筒量取所需水的体积,故选项说法正确。
D.配制50g溶质质量分数为14%的氢氧化钠溶液,首先计算配制溶液所需氢氧化钠和水的质量,再称量所需的氢氧化钠和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒,故选项说法错误。
(2)用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏高。
故答案为:
(1)ABD;
(2)偏高。
(1)A、根据氢氧化钠具有腐蚀性,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析判断。
D、根据配制溶质质量分数一定的溶液的步骤,进行分析判断。
(2)用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
一、单选题
1.???以下是同学们设计的几个实验方案,你认为能达到预期目的的是( )
A.?用12mL蒸馏水和20mL酒精配制32mL酒精溶液
B.?用红色或蓝色的石蕊试纸均可以验证醋酸具有酸性
C.?用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照读出待测液的pH
D.?用天平、烧杯、玻璃棒、量筒、胶头滴管、药匙等仪器配制一定温度下16%的硝酸钾溶液
2.???下列有关溶液的说法错误的是( )
A.?均一、稳定的液体一定是溶液
B.?溶液中的溶质可以是固体,也可以是液体或气体
C.?硝酸铵溶解过程中扩散过程吸收的热量大于水合过程放出的热量
D.?用量筒量取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大
3.???配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.?烧杯??????????????????????B.?量筒???????????????????????C.?铁架台??????????????????????D.?玻璃棒
4.???实验室用氯化钠固体配制50g溶质质量分数为5%的氯化钠溶液。下列说法正确的是( )
A.?所配制溶液中溶质和溶剂的质量比为1:20
B.?将称量好的氯化钠固体放入50mL量筒中溶解
C.?量取水时,仰视读数可能导致所配制溶液的溶质质量分数偏小
D.?溶解过程中用玻璃棒搅拌的目的是增大氯化钠在水中的溶解度
5.???回顾基础实验“配制50g溶质质量分数为6%的氯化钠溶液”。下列做法不正确的是( )
A.?计算:需要氯化钠的质量为3g,需要水的体积为47mL
B.?称取氯化钠:用药匙往托盘天平左盘的纸片上加氯化钠,当发现指针向左偏转,应该将砝码向右移动
C.?量取水:量取水时仰视读数,会导致配制的溶液质量分数偏小
D.?溶解、转移:用玻璃棒搅拌至氯化钠完全溶解,将配好的溶液倒入细口瓶中,盖紧瓶塞,贴上标签
6.???要配制50g质量分数为10%的氯化钠溶液,下列说法错误的是( )
A.?需称量的氯化钠固体为5g????????????????????????????????????????
B.?在烧杯中配制溶液????????????????????????????????????????
C.?把配制好的溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签????????????????????
D.?俯视读数导致溶质质量分数偏大
二、简答题
7.???回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要______g氯化钠固体.
①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是如图的______(填字母).
②下列仪器中,量取水时需要用到d和______仪器(填序号),溶解时需要用到e和______仪器(填序号).
a.烧杯
b.10mL量筒
c.100mL量筒
d.滴管
e.玻璃棒
f.药匙
g.蒸发皿
(2)在实验室配制溶液时,常涉及以下过程:
①称量、量取;
②过滤;
③蒸发结晶、干燥;
④计算;
⑤溶解.
用氯化钠和蒸馏水配制100g 10%的氯化钠溶液,正确的操作顺序是______(用以上序号填空).
8.???在实验室里配制10溶质质量分数为10%的NaCl溶液。
(1)用NaCl固体和蒸馏水配制溶液时,到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______;
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后______的质量保持不变;
(3)下列配制方法可以达到上述实验目的的是______。(填序号)
A.将10g NaCl固体与100g水混合溶解
B.向50g溶质质量分数为20%的NaCl溶液中加入50g水
C.向20g溶质质量分数为20%的NaCl溶液中加入80g溶质质量分数为7.5%的NaCl溶液
9.???据如图配制100g溶质质量分数为5%的氯化钠溶液.请回答下列问题:
(1)配制上述氯化钠溶液,需要水的质量为______g,量水时选用的量筒的量程最合适的是______(填序号).
A.10mL
B.20mL
C.50mL
D.100mL
用量筒量取水时,若仰视读数,则配制结果将偏______(填“大”或“小”)(假设氯化钠质量的计算和称量均正确,且实验过程中氯化钠无损失).
(2)该实验正确的操作顺序是______.
A.④⑤①②③
B.①②③④⑤
C.②①④③⑥
D.③④①②⑤
(3)如图⑤称量过程中若发现指针偏向左边,你应采取的操作是______.
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是______.
三、探究题
10.???配制50g溶质质量分数6%的氯化钠溶液,请结合实验回答下列问题。
(1)计算并称量:用托盘天平称量3g氯化钠固体,用量筒量取47mL水;
(2)溶解:需要用到的仪器有烧杯和______;
(3)下列实验操作中,会引起溶质质量分数偏差的有______;
A.称量药品时药品和砝码放反
B.量取水时俯视读数
C.装瓶时洒出少量溶液
(4)用25%的氯化钠溶液______g和适量的水混合也可以配制50g质量分数6%的氯化钠溶液。
11.???如图是配制100g质量分数为12%的氯化钠溶液的操作过程示意图,回答下列问题。
(1)操作E中,玻璃棒的作用是______。
(2)量水的体积时,应选用规格为______(选填“50”、“100”或“200”)mL的量筒。
(3)影响该氯化钠溶液质量分数大小的因素有______。
A.称量的氯化钠中有少量杂质
B.用于溶解的烧杯中残留有少量的水
C.量取水时视线与应量体积的刻度及液体凹液面最低处保持水平
D.配完溶液装瓶时洒出一些溶液
???根据如图图示的实验基本操作,回答问题。
小雪同学想制作“叶脉书签”,需要50g溶质质量分数为14%的氢氧化钠溶液。若要完成“配制一定溶质质量分数的氢氧化钠溶液”的实验,请回答下列问题:
(1)配制溶液时,下列说法不正确的是______。
A.将氢氧化钠固体放在称量纸上称量
B.称取氢氧化钠固体时,若指针偏左,应向右移动游码
C.用50mL量筒量取所需水的体积
D.实验中用到的玻璃仪器只有烧杯、量筒、玻璃棒
(2)在用量筒量取所需水的过程中,小明俯视读数,这样配得的溶液溶质质量分数会______(填“偏低”、“偏高”或“无影响”)。
实验活动5 一定溶质质量分数的氯化钠溶液的配制
【答案】
1.??D???????2.??A???????3.??C???????4.??C???????5.??B???????
6.??C???????
7.??10? B? c? a? ④①⑤???????
8.??量筒? 溶质? BC???????
9.??95? D? 小? A? B? 加快溶解速率???????
10.??玻璃棒? AB? 12???????
11.??搅拌,加快溶解速率? 100? AB???????
12.??ABD? 偏高???????
【解析】
1.??
解:A、分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,12mL蒸馏水和20mL酒精配制的酒精溶液的体积小于32mL,故选项实验不能达到预期目的。
B、可用蓝色的石蕊试纸可以验证醋酸具有酸性,不能使用红色的石蕊试纸,故选项实验不能达到预期目的。
C、用pH试纸测定溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把试纸显示的颜色与标准比色卡对比来确定pH.不能用水湿润pH试纸,若溶液显酸性或碱性,则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故选项实验不能达到预期目的。
D、配制一定温度下16%的硝酸钾溶液的操作步骤分别是:计算、称量、溶解,药匙用于取用硝酸钾,托盘天平用于称取固体硝酸钾、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,故选项实验能达到预期目的。
故选:D。
A、根据分子间有间隔,进行分析判断。
B、根据酸的化学性质,进行分析判断。
C、根据用pH试纸测定溶液的pH的方法进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
2.??
解:A、均一、稳定的液体不一定是溶液,如水,故选项说法错误。
B、溶液中的溶质可以是固体,也可以是液体或气体,故选项说法正确。
C、硝酸铵溶解过程中扩散过程吸收的热量大于水合过程放出的热量,整体表现出吸热,故选项说法正确。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
故选:A.
A、根据溶液是均一稳定的混合物,进行分析判断。
B、根据溶质的状态,进行分析判断。
C、根据硝酸铵溶于水吸热,进行分析判断。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
本题难度不大,判断错误操作对溶剂的影响、了解溶液是均一稳定的混合物、硝酸铵溶于水吸热等是正确解答本题的关键。
3.??
解:A、配制50g质量分数为6%的氯化钠溶液,烧杯用于完成溶解操作,故A错误;
B、配制50g质量分数为6%的氯化钠溶液,量筒用于准确量取水,故B错误;
C、配制50g质量分数为6%的氯化钠溶液,配制溶液的过程中不需要使用铁架台,故C正确;
D、配制50g质量分数为6%的氯化钠溶液,玻璃棒用于搅拌,加速氯化钠的溶解,故D错误。
故选:C。
根据实验室配制50g质量分数为6%的氯化钠溶液的操作步骤分别是:计算、称量、溶解,结合各操作所需要使用的仪器,判断所列仪器是否需要。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需的仪器是正确解答本题的关键。
4.??
解:A.5%的氯化钠溶液中,溶质和溶剂的质量比为5:95=1:19,选项说法错误;
B.量筒只能用于量取一定体积的液体,不能用于溶液的配制,配制溶液应在烧杯中进行,选项说法错误;
C.量取水时,仰视读数导致量取的水偏多,造成所配制溶液的溶质质量分数偏小,选项说法正确;
D.溶解过程中用玻璃棒搅拌的目的是加快氯化钠的溶解速率,不能增大氯化钠的溶解度,选项说法错误。
故选:C。
A.根据溶质的质量分数来分析;
B.根据仪器的用途来分析;
C.根据量筒的读数方法以及溶质的质量分数来分析;
D.根据玻璃棒搅拌的目的来分析。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、所需的仪器是正确解答本题的关键。
5.??
解:A、溶质质量=溶液质量×溶质的质量分数,配制50g溶质质量分数为6%的氯化钠溶液,需氯化钠的质量=50g×6%=3g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-3g=47g(合47mL),故选项说法正确。
B、用药匙往托盘天平左盘的纸片上加氯化钠,当发现指针向左偏转,说明药品的质量大于砝码的质量,应减少药品,故选项说法错误。
C、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法正确。
D、用玻璃棒搅拌至氯化钠完全溶解,将配好的溶液倒入细口瓶中,盖紧瓶塞,贴上标签,故选项说法正确。
故选:B。
A、利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
6.??
解:A、溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为10%的氯化钠溶液,需氯化钠的质量=50g×10%=5g,故选项说法正确。
B、溶解操作在烧杯中进行,故选项说法正确。
C、刚用蒸馏水润洗过的试剂瓶中含有水,把配制好的溶液倒入刚用蒸馏水润洗过的试剂瓶中,相当于稀释了溶液,溶质质量分数偏小,故选项说法错误。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
故选:C。
A、利用溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、刚用蒸馏水润洗过的试剂瓶中含有水,进行分析判断。
D、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
7.??
解:需溶质质量为:100g×10%=10g,
①用质量为23.1g的烧杯盛放10g固体,在托盘天平上已放30g的砝码,游码应为3.1g,游码的左侧与3.1g处相齐;
②由于水需要100g-10g=90g,体积为90mL,选取量筒时选取比90大且最接近的,所以选取100mL的量筒,溶解时用到烧杯,还需要用玻璃棒搅拌,加速溶解.
(2)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.所以甲同学的配制顺序为④①⑤;
故答案为:(1)10;
①B;
②c;a;
(2)④①⑤。
(1)根据溶质质量=溶液质量×溶质质量分数进行解答;
①根据游码的读法进行分析;
②根据量筒量程的选取原则进行分析;根据溶解的过程考虑所用仪器进行分析.
(2)根据配制溶液的基本步骤来考虑操作顺序,分析解答.
通过解答本题知道了溶质、溶剂质量的计算方法,用天平称量时游码的使用方法和注意事项,掌握了量筒的选取方法和溶解的注意事项.
8.??
解:(1)用NaCl固体和蒸馏水配制溶液时,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和量筒;
(2)用浓溶液配制稀溶液时,计算的依据是稀释前后溶质的质量保持不变;
(3)A.将10gNaCl固体与100g水混合溶解,所得溶液中溶质的质量分数为:10/(10+100)*100%<10%,故错误;
B.向50g溶质的质量分数为20%的NaCl溶液中加入50g,所得溶液中溶质的质量分数为:50*20%/(50+50)*100%=10%,且溶液的质量为100g,故正确。
C、向20g溶质质量分数为20%的NaCl溶液中加入80g溶质质量分数为7.5%的NaCl溶液,所得溶液中溶质的质量分数为10%,且溶液的质量为100g,故正确;
故选:BC。
故答案为:(1)量筒;(2)溶质;(3)BC.
(1)根据配制溶液所需仪器来分析;
(2)根据溶液稀释过程中溶质的质量不变来分析;
(3)根据溶质质量分数的计算方法来分析。
掌握溶质的质量分数的计算式并会进行应用解决相关问题,了解溶液配制的注意事项等是解决此题的关键因素。
9.??
解:(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g(合95mL).应用规格为100mL的量筒量取水的体积.
用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。
(2)配制100g5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,该实验正确的操作顺序是④⑤①②③。
(3)使用托盘天平称量药品时应遵循“左物右码”,称量过程中发现指针偏左,说明药品质量大于砝码质量,说明氢氧化钠的质量大于砝码质量,应减少氢氧化钠,直至天平平衡。
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是加快溶解速率。
故答案为:
(1)95;D;小;
(2)A;
(3)B;
(4)加快溶解速率。
(1)利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析解答.
(2)根据配制溶质质量分数一定的溶液的基本步骤,进行分析解答.
(3)使用托盘天平称量药品时应遵循“左物右码”,称量过程中发现指针偏左,说明药品质量大于砝码质量,进行分析解答。
(4)根据溶解操作中搅拌的作用,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键.
10.??
解:(2)溶解过程中需要用到的仪器是烧杯和玻璃棒。玻璃棒的作用是搅拌,加快氯化钠的溶解速率;
(3)A.称量药品时药品和砝码放反,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故错误。
B.量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故错误。
C.溶于具有均一性,装瓶时洒出少量溶液,溶质质量分数不变,故正确。
(4)设用25%的氢氧化钠溶液的质量为x,根据溶液稀释前后溶质的质量不变,
则50g×6%=x×25%????? ?x=12g。
故答案为:(2)玻璃棒;
(3)AB;
(4)12。
(1)利用溶质质量=溶液质量×溶质的质量分数,进行分析解答。
(2)根据溶解操作所需的仪器,进行分析解答。
(3)溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因进行分析解答。
(4)根据溶液稀释前后溶质的质量不变,结合溶质质量=溶液质量×溶质的质量分数,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、注意事项等是正确解答本题的关键。
11.??
解:(1)操作E是溶解操作,玻璃棒的作用是搅拌,加快溶解速率。
(2)溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为12%的氯化钠溶液,需氯化钠的质量=100g×12%=12g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-12g=88g(合88mL);应用规格为100mL的量筒量取水的体积.
(3)A.称量的氯化钠中有少量杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
B.用于溶解的烧杯中残留有少量的水,会造成实际取的水的体积偏大,则使溶质质量分数偏小。
C.量取水时视线与应量体积的刻度及液体凹液面最低处保持水平,是正确的操作,不会影响该氯化钠溶液质量分数大小。
D.配完溶液装瓶时洒出一些溶液,溶液具有均一性,溶质质量分数不变。
故答案为:
(1)搅拌,加快溶解速率;
(2)100;
(3)AB。
(1)操作E是溶解操作,进行分析解答。
(2)利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析解答.
(3)根据溶质质量偏小(或偏大)或溶剂质量偏大(或偏小),分析出可能造成这两个方面错误的原因,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键.
12.??
解:(1)A.氢氧化钠具有腐蚀性,不能将氢氧化钠固体放在称量纸上称量,应放在玻璃器皿中称量,故选项说法错误。
B.称取氢氧化钠固体时,若指针偏左,说明药品的质量大于砝码质量,应减少药品,直至天平平衡,故选项说法错误。
C.配制50g溶质质量分数为14%的氢氧化钠溶液,需氢氧化钠的质量=50g×14%=7g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7g=43g(合43mL)。可用50mL量筒量取所需水的体积,故选项说法正确。
D.配制50g溶质质量分数为14%的氢氧化钠溶液,首先计算配制溶液所需氢氧化钠和水的质量,再称量所需的氢氧化钠和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒,故选项说法错误。
(2)用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏高。
故答案为:
(1)ABD;
(2)偏高。
(1)A、根据氢氧化钠具有腐蚀性,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,进行分析判断。
D、根据配制溶质质量分数一定的溶液的步骤,进行分析判断。
(2)用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析解答。
本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、量取、溶解)、注意事项等是正确解答本题的关键。
同课章节目录
